MG132: L’Inibitore “Nato per Caso” che Fa Tremare il Melanoma?
Ciao a tutti! Oggi voglio parlarvi di una scoperta che ha dell’incredibile, un po’ come trovare un tesoro nascosto mentre si cercava tutt’altro. Parliamo di melanoma, quel tipo di cancro della pelle piuttosto aggressivo e, purtroppo, ancora difficile da sconfiggere per molti pazienti, specialmente quando decide di “viaggiare” in giro per il corpo (metastasi).
Nonostante i passi da gigante fatti con le terapie moderne (inibitori BRAF/MEK, immunoterapia con anti-CTLA-4/PD-1, virus oncolitici), la bestia nera della resistenza ai farmaci è sempre dietro l’angolo. Le cellule tumorali sono maestre del trasformismo, cambiano pelle (geneticamente ed epigeneticamente) e diventano insensibili alle cure. Ecco perché la ricerca non si ferma mai, e siamo sempre alla caccia di nuove strategie. Ed è qui che entra in gioco il nostro protagonista inatteso: l’MG132.
Ma cos’è questo MG132 e perché ci interessa?
L’MG132 è un cosiddetto inibitore del proteasoma. Immaginate il proteasoma come l’inceneritore super efficiente delle nostre cellule: il suo compito è degradare le proteine vecchie, danneggiate o che semplicemente non servono più. È un meccanismo fondamentale per la vita della cellula. L’MG132, un tripeptide (una piccola catena di tre amminoacidi) che, pensate un po’, deriva da erbe cinesi, va a inceppare questo meccanismo, bloccando l’attività catalitica del proteasoma.
Perché bloccare l’inceneritore cellulare dovrebbe essere utile contro il cancro? Beh, le cellule tumorali si moltiplicano a tutta velocità e producono un sacco di proteine, anche anomale. Hanno un disperato bisogno che il proteasoma funzioni a pieno regime per eliminare “l’immondizia” proteica e le proteine che normalmente frenerebbero la loro crescita o innescherebbero la loro autodistruzione (apoptosi). Bloccando il proteasoma con l’MG132, si accumulano proteine “scomode” per la cellula tumorale, mandandola in tilt e spingendola verso l’apoptosi. Altri inibitori del proteasoma, come il Bortezomib, sono già usati in clinica, quindi l’idea non è nuova, ma capire *esattamente* come agisce l’MG132 sul melanoma era un territorio ancora poco esplorato.
La scoperta “per caso” che ha cambiato tutto
E qui arriva il bello! Sembra che il potenziale anti-melanoma dell’MG132 sia saltato fuori quasi per sbaglio. Inizialmente, il gruppo di ricerca che ha pubblicato lo studio da cui prendiamo spunto (trovate il link alla fine!) aveva notato un effetto sorprendente dell’MG132: uno spiccato potere sbiancante sulla pelle. Curioso, no? Ma la vera sorpresa è arrivata dopo: per una serie di eventi fortuiti, si sono accorti che questa molecola era incredibilmente efficace nell’indurre la morte programmata (apoptosi) proprio nelle cellule di melanoma A375, una linea cellulare comunemente usata negli studi su questo tumore. I test di citotossicità hanno rivelato una potenza notevole (un valore chiamato IC50 di 1.258 µM, che indica la concentrazione necessaria per uccidere metà delle cellule). Non solo, si è visto che l’MG132 era efficace anche contro altre linee cellulari tumorali (A549 polmone, MCF-7 seno, Hela cervice). Insomma, da un effetto sbiancante a un potenziale killer di tumori!
Cosa fa esattamente l’MG132 alle cellule di melanoma A375?
Una volta fiutata la pista giusta, i ricercatori si sono messi al lavoro per capire meglio. Hanno usato un arsenale di tecniche:
- Test di vitalità (CCK8): Hanno confermato che l’MG132 uccide le cellule A375 in modo dipendente sia dalla dose che dal tempo di esposizione. Più MG132 dai, e per più tempo lo lasci agire, meno cellule sopravvivono.
- Saggio di guarigione della ferita (Wound Healing): Hanno “graffiato” uno strato di cellule e visto quanto tempo ci mettevano a richiudere il “buco”. L’MG132 ha messo i bastoni tra le ruote alla grande: a concentrazioni terapeutiche, ha bloccato significativamente la migrazione delle cellule. A 0.25 µM dopo 12 ore, l’inibizione era 52 volte maggiore rispetto al controllo! E dopo 36 ore, a 0.25 o 0.5 µM, la migrazione era praticamente azzerata. Questo è importantissimo, perché la capacità di migrare è legata alla capacità del tumore di formare metastasi.
- Citometria a flusso (Apoptosi): Hanno misurato quanta apoptosi (morte cellulare programmata) induceva l’MG132. I risultati sono stati netti: dopo 24 ore, con 2 µM di MG132, ben il 46.5% delle cellule era in apoptosi precoce e l’85.5% mostrava segni di apoptosi totale (precoce + tardiva). Un vero massacro, in senso buono per la terapia!
- Citometria a flusso (Ciclo cellulare): Hanno anche visto che l’MG132 blocca le cellule in una fase specifica del loro ciclo di vita, la fase G2, impedendo loro di dividersi ulteriormente.

Svelare i meccanismi: come fa l’MG132 a scatenare l’inferno nelle cellule tumorali?
Ok, abbiamo visto che l’MG132 uccide le cellule di melanoma e ne blocca la migrazione. Ma *come* ci riesce? Qui la faccenda si fa ancora più interessante. I ricercatori hanno usato la tecnica del Western Blot per “fotografare” i livelli di proteine chiave all’interno delle cellule trattate. Hanno scoperto che l’MG132 agisce su due fronti principali:
1. La via p53/p21/caspase-3: L’MG132 inibisce una proteina chiamata MDM2. MDM2 è un po’ il “sorvegliante” di p53, una proteina importantissima nota come “guardiano del genoma”. Normalmente, MDM2 marca p53 per la distruzione nel proteasoma. Bloccando MDM2 (e il proteasoma stesso), l’MG132 fa accumulare p53. p53 attivata fa due cose:
* Accende p21, che frena il ciclo cellulare (ecco spiegato l’arresto in G2!).
* Attiva la cascata delle caspasi (in particolare la caspasi-3), che sono gli “esecutori materiali” dell’apoptosi.
In più, l’MG132 riduce i livelli di Bcl2, una proteina che *protegge* dalla apoptosi, e di CDK2, un’altra proteina che spinge il ciclo cellulare. Insomma, toglie i freni all’apoptosi e mette il blocco alla divisione cellulare.
2. L’attivazione della via MAPK: Questa è stata una scoperta cruciale. La via MAPK è una rete complessa di segnali dentro la cellula. A seconda del contesto, può promuovere la crescita o, come in questo caso, la morte. L’MG132 ha causato un aumento dose-dipendente delle forme attivate (fosforilate) di tre attori chiave della via MAPK: ERK, JNK e p38. Sembra che proprio l’attivazione di questa via sia un motore fondamentale per l’apoptosi indotta da MG132 nel melanoma.
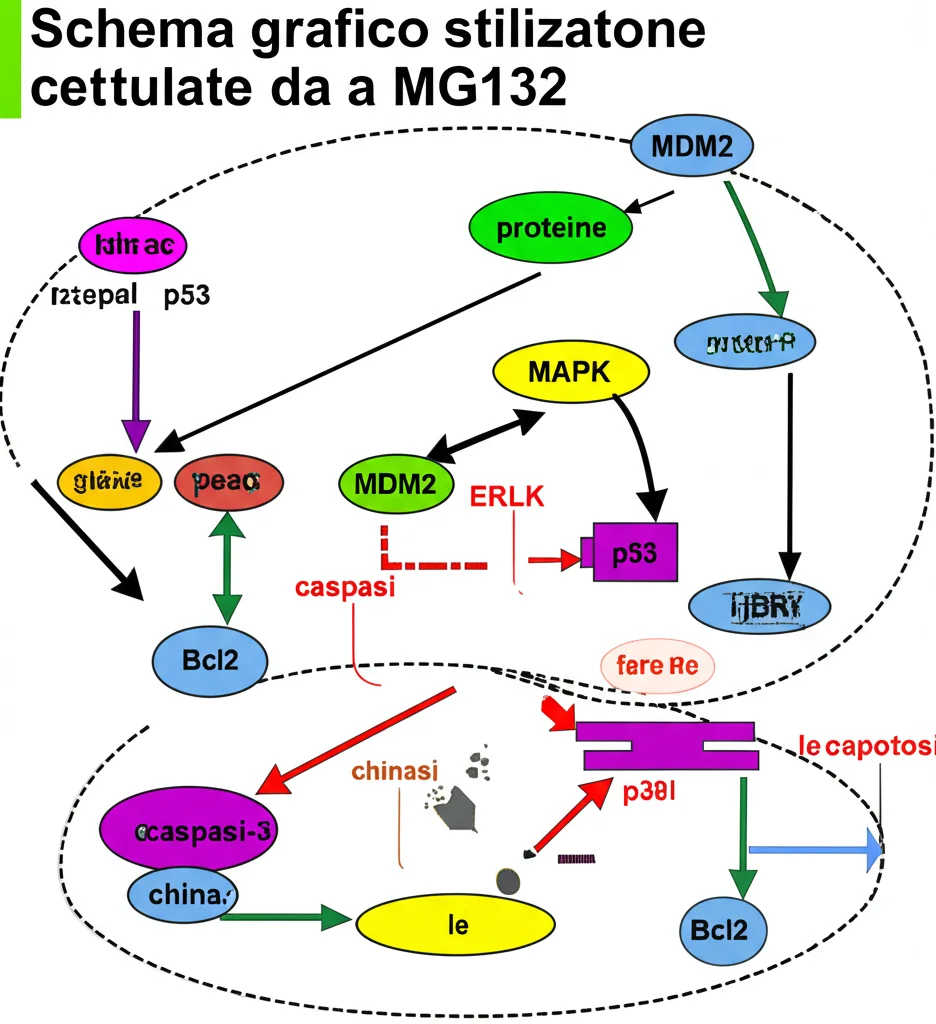
Quindi, l’MG132 non colpisce un solo bersaglio, ma agisce come un agente multi-tasking, disturbando la proliferazione e attivando contemporaneamente la macchina della morte cellulare attraverso vie diverse.
Cosa significa tutto questo per il futuro della lotta al melanoma?
Questa ricerca è davvero promettente. Ci dice che l’MG132 ha le carte in regola per essere considerato un potenziale farmaco anti-melanoma. Il fatto che agisca su più fronti è un vantaggio: rende più difficile per le cellule tumorali sviluppare resistenza.
In particolare, la scoperta che la via MAPK sia così importante nell’apoptosi indotta da MG132 apre scenari interessanti. Si potrebbe pensare a terapie combinate: usare l’MG132 insieme ad altri farmaci che magari colpiscono proprio la via MAPK o altre vie complementari, per ottenere un effetto sinergico ancora più potente.
Certo, siamo ancora agli inizi. Come ammettono gli stessi ricercatori, questo studio è stato fatto in vitro (su cellule in coltura) e solo sulla linea A375. Bisognerà verificare questi risultati su altre linee cellulari di melanoma, condurre esperimenti in vivo (su modelli animali) per vedere se l’effetto si conferma e per valutare la tossicità, e magari lavorare sulla molecola stessa per migliorarne le caratteristiche farmacologiche.
Ma la strada è tracciata. Quella che era iniziata come un’osservazione casuale su un effetto sbiancante si è trasformata nella scoperta di un meccanismo affascinante con cui una molecola naturale può mettere KO le cellule di melanoma. Non è fantastico? Continueremo a seguire gli sviluppi!
Fonte: Springer