Cancro al Seno: Una Nuova ‘Spia’ Radioattiva Semplificata per Scovare il Nemico
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona tantissimo: la lotta contro il cancro, in particolare quello al seno, e di come la ricerca stia facendo passi da gigante per renderla più efficace. Sapete, il cancro al seno è il tumore più diffuso tra le donne a livello globale. Pensate che solo negli Stati Uniti, nel 2023, si stimava che quasi 300.000 donne avrebbero ricevuto una diagnosi di cancro al seno invasivo. Numeri che fanno riflettere, vero?
Le terapie principali, come chirurgia, radioterapia e chemioterapia, sono fondamentali, ma hanno i loro limiti. La chirurgia non sempre elimina tutto, e le altre due possono essere piuttosto tossiche. Per fortuna, negli ultimi anni sono emerse terapie mirate, che colpiscono specifici “bersagli” sulle cellule tumorali, come i recettori per estrogeni, progesterone o HER2. Queste funzionano alla grande per molti tipi di cancro al seno, ma c’è un’eccezione ostica: il cancro al seno triplo negativo. Qui, queste terapie mirate servono a poco.
Il Ruolo Chiave degli Inibitori PARP
Spesso, nel cancro triplo negativo (e non solo), troviamo mutazioni nei geni BRCA1 e BRCA2. Questi geni sono come dei meccanici super specializzati nel riparare i danni al nostro DNA. Quando non funzionano bene, le cellule possono iniziare a moltiplicarsi senza controllo. Ed ecco che entra in gioco un altro attore: l’enzima PARP (poli ADP-ribosio polimerasi). Si è scoperto che nei tumori legati a mutazioni BRCA, questo enzima è spesso sovraespresso, cioè ce n’è troppo.
Dal 2005 circa, si è capito che bloccare questo enzima PARP con farmaci specifici, chiamati inibitori PARP, poteva essere una strategia vincente, specialmente nei tumori con geni BRCA difettosi. Questi farmaci sono così promettenti che alcuni sono già stati approvati e vengono usati sia da soli che in combinazione con chemio o radioterapia. Funzionano un po’ come togliere l’ultima ruota di scorta a una cellula tumorale già in difficoltà nel riparare il proprio DNA.
La Sfida: Vedere Dove Agire
Fantastico, direte voi! Abbiamo un’arma efficace. Sì, ma c’è un “ma”. Per usare al meglio gli inibitori PARP, dobbiamo sapere quali tumori hanno effettivamente alti livelli di questo enzima. Non tutti i tumori sono uguali! Come facciamo a “vedere” il PARP dentro il corpo, senza dover fare biopsie invasive ogni volta?
Qui entra in gioco la medicina nucleare e i cosiddetti radiotraccianti. Immaginate delle “spie” molecolari che si legano specificamente al PARP e che sono “marcate” con un atomo radioattivo. Iniettandole nel paziente, possiamo poi usare tecniche di imaging come la PET (Tomografia a Emissione di Positroni) o la SPECT (Tomografia a Emissione di Singolo Fotone) per vedere dove queste spie si accumulano, e quindi dove c’è tanto PARP.
Tra questi traccianti, uno molto studiato è il KX1, un derivato di un altro farmaco (rucaparib), marcato con Iodio-125 (I-125) o Iodio-123 (I-123). Ha dimostrato di funzionare bene nel “fotografare” il PARP-1 (la forma più abbondante dell’enzima) in cellule tumorali e in piccoli animali. La PET offre immagini più definite, ma i traccianti PET spesso richiedono un ciclotrone (un acceleratore di particelle) e hanno vita breve, limitandone l’uso. I traccianti iodati per SPECT, come il nostro I-123-KX1, sono potenzialmente più accessibili.
Il Problema della Preparazione: Troppo Lenta!
C’è un intoppo: preparare questi traccianti radioiodati, come l’I-125-KX1, è tradizionalmente un processo lungo e macchinoso. Richiede passaggi complessi, come la purificazione tramite HPLC (Cromatografia Liquida ad Alte Prestazioni) semipreparativa, che porta via un sacco di tempo. Questo non è l’ideale, specialmente se si pensa a un uso più diffuso in laboratorio o, in futuro, in clinica.
La Nostra Idea: Semplificare con l’SPE
Ed ecco dove entra in gioco il nostro lavoro. Ci siamo chiesti: non c’è un modo più semplice e veloce? Ispirandoci a tecniche usate per altri radiotraccianti, abbiamo pensato di usare una tecnica chiamata Estrazione in Fase Solida (SPE) con delle cartucce C18. Immaginatele come dei piccoli filtri super-selettivi.
Abbiamo modificato la procedura standard di marcatura del KX1 con Iodio-123 o Iodio-125, sostituendo il lungo passaggio di HPLC con una rapida purificazione su cartuccia SPE. In pratica:
- Abbiamo preso il precursore del KX1 (la molecola di partenza).
- Lo abbiamo fatto reagire con lo Iodio radioattivo (Na123I o Na125I) a temperatura ambiente per soli 10 minuti.
- Abbiamo bloccato la reazione e neutralizzato il tutto.
- Abbiamo caricato la miscela grezza sulla cartuccia SPE C18 (precedentemente attivata).
- Abbiamo lavato via lo iodio non reagito e le impurità con soluzioni di etanolo a bassa concentrazione.
- Infine, abbiamo recuperato il nostro I-123/125-KX1 puro eluendolo con etanolo al 100%.
Il risultato? L’intera procedura di marcatura e purificazione ora richiede meno di 30 minuti! Un bel risparmio di tempo, no?
Ma Funziona Ancora? I Test di Laboratorio
Ok, abbiamo un metodo veloce, ma il prodotto finale è di buona qualità? Mantiene le sue proprietà? Abbiamo fatto un bel po’ di test per verificarlo.
Purezza e Resa: Prima di tutto, abbiamo controllato la purezza radiochimica con l’HPLC analitico: eccellente, superiore al 99%! Anche la resa radiochimica (quanto prodotto utile otteniamo rispetto a quanto radioisotopo usiamo) è stata buona: circa il 59% per l’I-123-KX1 e il 73% per l’I-125-KX1, valori paragonabili a quelli ottenuti con il metodo tradizionale.
Legame al Bersaglio: La cosa più importante: il nostro KX1 “semplificato” si lega ancora specificamente al PARP-1? Abbiamo usato due linee cellulari di cancro al seno: MDA-MB-231 (note per avere più PARP-1) e MCF-7 (con meno PARP-1).
- Abbiamo prima confermato con una tecnica chiamata Western Blot che le cellule MDA-MB-231 avevano effettivamente circa 1.8 volte più PARP-1 delle MCF-7.
- Poi, abbiamo fatto dei saggi di legame usando membrane cellulari e il nostro I-125-KX1. Abbiamo misurato due parametri chiave: la Kd (che indica l’affinità di legame: più è bassa, meglio si lega) e la Bmax (che indica la quantità massima di siti di legame disponibili, cioè quanto PARP-1 c’è).
I risultati? La Kd era ottima (circa 1.0-1.4 nM), simile a quella riportata in letteratura con il metodo classico. E, cosa importantissima, la Bmax era significativamente più alta nelle cellule MDA-MB-231 rispetto alle MCF-7 (circa 1.45 volte di più), rispecchiando perfettamente i livelli di PARP-1 visti con il Western Blot! Questo ci ha confermato che il nostro I-125-KX1 preparato rapidamente mantiene la sua capacità di legarsi specificamente al PARP-1 e di quantificarne le differenze.
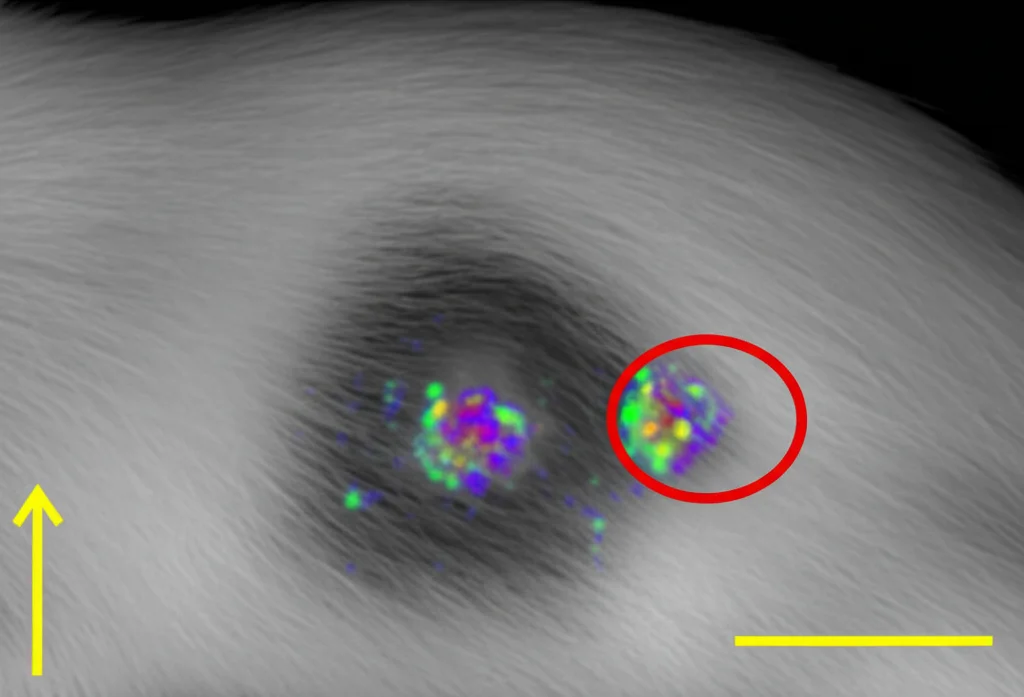
La Prova del Nove: L’Imaging In Vivo
Bello il lavoro in provetta, ma come si comporta il nostro tracciante in un organismo vivente? Abbiamo preso dei topi a cui avevamo fatto crescere tumori derivati dalle cellule MDA-MB-231. Abbiamo iniettato loro l’I-123-KX1 preparato con il nostro metodo semplificato e poi abbiamo usato la SPECT/CT per vedere dove andava a finire.
Le immagini erano chiare: il tracciante si accumulava in modo significativo nel tumore! Abbiamo misurato l’uptake: nel tumore era circa 6.9 %ID/mL (percentuale della dose iniettata per millilitro di tessuto), mentre nel muscolo adiacente era solo 3.1 %ID/mL. Questo ci dà un rapporto tumore/muscolo di circa 2.3, un buon segnale di specificità. È interessante notare che questo rapporto sembra persino migliore di quello riportato in altri studi che usavano I-123-KX1 purificato con HPLC su modelli diversi, o altri traccianti simili. Questo suggerisce che il nostro metodo semplificato potrebbe essere davvero vantaggioso per l’imaging SPECT.
Ulteriori Conferme: Autoradiografia e Immunoistochimica
Per essere sicuri al 100% della specificità, abbiamo fatto altri due esperimenti su fettine sottili del tumore prelevato dai topi.
Autoradiografia: Abbiamo incubato queste fettine con l’I-125-KX1. Poi, in alcune fettine, abbiamo aggiunto anche altri inibitori PARP noti (olaparib, veliparib, ecc.) o il KX1 non radioattivo. Risultato: dove c’erano gli altri inibitori, il nostro I-125-KX1 non riusciva a legarsi. Questo fenomeno, chiamato “blocking” o competizione, dimostra che si lega proprio agli stessi siti specifici del PARP-1 a cui si legano gli altri farmaci.
Immunoistochimica (IHC): Su fettine adiacenti, abbiamo usato un anticorpo che colora specificamente il PARP-1. Abbiamo visto che le zone colorate dall’anticorpo corrispondevano perfettamente alle zone dove si era accumulato il nostro I-125-KX1 nell’autoradiografia. Una conferma visiva diretta!
Cosa Significa Tutto Questo?
Il nostro studio dimostra che è possibile preparare un tracciante radioiodato per PARP-1 (I-123/125-KX1) in modo molto più rapido e semplice, usando la purificazione SPE invece della complessa HPLC, senza comprometterne la qualità, la purezza, l’affinità di legame o la specificità. Il tracciante preparato con questo metodo “smart” funziona bene sia in vitro che in vivo per visualizzare e quantificare il PARP-1 nei modelli di cancro al seno.
Questo apre le porte a un uso più agevole di questo tipo di traccianti nella ricerca, per studiare meglio il ruolo del PARP nei tumori e per testare nuovi farmaci. E chissà, forse in futuro potrebbe facilitare anche lo sviluppo di strumenti diagnostici per selezionare meglio i pazienti che possono beneficiare maggiormente delle terapie con inibitori PARP. Certo, serviranno ulteriori studi per confermarne appieno l’efficacia, ma la strada sembra promettente! È emozionante contribuire, anche con un piccolo passo come la semplificazione di una procedura, alla grande sfida della lotta contro il cancro.
Fonte: Springer