Orzo Magico: Come il DNA si ‘Accende’ e ‘Spegne’ per Creare Nuove Piante dal Nulla!
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel cuore delle piante, più precisamente nell’orzo, uno dei cereali più importanti al mondo. Avete mai pensato a come sia possibile, partendo da un piccolo pezzo di tessuto vegetale, far crescere una pianta intera in laboratorio? Sembra quasi magia, vero? Beh, una parte fondamentale di questo processo “magico”, chiamato coltura tissutale, è la formazione del callo. Immaginatelo come una massa di cellule vegetali non specializzate, un po’ come le cellule staminali negli animali, che hanno il potenziale per rigenerare un’intera pianta.
La Sfida dell’Orzo e il Mistero del Callo
L’orzo, pur essendo il quarto cereale più coltivato, è un po’ “timido” quando si tratta di coltura in vitro. Non tutte le varietà rispondono bene, e trasformarlo geneticamente (cioè inserire nuovi geni utili) è spesso un’impresa ardua, limitata principalmente all’uso di embrioni immaturi. La varietà ‘Golden Promise’ è una delle poche “star” che collabora di più. Capire come si forma il callo e come acquisisce la capacità di rigenerare (la pluripotenza) è quindi cruciale se vogliamo migliorare queste tecniche e rendere l’orzo più forte, produttivo o resistente.
Studi su altre piante, come l’Arabidopsis (una specie di “topo da laboratorio” del mondo vegetale), ci hanno già svelato alcuni segreti. Sappiamo che gli ormoni vegetali, come l’auxina, giocano un ruolo chiave nell’attivare specifici geni (come i LBD e i WOX) che spingono le cellule a dividersi e a riprogrammarsi. Ma c’è di più sotto la superficie…
L’Epigenetica Entra in Scena: I Segreti Nascosti nel DNA
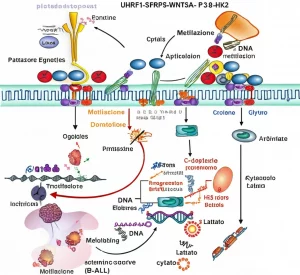
Qui entra in gioco un campo affascinante: l’epigenetica. Non si tratta di cambiare la sequenza del DNA in sé, ma di come questa sequenza viene “letta” e utilizzata dalla cellula. Uno dei meccanismi epigenetici più studiati è la metilazione del DNA. Immaginate delle piccole etichette chimiche (gruppi metile, -CH3) che si attaccano al DNA in punti specifici. Queste etichette possono agire come interruttori, accendendo o spegnendo i geni vicini, senza alterarne il codice. Nelle piante, questa metilazione avviene in tre “contesti” di sequenza: CG, CHG e CHH.
Già in passato, la nostra ricerca [30] aveva suggerito che proprio questi meccanismi epigenetici potessero influenzare la formazione del callo e la capacità rigenerativa nell’orzo, ma i dettagli erano ancora nebulosi. Come funzionava esattamente questo processo? Quali geni venivano “accesi” o “spenti” dalla metilazione durante la trasformazione di un embrione immaturo in callo?
La Nostra Indagine: Spiare il DNA e i Suoi Messaggeri
Per rispondere a queste domande, abbiamo deciso di usare due tecniche potentissime:
- RNA sequencing (RNA-seq): Per “ascoltare” quali geni erano attivi (trascritti in RNA messaggero) e quanto lo erano, in diversi momenti della formazione del callo.
- Whole-genome bisulfite sequencing (WGBS): Per creare una mappa dettagliata della metilazione su tutto il genoma dell’orzo, confrontando gli embrioni iniziali (giorno 0) con il callo formatosi dopo 9 giorni.
Abbiamo usato la varietà ‘Golden Promise’, la più collaborativa, per massimizzare le nostre possibilità di successo.
Cosa Abbiamo Scoperto: Un Leggero “Reset” Epigenetico
I risultati sono stati illuminanti! Abbiamo osservato che, durante i 9 giorni di induzione del callo, il livello generale di metilazione del DNA diminuiva leggermente. In particolare, la metilazione nel contesto CHH (quella più dinamica e spesso associata al silenziamento di elementi trasponibili, i “geni saltellanti”) mostrava la variazione più significativa, diminuendo. Al contrario, i livelli relativi di metilazione CG e CHG sembravano aumentare leggermente rispetto al totale delle citosine metilate, anche se il livello assoluto di mCHG rimaneva stabile e quello di mCG diminuiva leggermente nel complesso.

Abbiamo anche notato che le regioni ricche di geni tendevano ad avere bassi livelli di metilazione, mentre quelle ricche di elementi trasponibili (TEs) ne avevano alti livelli, un pattern tipico nelle piante, mantenuto anche nel callo.
Il Legame Cruciale: Metilazione e Attività dei Geni
Ma la parte più eccitante è stata collegare questi cambiamenti nella metilazione all’attività dei geni (misurata con RNA-seq). Abbiamo identificato migliaia di geni la cui attività cambiava significativamente durante la formazione del callo (i cosiddetti Differentially Expressed Genes, DEGs). Poi siamo andati a cercare quali di questi DEGs si trovavano vicino a regioni del DNA che avevano cambiato il loro stato di metilazione (le Differentially Methylated Regions, DMRs).
Bingo! Abbiamo trovato centinaia, persino migliaia, di geni la cui espressione sembrava legata a cambiamenti nella metilazione nelle vicinanze, specialmente nel contesto CHH (oltre 2000 geni!). In particolare, abbiamo notato una tendenza interessante: molti geni che diventavano più attivi nel callo mostravano una diminuzione della metilazione nella loro regione promotore (la zona che controlla l’accensione del gene), soprattutto nei contesti CG e CHH. Al contrario, anche molti geni che venivano “spenti” mostravano una riduzione della metilazione CHH nel promotore, suggerendo meccanismi regolatori complessi.
Geni Chiave Sotto Controllo Epigenetico
Ci siamo concentrati su geni noti per essere importanti nella rigenerazione e nello sviluppo delle piante. E qui abbiamo trovato conferme importanti! Geni cruciali come:
- HvKRP4 e HvCYCD1;1 (coinvolti nel controllo del ciclo cellulare)
- HvSCR e HvSHR (importanti per l’identità delle cellule meristematiche, le “fabbriche” di nuove cellule)
- HvWOX5 (un marcatore delle cellule staminali della radice, coinvolto nell’acquisizione della pluripotenza nel callo)
- HvRAP2.6L/ERF113 e HvWIND4 (legati alla risposta alle ferite e alla riprogrammazione cellulare)
- HvE2Fa (un altro regolatore del ciclo cellulare)
- HvLBD16 (coinvolto nella risposta all’auxina e nella formazione di organi laterali)
Tutti questi geni, che si attivavano significativamente durante la formazione del callo, mostravano una correlazione negativa tra la loro attività e il livello di metilazione nelle loro regioni promotore. In pratica: meno metilazione nel promotore, più il gene era attivo. Questo suggerisce fortemente che la metilazione del DNA agisca come un freno molecolare, e che rimuovere questo freno sia necessario per attivare i programmi genetici che portano alla formazione del callo e alla rigenerazione.

La Prova del Nove: Bloccare la Metilazione
Per confermare il ruolo regolatorio della metilazione, abbiamo fatto un esperimento “di disturbo”. Abbiamo trattato gli embrioni immaturi con una sostanza chimica, la 5-Aza-2′-deossicitidina (5-Aza-dC), che è un noto inibitore delle DNA metiltransferasi (gli enzimi che attaccano le etichette di metile al DNA). Come previsto, il trattamento ha ridotto drasticamente i livelli di metilazione nel DNA degli espianti. E qual è stato l’effetto sulla formazione del callo? È stata soppressa! I calli trattati crescevano molto meno rispetto a quelli di controllo.
Analizzando l’attività genica nei campioni trattati, abbiamo visto che l’inibizione della metilazione alterava l’espressione di migliaia di geni, in particolare quelli legati al ciclo cellulare e alla risposta all’acido abscissico (ABA), un altro ormone vegetale importante. Sembra che un livello “giusto” di metilazione e i suoi cambiamenti dinamici siano essenziali per orchestrare correttamente questi processi fondamentali per la proliferazione e la riprogrammazione cellulare che avvengono durante la formazione del callo. Un “reset” troppo drastico, indotto dalla 5-Aza-dC, manda in tilt il sistema.
Cosa Significa Tutto Questo?
Il nostro studio getta nuova luce sulla complessa danza tra epigenetica ed espressione genica durante un processo vitale per le biotecnologie vegetali come la formazione del callo nell’orzo. Abbiamo dimostrato che i cambiamenti dinamici nella metilazione del DNA non sono casuali, ma svolgono un ruolo regolatorio preciso, in particolare “sbloccando” geni chiave necessari per la dedifferenziazione cellulare e l’acquisizione della pluripotenza.
Questa conoscenza è preziosa. Capire come la metilazione controlla questi geni potrebbe aprirci la strada a nuove strategie per “convincere” anche le varietà di orzo più recalcitranti a rigenerare in vitro. Immaginate di poter “sintonizzare” lo stato di metilazione di geni specifici per migliorare l’efficienza della trasformazione genetica!
Certo, la metilazione non è l’unico attore epigenetico in gioco. Altri meccanismi, come le modifiche degli istoni (le proteine attorno cui si avvolge il DNA) e l’accessibilità della cromatina, probabilmente collaborano in questa complessa regolazione. Il prossimo passo sarà esplorare anche queste interazioni per avere un quadro ancora più completo.
Ma per ora, possiamo dire di aver aggiunto un tassello importante alla comprensione di come l’orzo, e forse molte altre piante, utilizzino questi affascinanti meccanismi epigenetici per compiere la “magia” della rigenerazione.
Fonte: Springer