Vecchi Farmaci, Nuova Speranza per la Leucemia: Metformina e Clorochina Stravolgono le Cure!
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi sta davvero a cuore e che potrebbe rappresentare una svolta importante nella lotta contro una malattia terribile: la leucemia linfoblastica acuta (LLA), il tumore più comune tra i bambini. Nonostante i progressi, le ricadute sono ancora troppo frequenti e la tossicità delle cure impatta pesantemente sulla qualità di vita dei piccoli pazienti. Ma se vi dicessi che farmaci già noti, usati per tutt’altro, potrebbero darci una mano potentissima? È il concetto affascinante del “drug repositioning”, ovvero trovare nuove vite per vecchi farmaci. Ebbene, sembra proprio che due di questi, la metformina e la clorochina, possano fare faville se abbinate alla citarabina, un chemioterapico standard. Pronti a scoprire come?
LLA: Un Nemico Insidioso, Soprattutto per i Più Piccoli
La leucemia linfoblastica acuta a precursori delle cellule B (B-ALL) è la forma più diffusa, costituendo l’85% dei casi pediatrici. Uno dei pilastri della terapia è la citarabina (AraC), ma spesso le cellule tumorali sviluppano resistenza. Immaginate la frustrazione: si combatte con tutte le forze, ma il nemico a volte ritorna più forte di prima. Infatti, i tassi di recidiva restano alti, e per chi ha una forma recidivante o refrattaria, le speranze di remissione crollano drasticamente, con una sopravvivenza a cinque anni di appena il 20%. È chiaro che c’è un bisogno disperato di nuove strategie terapeutiche.
Drug Repositioning: L’Arte di Reinventare i Farmaci
Ed è qui che entra in gioco il drug repositioning. Pensateci: prendere farmaci già approvati, di cui conosciamo bene gli effetti e la sicurezza, e testarli per nuove indicazioni. Un vantaggio enorme è la riduzione del rischio di fallimento terapeutico dovuto a effetti avversi imprevisti. Due candidati molto promettenti in questo campo sono la metformina e la clorochina.
- La metformina, conosciuta da tutti come farmaco per il diabete di tipo 2 (l’OMS la considera un farmaco essenziale!), ha dimostrato di poter indurre l’arresto del ciclo cellulare e l’apoptosi (una sorta di suicidio programmato) nelle cellule leucemiche. Sembra che potenzi la sensibilità alla chemio sopprimendo una via di segnalazione chiamata AKT-mTOR.
- La clorochina, usata comunemente contro la malaria e le malattie infiammatorie, ha rivelato un potenziale antitumorale inibendo l’autofagia (un meccanismo di “pulizia” cellulare che le cellule tumorali sfruttano per sopravvivere) e inducendo l’apoptosi.
Le ricadute nella B-ALL sono spesso legate a problemi nell’attivazione dell’apoptosi e all’iperattivazione del sistema RAS, una famiglia di geni che regola la crescita cellulare. Visto che metformina e clorochina agiscono proprio su questi meccanismi, l’idea di combinarli con la citarabina è diventata la nostra ipotesi di lavoro: potenziare l’efficacia della chemio, magari riducendone la dose e quindi la tossicità.
I Risultati in Laboratorio: Cosa Abbiamo Visto sulle Cellule NALM-6
Per testare la nostra idea, abbiamo usato una linea cellulare di B-ALL chiamata NALM-6. E i risultati sono stati davvero incoraggianti!
Inibizione della crescita e sinergia: Abbiamo visto che sia la metformina (Met) che la clorochina (CQ), da sole o in combinazione con la citarabina (AraC), inibivano la proliferazione delle cellule NALM-6 in modo dose-dipendente. Ma la cosa più interessante è che le combinazioni AraC+Met e AraC+CQ erano molto più efficaci nell’inibire la crescita rispetto ai farmaci usati singolarmente, anche a dosi più basse di AraC! Questo suggerisce un effetto sinergico (CI < 1, per i più tecnici). E, cosa fondamentale, la vitalità delle cellule sane (fibroblasti dermici umani, HDF) trattate con le stesse combinazioni era significativamente maggiore rispetto a quella delle cellule leucemiche. Un'ottima notizia!
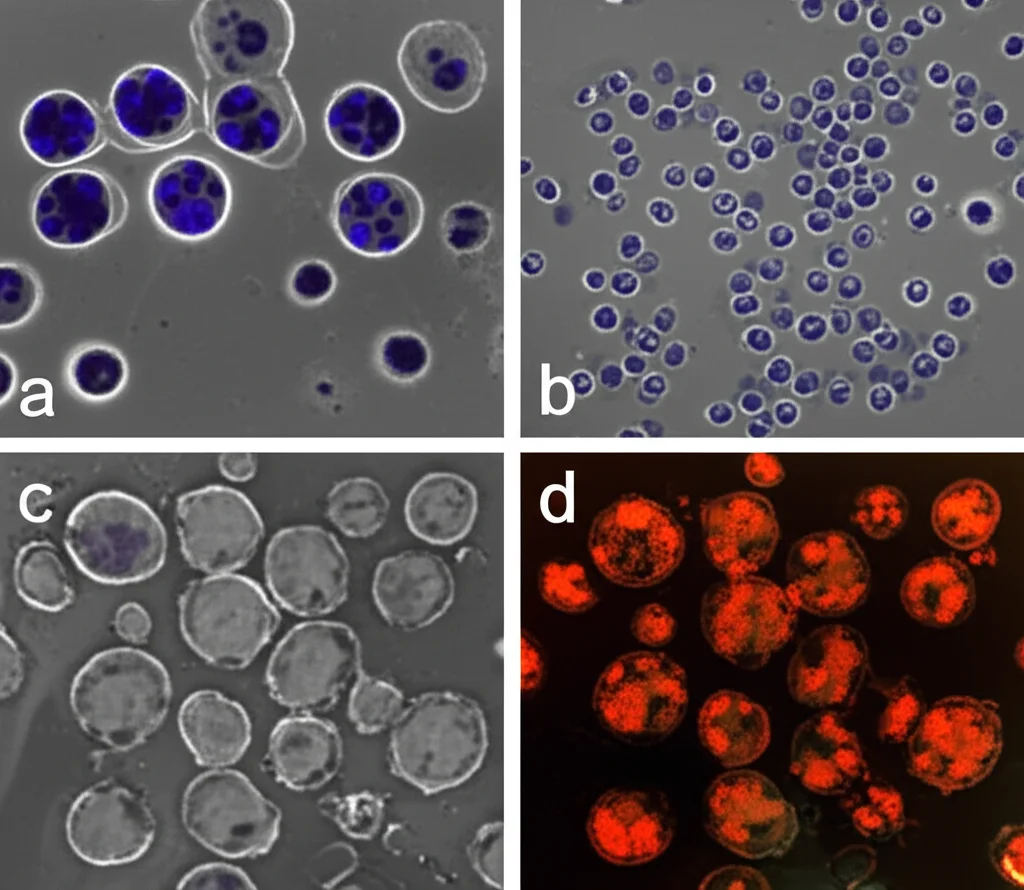
Meno colonie, meno “radici” del tumore: Un altro test importante è quello della formazione di colonie, che misura la capacità delle cellule tumorali di rigenerarsi e dare origine a nuove “popolazioni”. Anche qui, le combinazioni AraC+Met e AraC+CQ hanno ridotto significativamente il numero di colonie formate dalle cellule NALM-6 rispetto ai trattamenti singoli. È come se avessimo indebolito la capacità del tumore di mettere radici.
Apoptosi e Ciclo Cellulare: Spingere le Cellule Malate verso l’Autodistruzione
Abbiamo poi voluto capire come questi farmaci agissero. Uno dei meccanismi chiave è l’apoptosi. Utilizzando la citometria a flusso, abbiamo visto che la percentuale di cellule NALM-6 in apoptosi era maggiore in tutti i gruppi trattati rispetto al controllo, ma l’incremento era decisamente più marcato nei gruppi AraC+Met e AraC+CQ. Insomma, la combinazione spingeva più efficacemente le cellule leucemiche verso il “suicidio”.
Non solo: abbiamo analizzato anche il ciclo cellulare. Le cellule tumorali si dividono forsennatamente. Le nostre combinazioni hanno aumentato il numero di cellule bloccate nella fase G0/G1 del ciclo, una fase di “riposo” che precede la duplicazione del DNA. In pratica, abbiamo messo un freno alla loro corsa sfrenata alla proliferazione, soprattutto con AraC+Met, che ha anche mostrato la più bassa percentuale di cellule nella fase G2/M (quella subito prima della divisione).
Stress Ossidativo: Un’Arma a Doppio Taglio Modulata dalla Terapia
Lo stress ossidativo è un altro meccanismo molecolare attraverso cui i farmaci possono esercitare la loro tossicità e indurre apoptosi. Abbiamo misurato i livelli di malondialdeide (MDA), un marcatore di danno lipidico dovuto allo stress ossidativo. I livelli di MDA aumentavano con tutti i trattamenti, e ancora di più con le combinazioni AraC+Met e AraC+CQ.
Potrebbe sembrare una contraddizione, ma abbiamo anche misurato la capacità antiossidante totale (TAC) delle cellule. Qui la storia si fa interessante:
- La metformina da sola aumentava significativamente la TAC.
- AraC e CQ da sole non mostravano cambiamenti significativi.
- Le combinazioni AraC+Met e AraC+CQ potenziavano la TAC, con CQ+AraC che mostrava l’attività antiossidante più alta!
Questo indica che metformina e clorochina potrebbero aiutare a mitigare parte dello stress ossidativo indotto da AraC, pur contribuendo all’effetto antitumorale. È un equilibrio delicato. Anche i livelli di glutatione (GSH), un antiossidante cellulare cruciale, hanno mostrato un andamento simile: Met li aumentava, CQ e AraC li riducevano, ma le combinazioni li ripristinavano parzialmente. Questo suggerisce che la metformina, in particolare, protegge le riserve antiossidanti cellulari.

I Geni Coinvolti: Cosa Succede a Livello Molecolare?
Per capire ancora più a fondo, siamo andati a vedere l’espressione di alcuni geni chiave. E qui le conferme sono state nette:
- L’espressione dei geni pro-apoptotici TP53 (un famoso oncosoppressore), CASP3 (un effettore dell’apoptosi) e CASP8 (un iniziatore dell’apoptosi) aumentava con tutti e tre i trattamenti, ma in modo più marcato con le combinazioni AraC+Met e AraC+CQ.
- Al contrario, l’espressione del gene anti-apoptotico Bcl-2 diminuiva.
- Infine, anche l’espressione dei geni di segnalazione KRAS e NRAS, spesso implicati nella crescita tumorale e nella resistenza, diminuiva significativamente con i co-trattamenti rispetto ad AraC da solo.
Questi dati, confermati anche a livello proteico con Western blot per P53, BCL2 e CASP8, ci dicono che la combinazione di questi farmaci sposta l’equilibrio cellulare verso uno stato pro-apoptotico e riduce i segnali che spingono alla proliferazione.
Interpretazione dei Risultati: Perché Questa Combinazione Funziona?
Sembra che la metformina contribuisca attivando la via dell’AMPK, che può stabilizzare p53 e potenziare le sue funzioni pro-apoptotiche. Inoltre, la metformina può alterare il metabolismo energetico delle cellule tumorali, rendendole più vulnerabili alla chemio. La clorochina, d’altro canto, induce stress a livello del reticolo endoplasmatico e inibisce l’autofagia. Impedendo l’autofagia, la clorochina potrebbe “intrappolare” segnali di stress che alla fine attivano l’apoptosi.
La riduzione dell’espressione di KRAS e NRAS è particolarmente significativa. Le mutazioni in questi geni sono associate all’effetto Warburg (un metabolismo energetico alterato tipico dei tumori) e alla chemioresistenza. La metformina sembra capace di “spostare” K-RAS dalla membrana cellulare, dove è attivo, verso l’interno della cellula, riducendone l’attività. Anche la clorochina sembra interferire con le mutazioni di KRAS.

Implicazioni Cliniche e Prospettive Future: Una Speranza Concreta
Questi risultati sono davvero promettenti! Il fatto che metformina e clorochina siano farmaci già approvati dalla FDA, ben tollerati e con profili di sicurezza noti, è un vantaggio strategico enorme. La metformina, in particolare, ha pochissimi problemi di sicurezza dopo 60 anni di uso clinico.
L’idea che questa combinazione possa migliorare l’efficacia terapeutica permettendo magari di ridurre la dose di citarabina è entusiasmante. Dosi più basse di AraC significherebbero meno tossicità (danni d’organo, soppressione midollare), migliorando la qualità di vita dei pazienti, specialmente dei bambini. La down-regolazione degli oncogeni KRAS e NRAS e l’attivazione della via apoptotica di p53 sono meccanismi clinicamente rilevanti nella B-ALL.
Certo, questo è uno studio in vitro, su una linea cellulare. Il prossimo passo sarà validare questi risultati in modelli animali e, speriamo, in studi clinici. Sarà importante ottimizzare le dosi e identificare biomarcatori che possano predire la risposta a questa terapia combinata. Tecnologie avanzate come l’omica spaziale (epigenomica, trascrittomica, proteomica) e l’RNA-seq potrebbero darci una visione ancora più profonda dei meccanismi coinvolti.
Limiti dello Studio (L’Onestà Intellettuale Prima di Tutto!)
È giusto sottolineare che il nostro studio ha delle limitazioni. Abbiamo usato una sola linea cellulare (NALM-6), quindi sarà cruciale confermare i risultati su altre linee di LLA. Inoltre, non abbiamo validato sperimentalmente in modo diretto l’implicazione delle vie AMPK/mTOR e NF-kB, anche se i nostri dati lo suggeriscono fortemente. E, per difficoltà logistiche legate alla necessità di strutture molto avanzate, non abbiamo potuto condurre studi su animali, che saranno fondamentali per il futuro.
Nonostante ciò, i nostri risultati sostengono con forza l’idea che la combinazione di citarabina con metformina e clorochina possa essere un’alternativa efficace all’aumento della dose di citarabina per il trattamento della B-ALL. Potrebbe offrire un migliore effetto terapeutico a dosi più basse, aprendo la strada a trattamenti più efficaci e meno tossici. E questa, per me, è una speranza che vale la pena coltivare con tutte le nostre forze!
Fonte: Springer