Medulloblastoma Metastatico: Come ‘Corrompe’ il Suo Vicinato per Diffondersi Ancora di Più
Ciao a tutti! Oggi voglio parlarvi di qualcosa di incredibilmente affascinante e, purtroppo, molto serio nel campo dell’oncologia pediatrica: il medulloblastoma metastatico. Sapete, il medulloblastoma è il tumore cerebrale maligno più comune nei bambini. Nasce nel cervelletto, ma la sua vera pericolosità, quella che porta alle conseguenze più gravi, deriva dalla sua capacità di diffondersi, di creare metastasi. E dove vanno a finire queste cellule tumorali viaggiatrici? Quasi esclusivamente nelle leptomeningi, le sottili membrane che avvolgono il cervello e il midollo spinale.
La Sfida delle Metastasi Leptomeningee
Per anni, ci siamo chiesti: come fanno queste cellule a sopravvivere e prosperare in un ambiente così particolare come le leptomeningi, bagnate solo dal liquido cerebrospinale, che non è esattamente ricco di nutrienti? È un ambiente ostile, molto diverso da quello del tumore primario nel cervello. La maggior parte delle morti nei pazienti con medulloblastoma è causata proprio da queste metastasi leptomeningee. Le terapie attuali, come la radioterapia su tutto l’asse cranio-spinale, possono essere efficaci, ma hanno un prezzo alto, specialmente per il sistema nervoso in via di sviluppo dei bambini. Mancano terapie mirate, biologiche, un po’ perché non ci sono mutazioni genetiche ricorrenti facili da colpire con farmaci specifici.
Ecco perché abbiamo ipotizzato che le cellule tumorali capaci di formare metastasi nelle leptomeningi non si limitassero ad arrivare e crescere, ma dovessero attivamente creare un ambiente favorevole, una sorta di “nicchia” accogliente per poter colonizzare e poi espandersi. Capire i meccanismi molecolari che permettono la formazione di questo ecosistema metastatico potrebbe aprirci la strada a nuove strategie terapeutiche.
Indagare il Microambiente Metastatico: Cosa Abbiamo Scoperto
Per studiare questo fenomeno, abbiamo usato modelli murini geneticamente modificati (i topi Ptch-SB) che sviluppano medulloblastoma con metastasi leptomeningee spontanee, molto simili a quelle umane. Abbiamo isolato le leptomeningi spinali da topi con metastasi e da topi sani di controllo, e anche i tumori primari. Poi, abbiamo utilizzato una tecnica potentissima chiamata sequenziamento dell’RNA a singola cellula (scRNA-seq). Questa tecnica ci permette di guardare cosa succede, a livello di geni attivi, in ogni singola cellula, sia tumorale che del suo microambiente (il famoso TME, Tumor Microenvironment).
La prima cosa che abbiamo notato confrontando le cellule del tumore primario con quelle delle metastasi leptomeningee (LPT-MET) è stata una differenza enorme nei loro programmi genetici. Le cellule metastatiche sembravano aver cambiato il loro metabolismo, passando da uno basato sulla respirazione aerobica e la produzione di nucleotidi (tipico del tumore primario) a uno focalizzato sul metabolismo degli amminoacidi. Non solo, ma nelle metastasi, la proporzione di cellule del microambiente rispetto alle cellule tumorali era molto più alta.

Il Dialogo tra Cellule Tumorali e Microambiente
Analizzando le comunicazioni tra le diverse cellule (usando uno strumento chiamato CellChat), abbiamo visto un’altra differenza chiave. Nel tumore primario, le cellule tumorali erano le protagoniste assolute, mandando e ricevendo la maggior parte dei segnali. Nelle metastasi, invece, il dialogo era molto più intenso tra le cellule del microambiente e le cellule tumorali, e anche tra i diversi tipi di cellule del microambiente stesso. Era come se si fosse creato un vero e proprio ecosistema complesso nella nicchia metastatica.
Ci siamo chiesti: chi sono gli attori principali in questo dialogo? Confrontando le cellule delle leptomeningi sane (LPT-WT) con quelle metastatiche (LPT-MET), abbiamo identificato vari tipi cellulari nel microambiente: astrociti, cellule ependimali, cellule di Schwann, fibroblasti meningei, cellule muscolari lisce, cellule endoteliali, periciti e cellule immunitarie. Tra tutti questi, i fibroblasti meningei spiccavano per la loro intensa comunicazione con le cellule tumorali metastatiche e con il resto del microambiente.
I Fibroblasti Meningei: Attori Chiave Reclutati dal Tumore
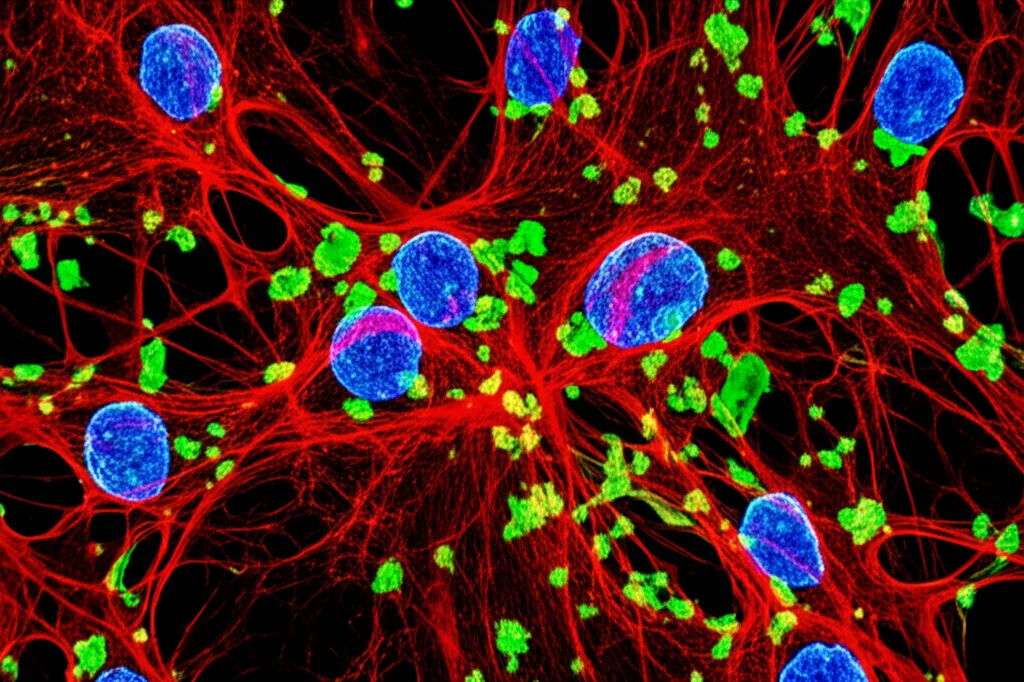
Guardando al microscopio le leptomeningi metastatiche, abbiamo visto che le cellule tumorali (marcate in verde nel nostro modello) si trovavano spesso vicinissime ai vasi sanguigni e immerse in una matrice extracellulare ricca. E indovinate chi c’era lì vicino? Proprio i fibroblasti meningei, che esprimono un recettore chiamato PDGFRα. Abbiamo usato topi reporter (Pdgfra-H2BeGFP) dove i fibroblasti sono fluorescenti e abbiamo confermato che la loro distribuzione rispecchiava quella delle cellule metastatiche. Non solo: nelle leptomeningi metastatiche c’erano più fibroblasti rispetto a quelle sane, e questi fibroblasti erano anche più proliferativi (si dividevano di più).
Come facevano le cellule tumorali ad attirare questi fibroblasti? Analizzando i segnali, abbiamo visto che le cellule metastatiche producevano ligandi del PDGF (Platelet-Derived Growth Factor), che agiscono come un richiamo chimico (chemiotassi) per i fibroblasti che esprimono il recettore PDGFRα. Abbiamo fatto un esperimento: abbiamo preso cellule di medulloblastoma umano (linea D458) e le abbiamo modificate per produrre più PDGFA (un tipo di ligando PDGF). Quando abbiamo impiantato queste cellule nei topi, abbiamo visto che effettivamente reclutavano più fibroblasti nella nicchia metastatica. Sorprendentemente, questo non aumentava la proliferazione dei fibroblasti stessi, ma aumentava quella delle cellule tumorali e riduceva la sopravvivenza dei topi. È come se le cellule tumorali chiamassero rinforzi (i fibroblasti) per creare un ambiente che poi favorisce la loro stessa crescita.
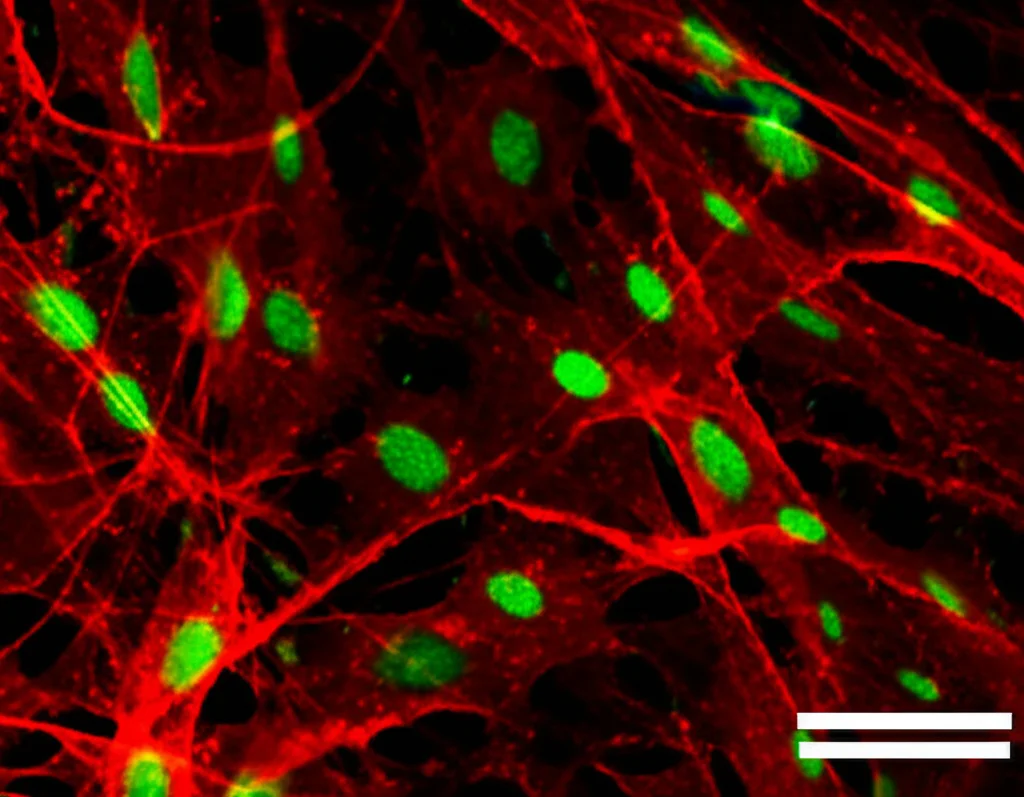
I Fibroblasti “Corrotti”: Nascita degli MB-MAF
Ma i fibroblasti reclutati non sono semplici spettatori. Abbiamo scoperto che, una volta nella nicchia metastatica, subiscono una vera e propria riprogrammazione. Confrontando i fibroblasti delle leptomeningi sane con quelli associati alle metastasi (che abbiamo chiamato MB-MAF, Metastasis-Associated Fibroblasts), abbiamo visto che questi ultimi avevano un profilo genetico completamente diverso. Attivavano vie di segnalazione come TGFβ, BMP, WNT e ERK1/2, e geni associati all’organizzazione della matrice extracellulare, alla migrazione cellulare, all’angiogenesi (formazione di nuovi vasi) e alla proliferazione.
Abbiamo identificato diversi sottotipi di fibroblasti, ma uno in particolare, chiamato LMF1, era molto più abbondante nelle metastasi. Questo cluster LMF1 assomigliava molto ai cosiddetti fibroblasti associati al cancro (CAF) che si trovano in altri tumori, in particolare a quelli di tipo “miofibroblastico”, noti per rimodellare la matrice e promuovere la crescita tumorale. Sembrava che i fibroblasti co-evolvessero con le cellule tumorali: nelle metastasi più estese, i fibroblasti assomigliavano ancora di più ai CAF miofibroblastici.
Il Segnale Segreto degli MB-MAF: Le BMP
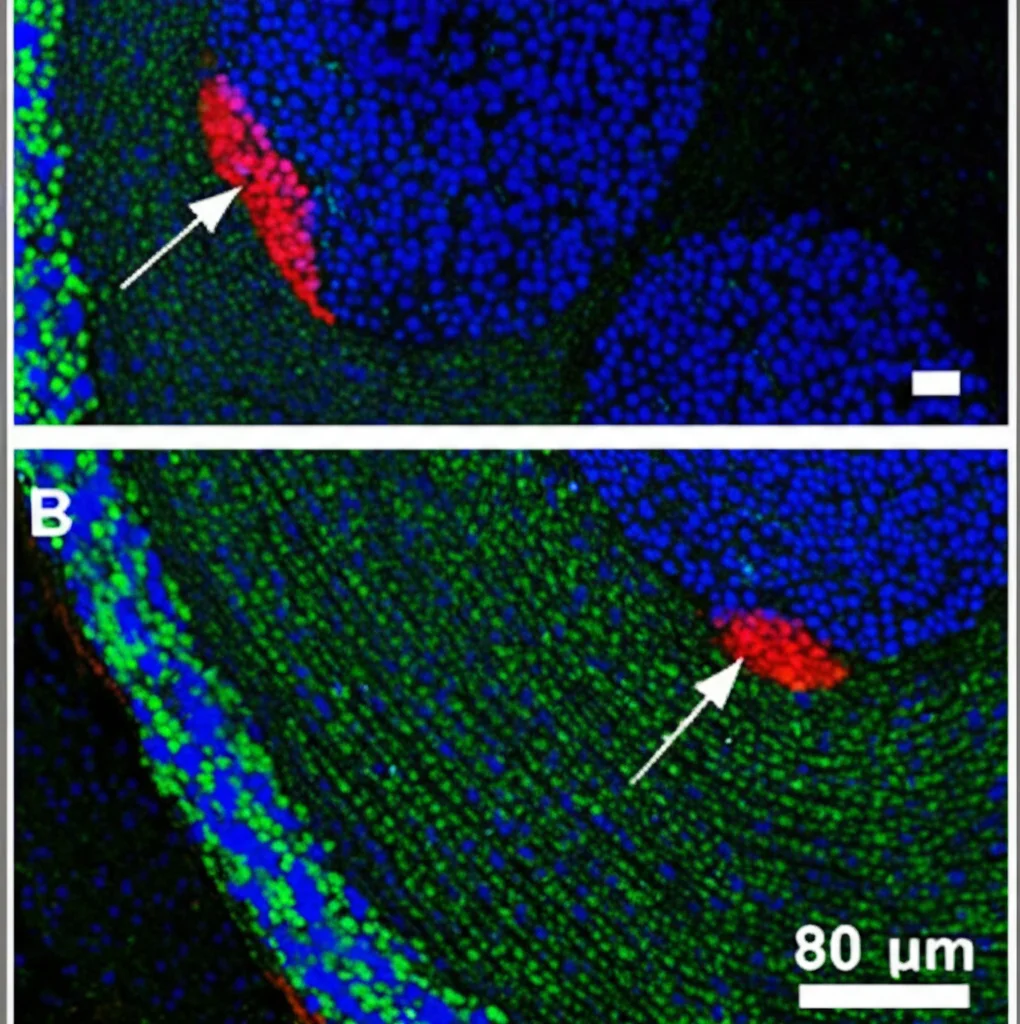
Se i fibroblasti vengono riprogrammati, cosa fanno poi per aiutare il tumore? Analizzando i segnali inviati *dai* fibroblasti *alle* cellule tumorali, un percorso è emerso chiaramente: la via di segnalazione delle BMP (Bone Morphogenetic Proteins). Nelle leptomeningi sane, i fibroblasti producevano un po’ di BMP5 che segnalava ai periciti (cellule associate ai vasi). Ma nelle metastasi, i fibroblasti (ora MB-MAF) iniziavano a produrre BMP4 e BMP7, che segnalavano potentemente alle cellule tumorali metastatiche (oltre che ad altre cellule del microambiente). Abbiamo confermato la presenza di BMP4 e BMP7 proprio vicino alle cellule metastatiche usando l’immunofluorescenza.
E le cellule tumorali ricevevano il messaggio? Assolutamente sì! Abbiamo misurato l’attivazione della via BMP nelle cellule tumorali guardando la fosforilazione di proteine chiamate SMAD1/5 (pSMAD1/5), un segno che il segnale BMP è attivo. I livelli di pSMAD1/5 erano molto più alti nelle cellule metastatiche rispetto a quelle del tumore primario. Di conseguenza, le cellule metastatiche attivavano geni bersaglio della via BMP, come Id1 e Id2.
Cosa fanno questi geni? Studiando le cellule metastatiche che esprimevano Id1, abbiamo visto che attivavano anche geni legati alla progressione del ciclo cellulare. In pratica, il segnale BMP proveniente dai fibroblasti riprogrammati spingeva le cellule tumorali a dividersi di più.
La Prova del Nove: Esperimenti Funzionali
Per essere sicuri che questo dialogo PDGF-BMP fosse davvero cruciale, abbiamo fatto altri esperimenti.
- Abbiamo modificato cellule tumorali D458 per avere la via BMP costantemente attiva (esprimendo una forma mutata di BMPR1A, il recettore BMP). Quando le abbiamo impiantate nei topi, queste cellule hanno colonizzato le leptomeningi molto più efficacemente e i topi sono sopravvissuti meno a lungo. Questo conferma che attivare la via BMP promuove la crescita metastatica.
- Abbiamo isolato i fibroblasti MB-MAF dalle leptomeningi metastatiche di topi con xenotrapianti derivati da pazienti (MB411) usando il FACS (una tecnica per separare cellule specifiche). Poi abbiamo co-impiantato cellule tumorali primarie MB411 insieme a questi MB-MAF nelle leptomeningi di altri topi. Risultato? Una colonizzazione metastatica massiccia e una sopravvivenza molto ridotta rispetto ai topi che avevano ricevuto solo le cellule tumorali. Questo dimostra che gli MB-MAF giocano un ruolo causale attivo nello stabilire le metastasi.
Una Nuova Speranza Terapeutica: Bloccare il Dialogo
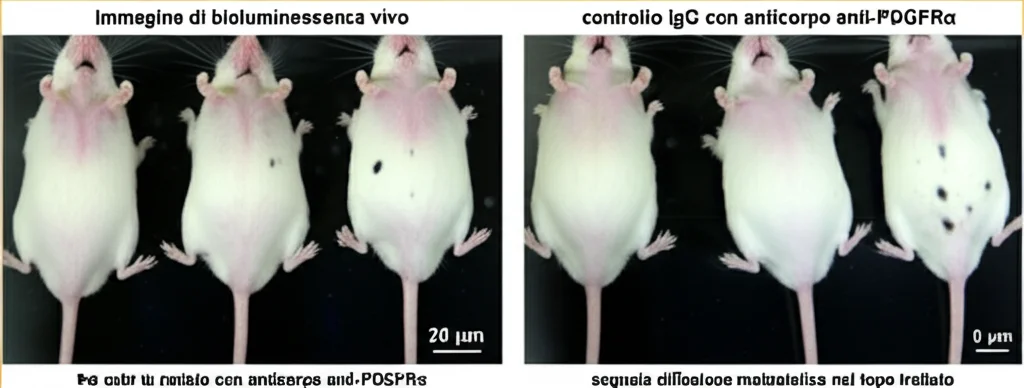
Se questo dialogo è così importante, possiamo interromperlo? Abbiamo provato a bloccare il primo passo, il reclutamento dei fibroblasti mediato da PDGF. Abbiamo trattato topi con metastasi D458 con un anticorpo neutralizzante contro PDGFRα, somministrato direttamente nelle leptomeningi. Ebbene, questo trattamento ha ridotto la colonizzazione spinale e ha prolungato la sopravvivenza dei topi!
Conclusioni e Prospettive Future
Quindi, abbiamo scoperto un meccanismo affascinante e complesso: le cellule di medulloblastoma metastatico secernono PDGF per reclutare i fibroblasti meningei. Questi fibroblasti vengono poi riprogrammati (diventano MB-MAF) e iniziano a secernere BMP4/7, che a loro volta stimolano la proliferazione delle cellule tumorali, favorendo ulteriormente la colonizzazione e la crescita delle metastasi. È una sorta di “folie à deux”, una pazzia a due in cui tumore e fibroblasti si sostengono a vicenda.
Questo studio sottolinea quanto sia cruciale studiare direttamente le metastasi e il loro microambiente specifico, che è molto diverso da quello del tumore primario. I fibroblasti riprogrammati, gli MB-MAF, sono chiaramente dei complici attivi nel processo metastatico. La buona notizia è che questo complesso ecosistema potrebbe essere il tallone d’Achille del tumore, offrendo nuovi bersagli terapeutici.
Bloccare il reclutamento dei fibroblasti con anticorpi anti-PDGFRα si è dimostrato promettente nei nostri modelli. Questo apre la porta a possibili trial clinici per testare questa strategia nell’uomo, magari per prevenire le recidive metastatiche dopo la terapia standard o per trattare le metastasi già presenti. Poiché il microambiente tumorale non ha l’instabilità genomica delle cellule tumorali, potremmo avere meno problemi di resistenza alla terapia.
C’è ancora molto da scoprire, ovviamente. Dobbiamo capire se questo asse PDGF-BMP è valido per tutti i sottogruppi di medulloblastoma e confermare questi risultati su campioni umani (che sono difficilissimi da ottenere). Ma la strada è tracciata: colpire la nicchia metastatica, disarmare i complici del tumore, potrebbe essere una strategia vincente per combattere questa terribile malattia nei bambini.