Svelato il Meccanismo Segreto delle Chinasi Istidiniche: Attivazione Allosterica Senza Fosforilazione!
Ciao a tutti, appassionati di scienza! Oggi voglio parlarvi di qualcosa che mi affascina da matti nel mondo della biologia cellulare: le chinasi istidiniche (HKs). Immaginatele come delle antenne super intelligenti sulla superficie delle cellule, specialmente nei batteri, ma anche in funghi e piante. Il loro compito? Captare segnali dall’ambiente – tipo cambiamenti di temperatura, osmolarità, nutrienti – e tradurli in una risposta cellulare, spesso attivando o disattivando specifici geni.
Come funzionano di solito le Chinasi Istidiniche?
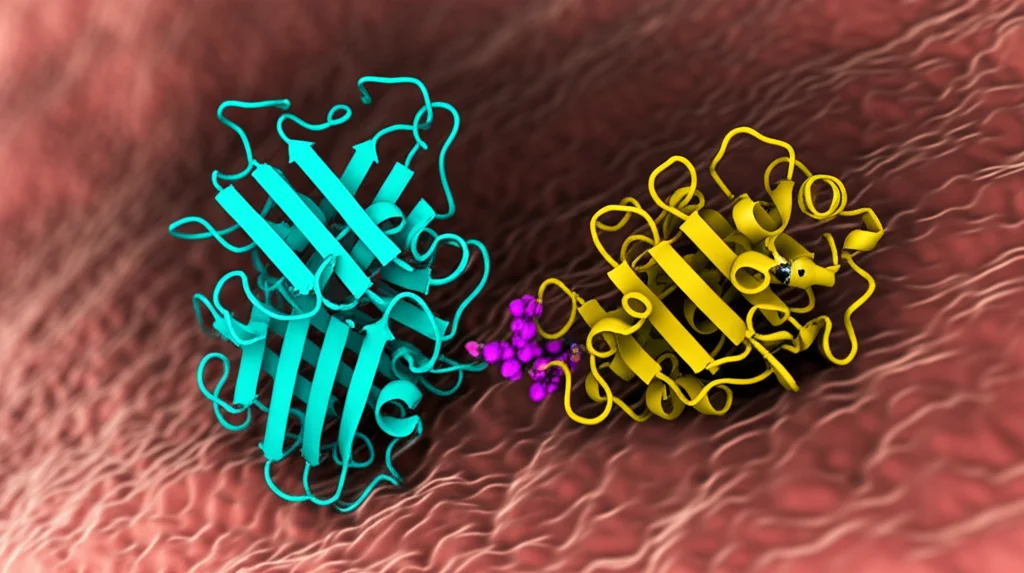
Il meccanismo “classico”, quello che abbiamo studiato per anni, è basato sulla fosforilazione. In pratica, quando l’antenna (la chinasi) riceve un segnale, si “accende” e prende un gruppo fosfato da una molecola di ATP (la nostra moneta energetica cellulare). Questo fosfato viene poi attaccato a un residuo specifico della chinasi stessa, un’istidina super conservata (cioè presente in quasi tutte le HKs), che si trova in una regione chiamata dominio DHp (Dimerization and Histidine phosphotransfer).
Da qui, il fosfato fa un altro salto: passa a una proteina partner, chiamata Regolatore di Risposta (RR). Quando l’RR riceve il fosfato (su un residuo di aspartato, anch’esso conservato), cambia forma, si attiva e, nella maggior parte dei casi, va a legarsi al DNA per regolare l’espressione genica. Un sistema elegante, che richiede energia (ATP) e passaggi ben precisi.
Pensate a DesK, una chinasi istidinica termosensore del batterio Bacillus subtilis. È un esempio da manuale: percepisce la fluidità della membrana cellulare. Se fa troppo freddo (tipo 25°C), la membrana diventa più rigida, DesK si attiva, fosforila il suo RR, DesR, che a sua volta attiva la produzione di un enzima (una desaturasi) che rende i lipidi di membrana più fluidi, ristabilendo l’equilibrio. L’istidina chiave in DesK è la His 188. Per anni si è pensato che sostituire questa His 188 con un amminoacido non fosforilabile (come la valina, H188V) spegnesse completamente l’interruttore. E in effetti, gli esperimenti sembravano confermarlo.
Il Colpo di Scena: Attivazione Senza Fosforilazione!
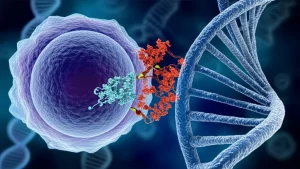
Ma la biologia, si sa, ama sorprenderci. Studi recenti, inclusi quelli che voglio raccontarvi oggi basati su una ricerca pubblicata su *Scientific Reports*, hanno iniziato a mostrare crepe in questo modello così lineare. Si è visto che alcuni RR, come DesR e OmpR (l’RR partner della chinasi EnvZ di E. coli), potevano attivarsi anche senza ricevere quel famoso fosfato dalla loro chinasi! Richiedevano comunque la presenza della chinasi, ma non il trasferimento del fosfato. Come è possibile? Qui entra in gioco l’accoppiamento allosterico.
L’allosteria è un concetto affascinante: una molecola (in questo caso, la chinasi) può influenzare l’attività di un’altra molecola (l’RR) legandosi ad essa e inducendo un cambiamento conformazionale (di forma), senza necessariamente passargli un gruppo chimico come il fosfato.
Nel nostro caso, i ricercatori si sono chiesti: e se la chinasi potesse attivare l’RR semplicemente “toccandolo” nel modo giusto, inducendo il cambiamento di forma necessario per l’attivazione, anche senza fosforilarlo? E se questo meccanismo non dipendesse nemmeno dalla fosforilazione della famosa istidina conservata (His 188 in DesK)?

Indagando su DesK: Mutazioni Rivelatrici
Per vederci chiaro, i ricercatori hanno fatto un lavoro certosino su DesK. Hanno notato un’altra istidina, la His 335, situata molto vicino al sito di legame dell’ATP nel dominio catalitico. E se fosse lei un sito di fosforilazione alternativo o avesse un altro ruolo?
Hanno creato diverse versioni mutanti di DesK:
- H335A: Sostituita His 335 con Alanina (non fosforilabile). Risultato: DesK completamente inattiva. Uhm, interessante… forse His 335 è importante?
- H335Y: Sostituita His 335 con Tirosina (fosforilabile). Risultato: DesK attiva, simile alla versione normale (WT – Wild Type). Questo rafforza l’idea che His 335 possa essere fosforilata o comunque importante.
A questo punto, la domanda sorge spontanea: ma allora His 188 è davvero indispensabile come si pensava? La mutazione H188V (valina) la inattivava, ma la valina è molto idrofobica e causa una rotazione “verso l’interno” del dominio DHp, forse bloccando la proteina. E se provassimo con altro?
- H188E: Sostituita His 188 con Glutammato (idrofilico, carica negativa). Questo causa una rotazione opposta, “verso l’esterno”. Risultato: DesK ancora inattiva. Sembra che la rotazione specifica sia cruciale.
- H188Q: Qui arriva la sorpresa! Sostituita His 188 con Glutammina (Q). La glutammina non è fosforilabile, ma è anfifatica (un po’ idrofobica, un po’ idrofilica) e forse permette la giusta flessibilità conformazionale. Risultato: DesK H188Q è ATTIVA! Mantiene circa il 59% dell’attività della versione normale a basse temperature. Questo è pazzesco: DesK può funzionare senza la sua istidina fosforilabile chiave!
E non è finita:
- H335Q: Sostituita His 335 con Glutammina. Risultato: DesK attiva, ma con attività ridotta (circa il 41% in meno rispetto al WT), simile alla riduzione vista con H188Q. Questo suggerisce che anche His 335 sia importante, ma la sua fosforilazione non è strettamente necessaria se c’è His 188.
- H188Q/H335Q: Il doppio mutante, con entrambe le istidine sostituite da glutammina. Risultato: DesK completamente INATTIVA.
Questi risultati *in vivo* (cioè dentro le cellule batteriche vive) sono potentissimi. Ci dicono che DesK ha bisogno di ALMENO UNA delle due istidine (188 o 335) per funzionare, ma non necessariamente per essere fosforilata su His 188. Sembra esserci una via alternativa che coinvolge His 335 e non richiede la fosforilazione di His 188.

Conferme In Vitro e Simulazioni al Computer
Per capire meglio, sono stati fatti esperimenti *in vitro* (in provetta) con le proteine purificate.
- Autofosforilazione: Hanno incubato le diverse versioni di DesK con ATP radioattivo (γ32P-ATP). Come previsto, la DesK normale (WT) e la H335Q si autofosforilavano (su His 188). Invece, la H188Q e la doppia mutante H188Q/H335Q NON si autofosforilavano. Questo conferma che His 188 è il sito principale di autofosforilazione e che His 335 non sembra autofosforilarsi in modo stabile.
- Trasferimento del fosfato a DesR: Hanno prima fatto autofosforilare le chinasi e poi aggiunto DesR. Solo WT-DesK e DesK H335Q trasferivano il fosfato a DesR. La H188Q, pur essendo attiva *in vivo*, non trasferiva fosfato *in vitro*.
Mettendo insieme i pezzi: la variante H188Q è attiva *in vivo* ma non si fosforila né trasferisce fosfato *in vitro*. Questo è il supporto definitivo per un meccanismo di attivazione che NON dipende dalla fosforilazione di His 188!
I ricercatori hanno chiamato questo meccanismo HK-ACAM (Histidine Kinase-Allosteric Coupling Activation Mechanism).
Per visualizzare come potesse funzionare a livello molecolare, hanno usato simulazioni di dinamica molecolare (MDS), dei potentissimi strumenti computazionali che simulano il movimento degli atomi nelle proteine. Hanno simulato il complesso DesK-DesR con diverse varianti di DesK (WT, H335Y, H335Q) in assenza di ATP.
I risultati sono stati illuminanti:
- Con WT-DesK e DesK H335Y (le più attive), DesR manteneva una conformazione “aperta”, attiva, con il suo dominio di legame al DNA (HTH) esposto e pronto ad agire. In queste simulazioni, il residuo 335 di DesK (His o Tyr) interagiva strettamente con una regione specifica di DesR (l’elica α2).
- Con DesK H335Q (meno attiva e priva di HK-ACAM secondo l’ipotesi), DesR tendeva a ripiegarsi in una conformazione “chiusa”, inattiva, con il dominio HTH nascosto. L’interazione tra Gln 335 e l’elica α2 di DesR era diversa e meno stretta.
Queste simulazioni suggeriscono che l’interazione fisica tra il residuo in posizione 335 di DesK e l’elica α2 di DesR sia cruciale per mantenere DesR nella sua forma attiva tramite il meccanismo allosterico HK-ACAM, indipendentemente dalla fosforilazione.
Non solo DesK: il Meccanismo Potrebbe Essere Diffuso!
Ok, tutto questo è bellissimo per DesK, ma è un caso isolato o qualcosa di più generale? Per scoprirlo, i ricercatori hanno rivolto la loro attenzione a un’altra famosa chinasi istidinica: EnvZ di Escherichia coli. EnvZ risponde ai cambiamenti di osmolarità e la sua istidina conservata è la His 243.
Hanno fatto un esperimento simile a quello fatto per DesK: hanno creato la mutante EnvZ H243Q (sostituendo l’istidina chiave con glutammina non fosforilabile) e l’hanno testata *in vivo* in cellule di E. coli. Sorprendentemente, anche EnvZ H243Q era attiva! Riusciva a indurre l’espressione del gene bersaglio (ompC) in risposta ad alta osmolarità, anche se con un’efficienza ridotta (circa il 65% rispetto al WT), una riduzione simile a quella vista per DesK H188Q.
Questa scoperta è fondamentale: dimostra che il meccanismo HK-ACAM, l’attivazione allosterica indipendente dalla fosforilazione dell’istidina conservata, non è un’esclusiva di DesK in B. subtilis (un batterio Gram-positivo), ma funziona anche in EnvZ di E. coli (un batterio Gram-negativo modello). Questo suggerisce fortemente che HK-ACAM possa essere un meccanismo diffuso e conservato tra i batteri.
Perché Esiste Questo Meccanismo Alternativo?
Viene da chiedersi: perché i batteri avrebbero evoluto questo sistema “alternativo” oltre alla classica fosforilazione? L’ipotesi più intrigante è che HK-ACAM possa fungere da meccanismo di “fail-safe” o di attivazione in condizioni particolari.
Immaginate situazioni di stress per la cellula, come carenza di nutrienti (che porta a bassi livelli di ATP) o condizioni di acidità, che possono ostacolare l’autofosforilazione della chinasi. In questi scenari, la via classica basata su ATP e fosforilazione potrebbe non funzionare bene. HK-ACAM, invece, non richiede né ATP né fosforilazione! La chinasi potrebbe comunque percepire il segnale ambientale, cambiare conformazione (la famosa rotazione delle eliche DHp) e interagire allostericamente con il suo RR per attivarlo.
Questo meccanismo colma anche un po’ il divario tra enzimi classici (che catalizzano reazioni) e “pseudo-enzimi”, proteine che assomigliano a enzimi ma hanno perso l’attività catalitica e funzionano spesso tramite interazioni allosteriche. Le chinasi istidiniche potrebbero essere un affascinante esempio di come questi due mondi si incontrano.

Implicazioni Future
Questa scoperta apre nuove strade affascinanti. Ci fa capire che la trasduzione del segnale nei batteri è ancora più complessa e versatile di quanto pensassimo. Inoltre, le chinasi istidiniche sono presenti nei batteri patogeni ma assenti negli umani, rendendole ottimi bersagli per lo sviluppo di nuovi antibiotici. Capire a fondo tutti i loro meccanismi di funzionamento, inclusi quelli non canonici come HK-ACAM, è cruciale per progettare farmaci più efficaci che magari possano bloccare entrambe le vie di attivazione.
Insomma, il mondo microscopico dei batteri continua a regalarci sorprese e a mostrarci soluzioni biologiche incredibilmente ingegnose. La prossima volta che pensate a un interruttore molecolare, ricordatevi che potrebbe avere più di un modo per accendersi!
Fonte: Springer