Sclerosi Multipla: Viaggio al Cuore dell’Infiammazione con la Mappa AA-PGE2-EP
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante, quasi da detective, nel complesso mondo della sclerosi multipla (SM). Sapete, la SM è una malattia cronica che colpisce il sistema nervoso centrale, creando delle vere e proprie “cicatrici” o lesioni nel cervello e nel midollo spinale. Quello che ancora ci sfugge, in parte, è perché l’infiammazione in queste aree diventi cronica, quasi come un fuoco che non si riesce a spegnere del tutto.
Negli ultimi anni, la ricerca ha iniziato a puntare i riflettori su dei protagonisti inaspettati: i lipidi bioattivi. Non pensate solo ai grassi che ci fanno ingrassare! Parlo di molecole potentissime derivate da acidi grassi polinsaturi (i famosi PUFA), come l’acido arachidonico (AA), che orchestrano le risposte infiammatorie, sia nell’accenderle che nello spegnerle. L’ipotesi intrigante? Che nella SM ci sia uno squilibrio in questo delicato sistema, in particolare nella via metabolica dell’AA, che impedisce all’infiammazione di risolversi come dovrebbe.
Ma c’è un problema: studiare queste molecole *direttamente* nel cervello umano, e capire dove si trovano esattamente rispetto alle lesioni, è sempre stato un rompicapo. Fino ad ora.
La Mappa del Tesoro: Vedere l’Invisibile con la MSI
Immaginate di avere una mappa super dettagliata che vi mostra non solo le strade e le case, ma anche la concentrazione di specifiche molecole in ogni singolo punto. Fantascienza? Non proprio! Grazie a una tecnica sofisticata chiamata Mass Spectrometry Imaging (MSI), siamo riusciti per la prima volta a fare proprio questo: mappare la distribuzione dell’acido arachidonico (AA) e di un suo importante “figlio”, la prostaglandina E2 (PGE2), direttamente nel tessuto cerebrale post-mortem di persone con SM e di controlli sani.
È stato come accendere una luce su un paesaggio prima invisibile. Abbiamo analizzato sezioni sottilissime di tessuto cerebrale, usando la MSI per “fotografare” la presenza e la quantità di AA e PGE2. Poi, abbiamo confrontato queste mappe molecolari con le analisi istologiche classiche, che ci mostrano il livello di demielinizzazione (la perdita della guaina che protegge i nervi) e di infiammazione (la presenza di cellule immunitarie attivate, come la microglia).
Sorpresa N°1: L’Acido Arachidonico (AA) si Nasconde
La prima scoperta interessante riguarda l’AA. Ci si potrebbe aspettare più “carburante” per l’infiammazione nelle zone calde, giusto? E invece no! Abbiamo osservato che:
- I livelli generali di AA erano più bassi nei campioni di tessuto SM rispetto ai controlli.
- All’interno dello stesso cervello SM, le aree delle lesioni demielinizzate avevano livelli di AA significativamente inferiori rispetto al tessuto circostante (peri-lesionale) apparentemente sano.
Questo calo potrebbe indicare due cose, forse entrambe vere: o c’è meno AA disponibile in generale, oppure viene consumato più rapidamente per produrre altre molecole. A supporto di questa seconda ipotesi, abbiamo visto che l’espressione di alcuni enzimi chiave che trasformano l’AA in prostaglandine, come la COX2 (PTGS2) e la mPGES-1 (PTGES), era tendenzialmente aumentata nei tessuti SM. È come se la “fabbrica” di prostaglandine fosse più attiva.
Abbiamo anche cercato la proteina COX2 direttamente nel tessuto con tecniche di immunoistochimica. L’abbiamo trovata principalmente nei vasi sanguigni e attorno ai nuclei di cellule immunitarie (CD45+), sia nei controlli che nei casi SM, a volte anche nello spazio attorno ai vasi nelle lesioni SM. Curiosamente, però, la quantità totale di COX2 non sembrava drasticamente diversa tra SM e controlli, né variava molto tra le diverse zone infiammatorie della SM. Forse l’aumento di attività è più sottile di quanto appaia a prima vista, o magari l’incremento di mRNA non si traduce sempre in un’enorme quantità di proteina visibile.
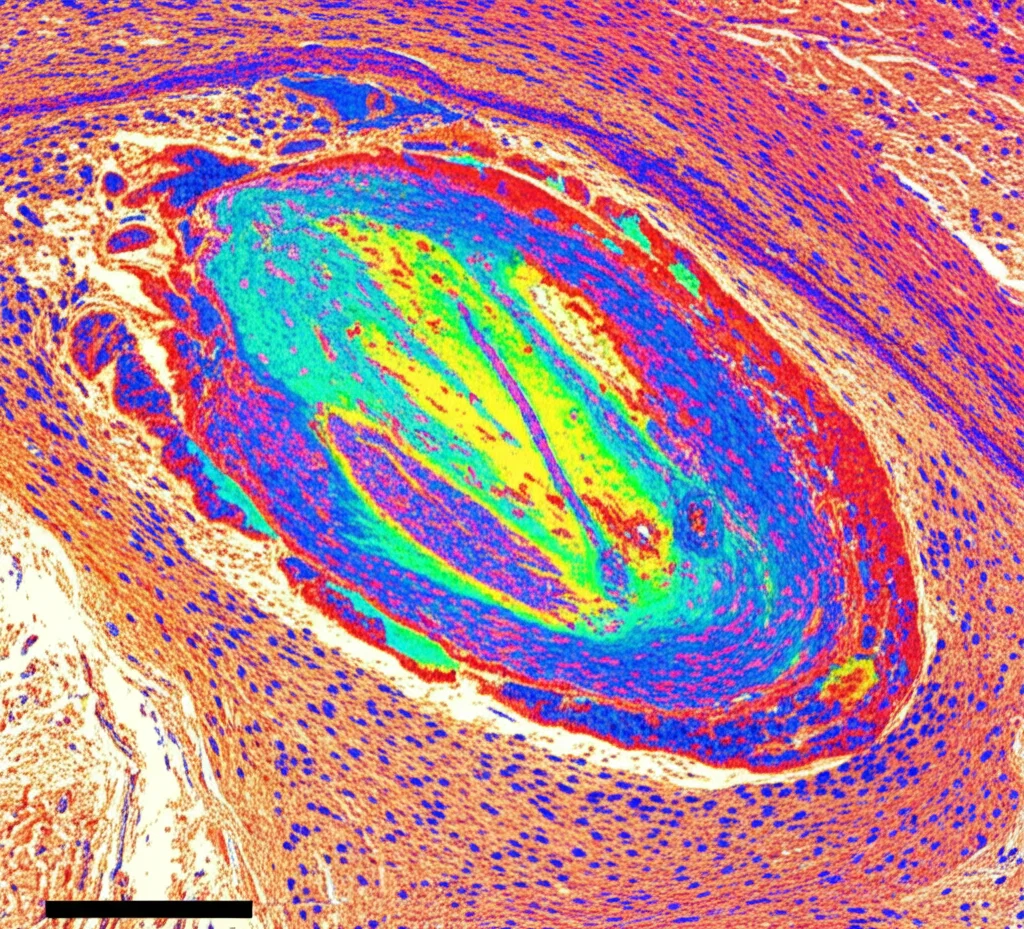
Sorpresa N°2: Il Rapporto PGE2/AA Sale alle Stelle nelle Lesioni
E la PGE2, questa famosa prostaglandina spesso associata all’infiammazione? Anche qui, la MSI ci ha regalato una visione dettagliata. Le mappe di PGE2 mostravano una distribuzione abbastanza omogenea nei controlli, ma disegnavano nettamente i contorni delle lesioni nei tessuti SM. A volte i livelli di PGE2 erano più bassi nella lesione, altre volte più alti – un quadro un po’ eterogeneo se guardiamo solo ai livelli assoluti.
Ma la vera chiave di volta è stata guardare il rapporto PGE2/AA. Questo rapporto ci dice quanta PGE2 viene prodotta rispetto al substrato AA disponibile in quella specifica zona. È un indicatore dell’efficienza della “fabbrica”. E qui il messaggio era chiaro:
- Il rapporto PGE2/AA era significativamente più alto nelle aree delle lesioni demielinizzate rispetto alle aree completamente mielinizzate all’interno dello stesso tessuto SM.
In pratica, anche se l’AA scarseggia, sembra che nelle lesioni la sua trasformazione in PGE2 sia più “efficiente” o comunque aumentata rispetto al tessuto sano circostante. Questo suggerisce una produzione locale di PGE2 proprio nel cuore del processo patologico. Abbiamo provato a correlare questo aumento del rapporto PGE2/AA con l’intensità dell’attivazione microgliale (misurata con HLA-DR), ma non abbiamo trovato una correlazione diretta e univoca, suggerendo che la relazione è complessa.
I Guardiani della Porta: I Recettori EP2 ed EP4 Cambiano Ruolo
Ok, la PGE2 viene prodotta localmente nelle lesioni. Ma cosa fa esattamente? La PGE2 agisce legandosi a specifici recettori sulla superficie delle cellule, un po’ come una chiave che apre una porta. Ce ne sono quattro principali (EP1-4), ma due in particolare, EP2 ed EP4, sono stati spesso collegati all’infiammazione e alle malattie neurologiche.
Analizzando i livelli di questi recettori nei tessuti, abbiamo fatto un’altra scoperta cruciale:
- Il recettore EP4 era significativamente diminuito nelle lesioni SM rispetto ai controlli.
- Al contrario, il recettore EP2 era significativamente aumentato nelle lesioni SM rispetto ai controlli!
Andando a vedere più da vicino con l’immunoistochimica, abbiamo visto che l’EP2 si trovava prevalentemente sulle cellule della microglia (le cellule immunitarie residenti del cervello), e questa presenza era molto più marcata nelle lesioni SM. In sostanza, nelle lesioni SM sembra esserci un vero e proprio “cambio della guardia”: meno porte EP4, più porte EP2, soprattutto sulla microglia attivata.
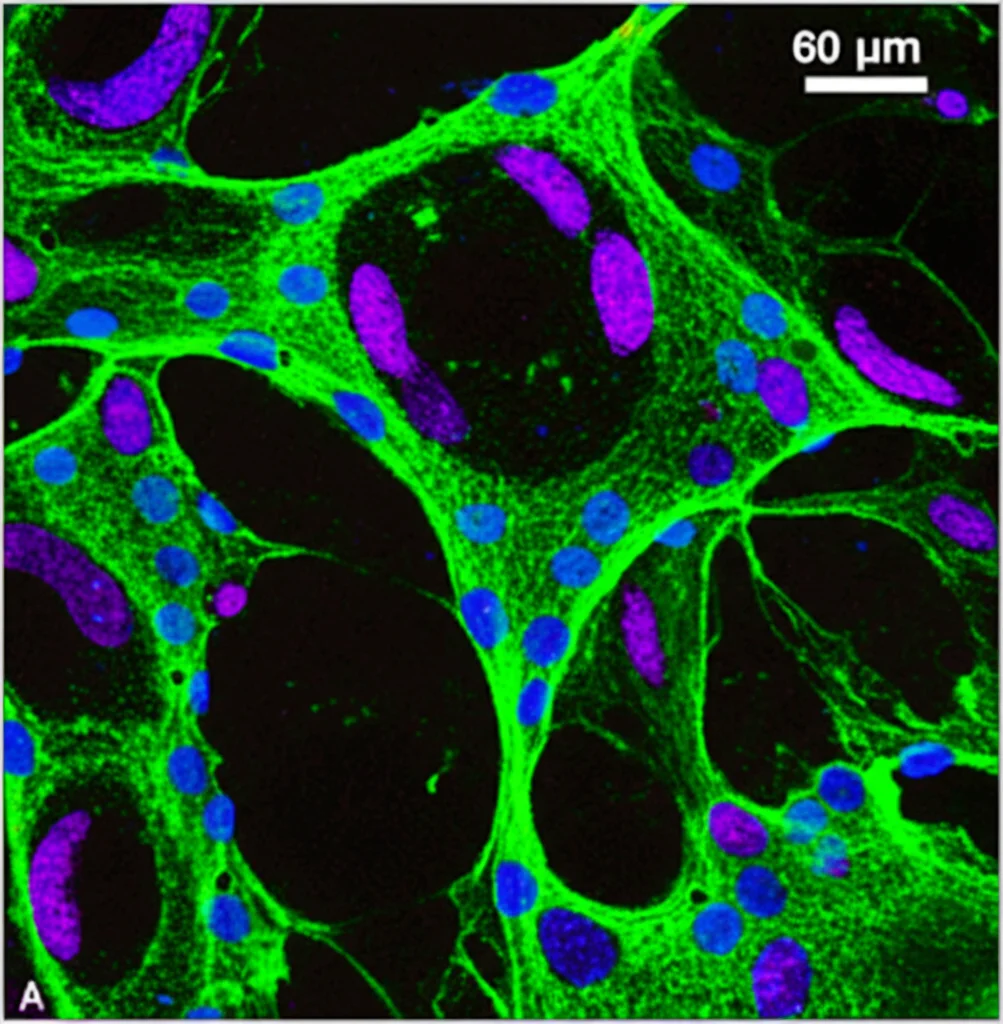
Microglia in Provetta: Cosa Succede Quando Arriva la PGE2?
Per capire meglio le conseguenze di questo aumento del segnale PGE2-EP2 sulla microglia, siamo passati a un modello in vitro. Abbiamo usato cellule microglia umane derivate da cellule staminali pluripotenti indotte (hiPSC) – un modo fantastico per studiare cellule umane in laboratorio. Le abbiamo coltivate sia in condizioni normali (“a riposo”) sia attivandole per mimare uno stato pro-infiammatorio (con LPS e IFNγ), simile a quello che si trova nelle lesioni SM.
Abbiamo notato che le microglia pro-infiammatorie esprimevano già di per sé più recettore EP2 rispetto a quelle a riposo, confermando quanto visto nei tessuti. Poi, abbiamo trattato entrambi i tipi di microglia con PGE2, con o senza degli inibitori specifici per EP2 o EP4, e abbiamo analizzato quali geni venivano accesi o spenti (usando l’RNA sequencing).
I risultati sono stati illuminanti e un po’ complessi, come spesso accade in biologia:
- Sulla microglia a riposo, la PGE2 sembrava spingere verso una risposta più infiammatoria. L’inibizione di EP2 contrastava in parte questo effetto.
- Sulla microglia già attivata (pro-infiammatoria), la PGE2 sembrava avere un effetto più sfumato, quasi “regolatorio”. Induceva sì alcuni geni legati all’immunità, ma ne spegneva altri associati a danno (come SPP1, MMP7) e ne accendeva alcuni legati alla fagocitosi e alla risoluzione (come TREM2, anche se l’effetto era più evidente bloccando EP4 rispetto a EP2).
- Bloccare EP2 nelle microglia attivate sembrava promuovere l’espressione di geni per la segnalazione chemokinica (CXCR4) e per la sintesi stessa di PGE2 (PTGES), ma tendeva a ridurre l’espressione di geni importanti per la risoluzione e il metabolismo microgliale come TREM2 e PAK1.
Inoltre, tornando ai dati sui tessuti, abbiamo notato che le cellule microglia EP2-positive nelle lesioni SM tendevano ad avere livelli più alti di TMEM119, un marcatore associato a uno stato più “omeostatico” o di controllo.
Un Tentativo di Risoluzione? Il Significato dell’Asse PGE2-EP2
Mettendo insieme tutti i pezzi di questo intricato puzzle, emerge un quadro affascinante. Nelle lesioni della sclerosi multipla, l’acido arachidonico diminuisce, ma la sua conversione in PGE2 sembra potenziata localmente (alto rapporto PGE2/AA). Contemporaneamente, sulla microglia infiammata, aumenta l’espressione del recettore EP2 mentre cala quella di EP4.
Cosa significa tutto ciò? L’ipotesi che proponiamo è che questo potenziamento del segnale PGE2-EP2 sulla microglia nelle lesioni SM possa rappresentare un meccanismo di risposta endogeno, un tentativo del sistema immunitario locale di modulare e forse risolvere l’infiammazione cronica. La PGE2, attraverso EP2, potrebbe cercare di “guidare” la microglia attivata verso funzioni più controllate, pro-risolutive o fagocitiche, contrastando magari gli effetti iniziali pro-infiammatori (che potrebbero essere mediati anche da EP4 o da altri segnali).
È chiaro che la storia è complessa. La PGE2 è una molecola a doppio taglio, e gli effetti dipendono dal contesto, dal tipo di cellula, dai recettori espressi e dallo stato di attivazione. Tuttavia, aver “mappato” questo asse AA-PGE2-EP specificamente nelle lesioni SM e aver identificato il potenziamento del segnale EP2 sulla microglia ci offre una nuova prospettiva.
Capire a fondo questi meccanismi locali è fondamentale. Potrebbe aprire la strada a future terapie più mirate, che magari non blocchino indiscriminatamente l’infiammazione (con tutti gli effetti collaterali), ma che riescano a potenziare le vie di risoluzione endogene, come forse quella mediata da PGE2-EP2, aiutando il cervello a “spegnere” quel fuoco che nella SM fatica a estinguersi. Il viaggio è appena iniziato, ma la mappa che abbiamo iniziato a tracciare è già ricca di indizi preziosi!
Fonte: Springer







