Macrofagi Superpotenziati nei Linfonodi: La Nuova Frontiera dell’Immunoterapia Contro il Cancro?
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta succedendo nel mondo della ricerca contro il cancro. L’immunoterapia, sapete, quella strategia che “insegna” al nostro sistema immunitario a riconoscere e combattere le cellule tumorali, ha già cambiato la vita di molti pazienti. Ma, come in tutte le grandi storie, ci sono ancora sfide da superare. Non tutte le persone rispondono alle terapie attuali, e a volte gli effetti collaterali possono essere pesanti. Ecco perché noi ricercatori siamo sempre alla ricerca di nuovi modi per rendere l’immunoterapia più efficace e mirata. E se vi dicessi che la chiave potrebbe trovarsi in cellule immunitarie specifiche, i macrofagi, e in un luogo ben preciso, i linfonodi?
I protagonisti nascosti: i macrofagi CD169+
Forse avete sentito parlare dei linfociti T, i “soldati” del nostro sistema immunitario che attaccano direttamente il cancro. Ma come fanno questi soldati a sapere chi attaccare? Qui entrano in gioco altre cellule, come i macrofagi. In particolare, un tipo di macrofagi presenti nei linfonodi, chiamati macrofagi CD169+, sembrano essere dei veri e propri “addestratori”. Catturano pezzetti del tumore (gli antigeni) e li presentano ai linfociti T, attivandoli e scatenando la risposta immunitaria. Pensate ai linfonodi come a delle caserme dove avviene l’addestramento! Studi recenti, anche su campioni di pazienti oncologici, hanno mostrato che dove ci sono tanti macrofagi CD169+ nei linfonodi, ci sono anche più cellule T citotossiche (i CTL, i soldati più agguerriti) nel tumore, e questo spesso si associa a una prognosi migliore. Abbiamo visto, analizzando immagini ad altissima risoluzione di linfonodi umani, che queste cellule sono davvero vicine, quasi a contatto, suggerendo una forte interazione. È chiaro che potenziare questi macrofagi CD169+ potrebbe essere una strategia vincente.
La sfida dell’Interferone Alfa (IFNα)
Come possiamo potenziare questi macrofagi? Una molecola promettente è l’Interferone alfa (IFNα). È noto che l’IFNα può “accendere” i macrofagi, facendogli esprimere proprio quella molecola, la CD169, che li rende così bravi ad attivare le cellule T. L’IFNα è stato usato in passato come farmaco antitumorale, ma con successi limitati e diversi problemi:
- Scarsa distribuzione ai linfonodi: L’IFNα è una molecola relativamente piccola e fatica a raggiungere i linfonodi in quantità sufficiente dopo un’iniezione.
- Mancanza di specificità: Moltissime cellule nel nostro corpo hanno recettori per l’IFNα. Questo significa che per avere un effetto sui macrofagi dei linfonodi, bisognerebbe usarne dosi alte, causando però effetti collaterali in tutto il corpo.
Insomma, l’idea era buona, ma serviva un modo per “consegnare” l’IFNα esattamente dove serve: ai macrofagi CD169+ nei linfonodi.
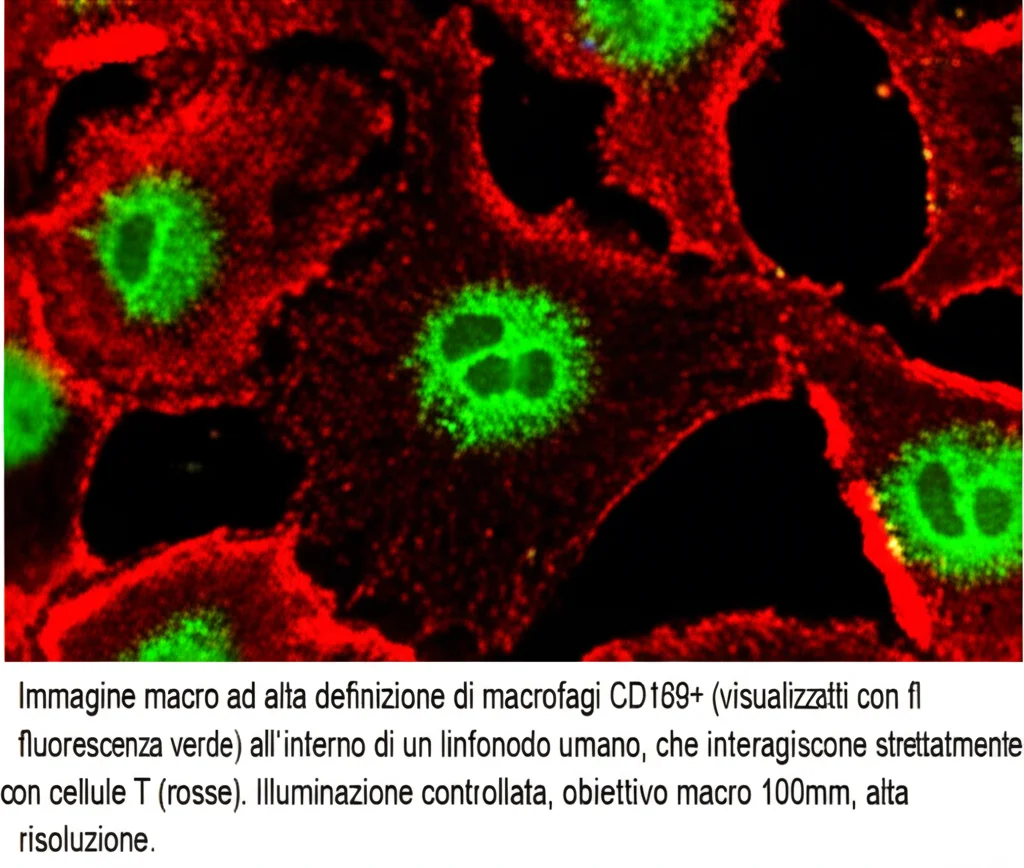
La nostra Mossa Astuta: Man-MSA-mIFNα
Ed ecco la nostra idea, un po’ come costruire un “cavallo di Troia” molecolare! Abbiamo pensato di sfruttare un’altra molecola, l’albumina sierica (MSA nella versione murina che abbiamo usato per gli esperimenti, HSA in quella umana). L’albumina è una proteina grande, la più abbondante nel sangue, e ha la capacità naturale di viaggiare bene attraverso i vasi linfatici e raggiungere i linfonodi. Inoltre, abbiamo modificato geneticamente questa albumina aggiungendole delle catene di uno zucchero chiamato mannosio (creando la Man-MSA). Perché il mannosio? Perché i macrofagi hanno sulla loro superficie dei recettori specifici per il mannosio, come delle piccole serrature. La nostra Man-MSA, quindi, agisce come una chiave che si lega preferenzialmente ai macrofagi.
A questo punto, abbiamo fuso insieme la Man-MSA (il nostro veicolo mirato e capace di raggiungere i linfonodi) con l’IFNα murino (mIFNα, il nostro carico attivo). Il risultato è una proteina ibrida che abbiamo chiamato Man-MSA-mIFNα. L’obiettivo? Far sì che questa proteina viaggiasse fino ai linfonodi, venisse catturata specificamente dai macrofagi grazie al mannosio, e una volta dentro, rilasciasse l’effetto potenziante dell’IFNα, inducendo il fenotipo CD169+.
Ha funzionato? Gli esperimenti parlano chiaro
Abbiamo messo alla prova la nostra Man-MSA-mIFNα con una serie di esperimenti su modelli animali (topi). Prima di tutto, abbiamo verificato che la proteina fosse ben formata e stabile. Poi, abbiamo seguito il suo percorso nel corpo dopo l’iniezione. I risultati sono stati entusiasmanti:
- La Man-MSA-mIFNα raggiungeva i linfonodi molto più efficacemente dell’IFNα da solo.
- Una volta nei linfonodi, veniva catturata in modo preferenziale proprio dai macrofagi, grazie al mannosio.
- Il trattamento con Man-MSA-mIFNα induceva un aumento significativo dell’espressione di CD169 sui macrofagi dei linfonodi, molto più potente rispetto all’IFNα normale o all’IFNα fuso con albumina non mannosilata (MSA-mIFNα).
Ma la prova del nove era vedere se tutto questo si traduceva in un effetto antitumorale. Abbiamo testato la Man-MSA-mIFNα su topi con diversi tipi di tumore. È stato interessante notare che l’effetto era particolarmente marcato nei tumori considerati “non immunogenici” (come il carcinoma della vescica MB49 o il carcinoma polmonare LLC), cioè quei tumori che di solito non scatenano una forte risposta immunitaria spontanea e sono spesso più difficili da trattare. In questi modelli, la Man-MSA-mIFNα ha rallentato significativamente la crescita tumorale. E come previsto, questo effetto era associato a una maggiore attivazione delle cellule T CD8+ (i nostri soldati killer) nei linfonodi e a un loro maggior numero all’interno del tumore stesso.
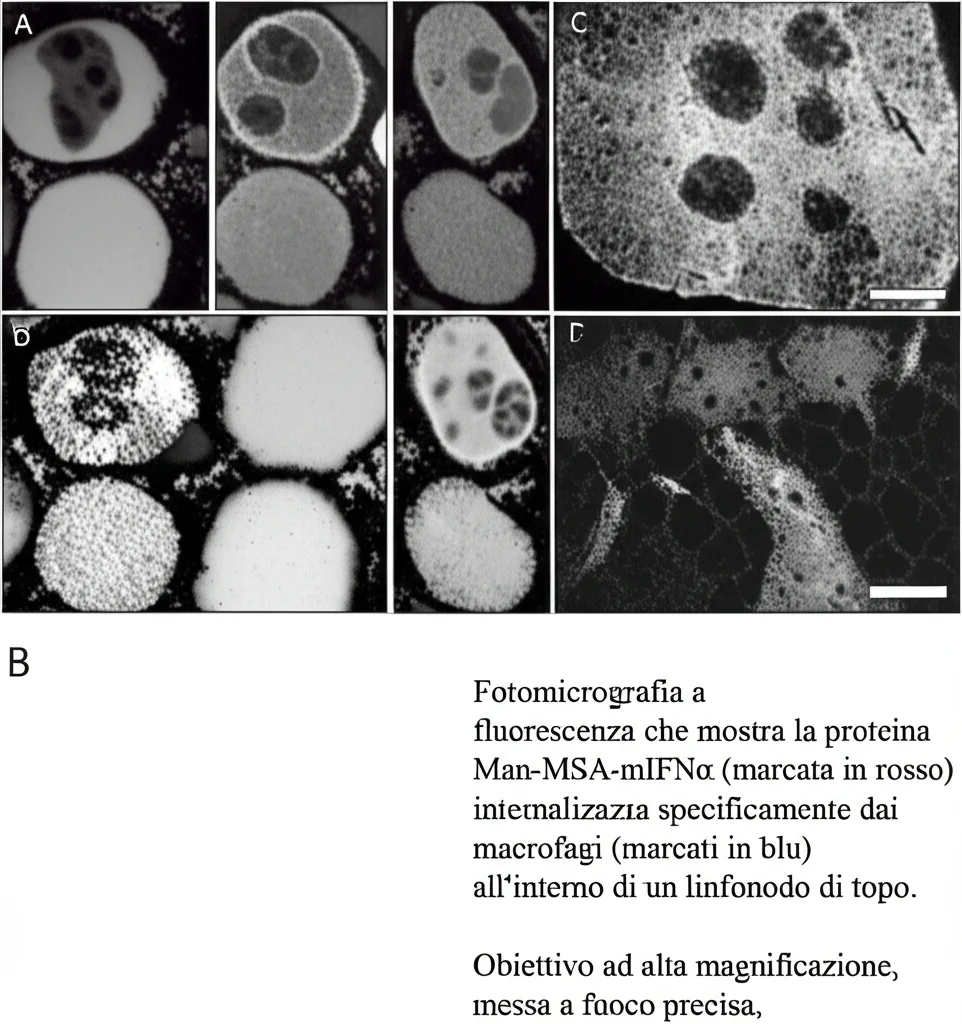
Per essere sicuri che l’effetto dipendesse proprio dai macrofagi CD169+ e dalle cellule T CD8+, abbiamo fatto altri esperimenti:
- Se eliminavamo chirurgicamente i linfonodi che drenavano il tumore, l’effetto della Man-MSA-mIFNα spariva.
- Se usavamo topi speciali in cui potevamo eliminare selettivamente i macrofagi CD169+ (topi CD169-DTR), la Man-MSA-mIFNα non aveva più alcun effetto antitumorale e non attivava le cellule T CD8+.
- Se eliminavamo le cellule T CD8+ con degli anticorpi specifici, l’effetto antitumorale della Man-MSA-mIFNα veniva annullato.
Tutto questo conferma che la nostra strategia funziona proprio come l’avevamo pensata: la Man-MSA-mIFNα potenzia i macrofagi CD169+ nei linfonodi, i quali a loro volta attivano le cellule T CD8+ che vanno a combattere il tumore.
Potenziare i potenziatori: l’unione fa la forza con gli inibitori dei checkpoint
Una delle sfide attuali dell’immunoterapia con gli inibitori dei checkpoint immunitari (come gli anti-PD-1/PD-L1) è che funzionano meglio quando ci sono già delle cellule T nel tumore. Ma se il tumore è “freddo”, cioè con poche cellule T, questi farmaci possono essere inefficaci. La nostra Man-MSA-mIFNα, aumentando proprio l’infiltrazione di cellule T CD8+ nel tumore, sembra perfetta per “scaldare” questi tumori freddi!
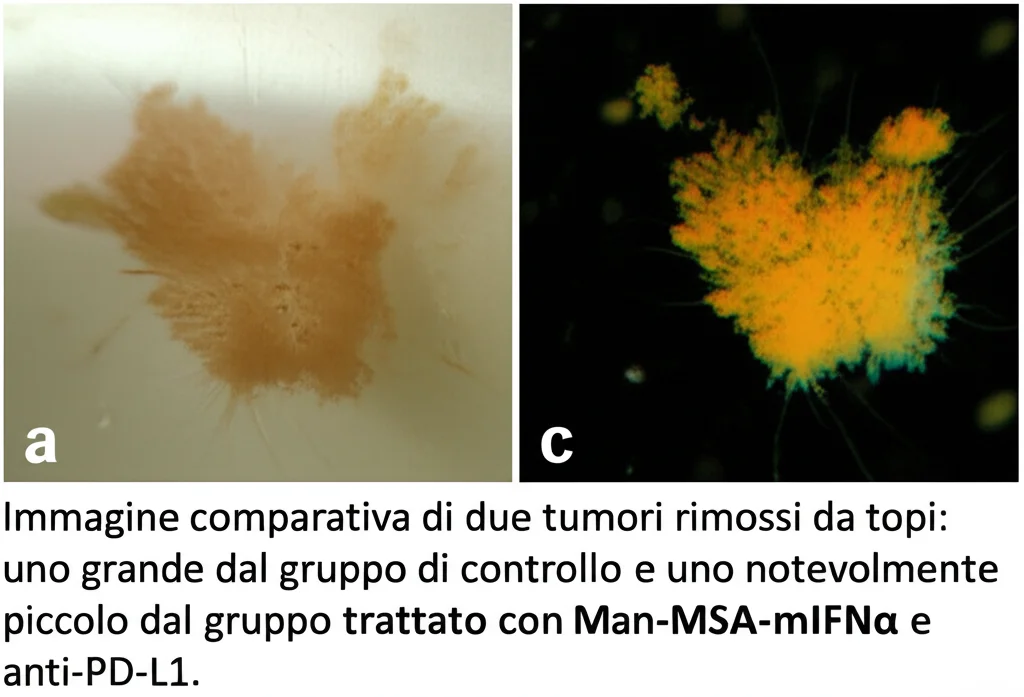
Abbiamo quindi provato a combinare la Man-MSA-mIFNα con un anticorpo anti-PD-L1 in topi con il tumore MB49, noto per essere resistente alla monoterapia con anti-PD-L1. I risultati sono stati spettacolari! La combinazione ha ridotto la crescita tumorale molto più efficacemente rispetto ai singoli trattamenti e ha aumentato significativamente la sopravvivenza degli animali. Abbiamo visto più cellule T attivate nel tumore e anche segni di maggiore morte cellulare tumorale (apoptosi) e minore crescita (Ki67). Addirittura, trattando un tumore su un fianco del topo, abbiamo visto un effetto anche su un secondo tumore sull’altro fianco, suggerendo una risposta immunitaria sistemica! Questo suggerisce che la nostra Man-MSA-mIFNα potrebbe agire come un vero “immune booster”, un potenziatore immunitario capace di rendere efficaci altre terapie anche in pazienti che oggi non rispondono.
Sicurezza e prospettive future
Un aspetto fondamentale è la sicurezza. Gli alti dosaggi di IFNα possono causare effetti collaterali. Ma grazie al nostro approccio mirato, abbiamo potuto usare dosi efficaci di Man-MSA-mIFNα senza osservare nei topi effetti collaterali significativi come perdita di peso, danni al fegato o ai reni, o alterazioni delle cellule del sangue. Questo è un grande vantaggio!
Cosa ci riserva il futuro? Stiamo già lavorando alla versione umana di questa proteina (Man-HSA-hIFNα) e abbiamo dati preliminari che mostrano come sia in grado di indurre il fenotipo CD169+ anche sui macrofagi umani derivati da monociti. L’idea è quella di poter un giorno usare questa strategia per trattare pazienti oncologici, magari selezionando quelli che hanno bassi livelli di macrofagi CD169+ nei linfonodi (diagnosticabili con una biopsia) e che quindi potrebbero beneficiare maggiormente di questo “boost”. Potrebbe diventare uno strumento prezioso da combinare con altre immunoterapie o terapie tradizionali per combattere i tumori più resistenti.
È un percorso ancora lungo, ma i risultati sono davvero promettenti. Aver trovato un modo per “risvegliare” e potenziare questi specifici macrofagi nei linfonodi apre scenari nuovi ed entusiasmanti nella lotta contro il cancro. Continueremo a lavorare sodo, sperando di poter trasformare presto questa scoperta in una nuova speranza per i pazienti!
Fonte: Springer