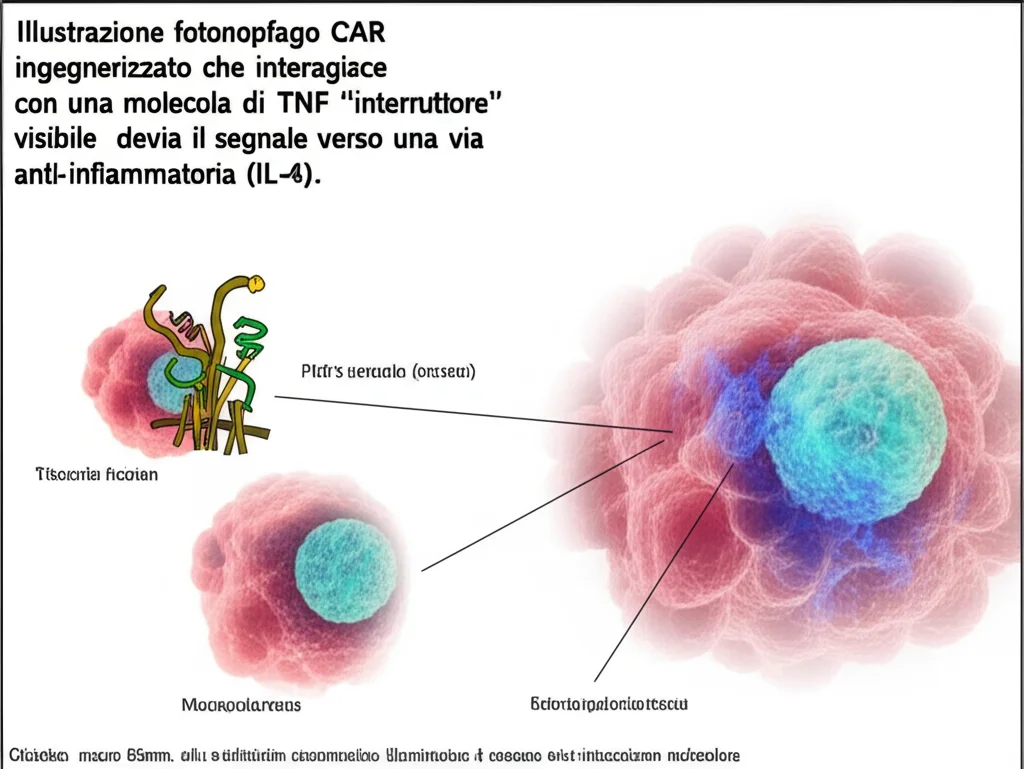
Macrofagi CAR: I Nuovi Guardiani Anti-Infiammatori con un Interruttore Segreto!
Amici, parliamoci chiaro: l’infiammazione è una brutta bestia. Certo, a volte è una risposta naturale del nostro corpo per difendersi, ma quando diventa cronica o sfugge di mano, può fare danni seri, portando a malattie croniche e persino al cedimento degli organi. E le armi che abbiamo oggi? Spesso sono farmaci con effetti collaterali pesanti e un’efficacia che lascia a desiderare, soprattutto nelle patologie croniche. Ma se vi dicessi che nel nostro corpo ci sono dei veri e propri “spazzini” specializzati, i macrofagi, che potrebbero diventare i nostri nuovi supereroi?
Macrofagi: eroi… un po’ instabili
Queste cellule sono fantastiche: pattugliano il corpo, eliminano patogeni e sostanze nocive, e giocano un ruolo chiave nel regolare l’infiammazione e promuovere la guarigione. Abbiamo già visto, noi e altri ricercatori, che somministrare macrofagi “buoni”, quelli anti-infiammatori (chiamati M2), può ridurre i danni in vari modelli di malattia. Il problema? Questi M2 sono un po’ “volubili”. Una volta esposti all’ambiente infiammato di un organo malato, possono cambiare bandiera e trasformarsi in promotori dell’infiammazione (M1). Un bel guaio, no?
L’ispirazione dalla lotta contro il cancro: le cellule CAR-T
Qui entra in gioco un’idea che ha rivoluzionato l’oncologia: la terapia con cellule CAR-T. Avete presente? Si prendono i linfociti T del paziente, li si “arma” in laboratorio con un recettore chimerico (CAR) che li indirizza specificamente contro le cellule tumorali, e poi li si reinfonde. Un successo strepitoso contro alcuni tumori del sangue! E allora ci siamo chiesti: e se potessimo usare una strategia simile, ma con i macrofagi, e non per attaccare, ma per… calmare?
Nascono i Macrofagi CAR (CAR-M) con “Interruttore di Segnale”
Ed ecco la nostra pensata: abbiamo sviluppato dei macrofagi CAR (CAR-M) progettati per fare proprio questo. Ma c’è un trucco, un vero e proprio “interruttore di segnale”. Immaginate un recettore CAR speciale: la parte esterna è come un’antenna che riconosce una delle principali molecole infiammatorie, il fattore di necrosi tumorale (TNF). Quando il CAR-M incontra il TNF nel tessuto infiammato, questa antenna lo “cattura”. E qui scatta la magia: invece di attivare una risposta infiammatoria (come farebbe normalmente il TNF), il nostro CAR è collegato internamente a un pezzetto del recettore per l’interleuchina-4 (IL-4). L’IL-4 è una citochina che dice ai macrofagi: “Ehi, ragazzi, calma, passiamo alla modalità anti-infiammatoria e ripariamo i tessuti!”. In pratica, il nostro CAR-M “sente” il segnale di pericolo (TNF) e lo trasforma in un ordine di “cessate il fuoco e ricostruite” (segnale IL-4). Geniale, vero?
Per essere sicuri che tutto funzionasse a dovere, abbiamo usato vettori lentivirali per inserire il nostro CAR nei macrofagi. Abbiamo visto che questa tecnica, a differenza di altre, induce solo una transitoria attivazione pro-infiammatoria, il che è perfetto per il nostro scopo. Una volta che il CAR è espresso, se il macrofago incontra il TNF, si attivano tutte le vie di segnalazione a valle dell’IL-4, come p-STAT6 e p-AKT, e compaiono sulla superficie del macrofago marcatori tipici degli M2, come CD206 ed EGR2. In pratica, il macrofago si “trasforma” in un M2 super efficiente, capace di aumentare la fagocitosi (cioè “mangiare” le cellule morte o danneggiate) e di sopprimere la proliferazione dei linfociti T, che spesso alimentano l’infiammazione. Abbiamo anche visto che questo meccanismo funziona sia con il TNF solubile che con quello immobilizzato sulle cellule.
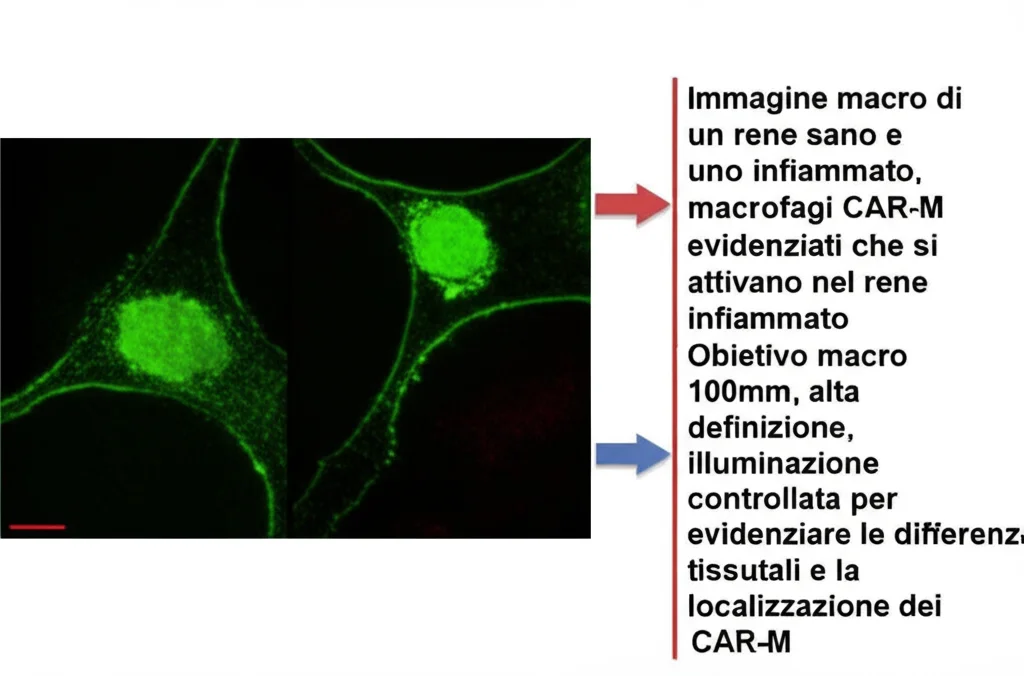
Alla prova dei fatti: i CAR-M contro l’infiammazione acuta del rene
Non ci siamo fermati alla teoria, ovviamente! Abbiamo testato i nostri CAR-M in modelli murini di danno renale acuto da ischemia-riperfusione (IRI), una condizione in cui il rene soffre per una temporanea mancanza di sangue. E i risultati? Fantastici! I CAR-M infusi si sono diretti selettivamente verso il rene infiammato (e non verso quello sano o altri organi sani, a parte un normale accumulo nel fegato) e, una volta lì, attivati dal TNF locale, si sono trasformati in cellule anti-infiammatorie, riducendo il danno ai tubuli renali, migliorando la funzionalità del rene (misurata dalla creatinina sierica) e diminuendo l’infiltrazione di neutrofili e l’espressione di citochine/chemochine infiammatorie. La cosa ancora più interessante è che, una volta che l’infiammazione si è risolta e il TNF è sparito (dopo circa 8 giorni), anche i nostri CAR-M hanno “spento” il loro fenotipo anti-infiammatorio. Un meccanismo di azione preciso e “on-demand”! Per confermare che fosse proprio il TNF il motore di questo effetto, abbiamo ripetuto l’esperimento in topi geneticamente privi di TNF: in questi animali, i CAR-M non hanno mostrato alcun effetto protettivo e non si sono convertiti in M2, anzi, tendevano a diventare pro-infiammatori. Questo dimostra in modo inequivocabile che l’effetto terapeutico è TNF-dipendente.
E nelle malattie croniche? I CAR-M non deludono!
Ma la vera sfida, spesso, sono le malattie infiammatorie croniche. Abbiamo quindi testato i CAR-M in un modello di nefropatia cronica indotta da Adriamicina (AN), che causa glomerulosclerosi e danno tubulare. In questo scenario, i livelli di TNF nel rene rimangono alti per settimane. Ebbene, i nostri CAR-M, somministrati una sola volta, hanno mantenuto il loro fenotipo anti-infiammatorio (come dimostrato dalla co-espressione di CD206) per tutto questo tempo, migliorando significativamente la funzione renale, riducendo la proteinuria, la sclerosi glomerulare, il danno tubulare e persino la fibrosi renale. Un risultato notevole, soprattutto se pensiamo che la terapia con i soli macrofagi M2 “standard” in questo modello cronico fallisce, proprio perché tendono a “convertirsi” al lato oscuro infiammatorio. I nostri CAR-M, invece, grazie all’interruttore di segnale, rimangono fedeli alla loro missione anti-infiammatoria per settimane, finché c’è TNF a stimolarli. Abbiamo anche osservato che i CAR-M riducono l’attività citotossica dei linfociti T CD8, che sono tra i principali responsabili del danno renale in questo modello.
Non solo reni: i CAR-M al soccorso del fegato
Per dimostrare la versatilità di questo approccio, abbiamo messo alla prova i CAR-M anche in un modello di danno epatico acuto da ischemia-riperfusione. E anche qui, i risultati sono stati eccellenti: i CAR-M hanno ridotto la necrosi epatocitaria, migliorato la funzione del fegato (abbassando i livelli di ALT e AST) e diminuito l’infiltrazione di neutrofili e l’infiammazione, addirittura con un effetto protettivo superiore a quello dei macrofagi M2. Anche nel fegato infiammato, i CAR-M si sono convertiti al fenotipo M2, confermando la loro capacità di agire in diversi contesti patologici. È importante notare che i CAR-M infusi persistono nell’organismo per circa 20 giorni a livelli elevati, per poi diminuire drasticamente entro i 60 giorni, indipendentemente dalla presenza di infiammazione acuta o cronica.
Un passo verso l’uomo: i CAR-M umani
Ovviamente, l’obiettivo finale è aiutare i pazienti. Per questo, abbiamo anche creato e testato in vitro dei CAR-M umani, utilizzando un CAR che riconosce il TNF umano (basato sull’anticorpo Infliximab) e attiva la via di segnalazione dell’IL-4 umana. I risultati preliminari sono molto incoraggianti: anche i CAR-M umani, derivati da monociti di sangue periferico, esprimono efficientemente il CAR e, quando stimolati con TNF, attivano le vie di segnalazione dell’IL-4 (p-STAT6, p-AKT, p-JAK3), aumentano l’espressione di marcatori M2 come CD206 e CD200R, producono IL-10 (una citochina anti-infiammatoria), sopprimono la proliferazione dei linfociti T e aumentano la capacità di eliminare cellule apoptotiche. In pratica, mostrano la capacità di “convertire” il segnale del TNF in una risposta anti-infiammatoria e pro-riparativa, proprio come i loro cugini murini. È la base per futuri studi preclinici più approfonditi e, speriamo, per trial clinici.
Perché i CAR-M con “interruttore” sono così promettenti?
Questo approccio basato sui CAR-M con interruttore di segnale ha delle caratteristiche uniche che lo rendono particolarmente interessante:
- Specificità d’azione: Si attivano solo dove c’è infiammazione (dove c’è TNF).
- Reversibilità: Quando l’infiammazione si placa e il TNF diminuisce, i CAR-M tornano “silenti”, evitando un’immunosoppressione prolungata e non necessaria.
- Stabilità fenotipica: Superano il problema dell’instabilità dei macrofagi M2 tradizionali, che possono convertirsi in M1 pro-infiammatori.
- Sicurezza potenziale: A differenza delle cellule CAR-T, i macrofagi non si auto-proliferano in modo massiccio e la loro persistenza nel corpo è di settimane, non anni, riducendo i rischi di effetti collaterali a lungo termine come la sindrome da rilascio di citochine.
- Funzioni riparative: Oltre a sopprimere l’infiammazione, i CAR-M promuovono attivamente la guarigione dei tessuti, ad esempio fagocitando le cellule morte e promuovendo la rigenerazione cellulare.
- Versatilità: L’approccio sembra funzionare in diversi organi e sia in condizioni acute che croniche.
Un futuro pieno di speranza per la lotta all’infiammazione
Certo, la strada per l’applicazione clinica è ancora lunga e ci sono sfide da superare. Ma i risultati che abbiamo ottenuto sono una solida base di partenza. L’idea di “dirottare” un segnale infiammatorio per trasformarlo in uno strumento di guarigione è, a mio parere, rivoluzionaria. Stiamo parlando di una potenziale nuova arma terapeutica per un’ampia gamma di malattie acute e croniche, dalle patologie renali ed epatiche all’artrite, al diabete, alle malattie cardiovascolari e neurologiche. Insomma, i nostri macrofagi CAR con interruttore di segnale potrebbero davvero cambiare le regole del gioco nella gestione dell’infiammazione. E io non vedo l’ora di vedere cosa ci riserverà il futuro!
Fonte: Springer