Lupus: Abbiamo Trovato i Monociti ‘Spia’ dell’Interferone! La Nuova Frontiera della Ricerca
Ciao a tutti, appassionati di scienza e scoperte! Oggi voglio portarvi con me in un viaggio affascinante nel cuore di una malattia complessa e ancora per molti versi misteriosa: il Lupus Eritematoso Sistemico (LES). Sapete, il LES è un po’ un camaleonte: una malattia autoimmune cronica che può colpire quasi ogni organo, causando infiammazione e danni tissutali diffusi. Un vero rompicapo per medici e ricercatori.
Il Grande Sospettato: l’Interferone di Tipo I
Da tempo sappiamo che un protagonista chiave in questa intricata vicenda è l’interferone di tipo I (IFN-I). Immaginatelo come un potente messaggero del sistema immunitario, fondamentale nelle risposte antivirali. Nel LES, però, qualcosa va storto: c’è una produzione eccessiva di IFN-I, che finisce per gettare benzina sul fuoco dell’infiammazione e dell’autoimmunità. È come se il sistema di allarme del corpo impazzisse, suonando continuamente e attivando le “truppe” sbagliate.
I Monociti: Soldati Chiave, Ma con Ruoli da Decifrare
E qui entrano in gioco i monociti. Queste cellule immunitarie sono fondamentali, e nel LES contribuiscono significativamente alla produzione di IFN-I. Tuttavia, il loro ruolo specifico, soprattutto considerando che non sono tutti uguali, era ancora poco chiaro. Esistono infatti diversi “tipi” di monociti (classici, intermedi, non classici), e sospettavamo che potessero avere compiti diversi in questa battaglia autoimmune. Capire queste differenze è cruciale.
La Nostra Missione: Svelare i Segreti dei Monociti nel LES
Per far luce su questo aspetto, ci siamo armati degli strumenti più avanzati. Abbiamo usato la bioinformatica e analisi statistiche sofisticate (come RRA, DESeq2, limma – nomi tecnici, ma pensateli come potentissime lenti d’ingrandimento digitali) per scandagliare i dati trascrittomici (cioè l’insieme degli RNA messaggeri, le “istruzioni operative” delle cellule) di cellule mononucleate del sangue periferico (PBMC) e monociti isolati da pazienti con LES e controlli sani.
Ma non ci siamo fermati qui! Abbiamo utilizzato una tecnologia rivoluzionaria chiamata sequenziamento dell’RNA a singola cellula (scRNA-seq). Questa tecnica ci permette di analizzare l’espressione genica cellula per cellula, svelando una eterogeneità incredibile che prima ci sfuggiva. È come passare da una foto sfocata di una folla a ritratti dettagliati di ogni singola persona! Con l’aiuto del pacchetto software Seurat R, abbiamo identificato e caratterizzato sottogruppi specifici di monociti che mostravano una forte “firma” genica legata all’interferone.
Infine, per essere sicuri che le nostre scoperte digitali corrispondessero alla realtà biologica, abbiamo usato la citometria a flusso. Questa tecnica ci permette di “etichettare” e contare cellule specifiche in un campione di sangue, basandoci su molecole presenti sulla loro superficie o al loro interno. Abbiamo cercato marcatori specifici come CD14, SIGLEC1 e IRF7 per confermare la presenza e l’abbondanza dei sottogruppi di monociti identificati.
La Scoperta: Monociti “Riprogrammati” e la Firma SLERRAsignature
Cosa abbiamo scoperto? Innanzitutto, abbiamo confermato che i monociti nei pazienti con LES subiscono una vera e propria riprogrammazione trascrizionale guidata dall’interferone. Abbiamo identificato un gruppo di geni, chiamati geni della firma dell’interferone (ISG), che sono particolarmente “accesi” in queste cellule. Tra questi spiccano IFI27, RSAD2, IFIT3, USP18 e DDX58. L’insieme di questi geni sovraregolati (ben 72 in totale!) l’abbiamo battezzato SLERRAsignature (SLE-Related Monocyte Signature).
Analizzando le interazioni tra le proteine prodotte da questi geni (analisi PPI con STRING), abbiamo visto che formano una rete complessa, fortemente implicata proprio nella via di segnalazione dell’interferone. Questo suggerisce che l’espressione anomala di questi geni amplifica la risposta infiammatoria nel LES.
La cosa interessante è che questa SLERRAsignature non è solo un marcatore passivo: analizzando i dati con GSEA (Gene Set Enrichment Analysis), abbiamo visto che è significativamente arricchita nei pazienti con LES e che il suo “punteggio” (calcolato con GSVA) potrebbe addirittura aiutare a diagnosticare la malattia (con un’ottima AUC di 0.93 nell’analisi ROC). Un potenziale strumento diagnostico basato sui monociti!
Zoom sui Sottogruppi: Cambiamenti nella Composizione e il Ruolo di CD14Mono8
Grazie all’analisi scRNA-seq su campioni di pazienti con diversi stati di malattia (inattiva, severa, riacutizzazione o “flare”) e controlli sani, abbiamo potuto vedere come cambia la “popolazione” dei fagociti mononucleati (che includono monociti e cellule dendritiche). Abbiamo identificato ben 9 sottogruppi di monociti CD14+ (CD14Mono1-9), 2 sottogruppi CD16+ (CD16Mono1-2) e 2 tipi di cellule dendritiche (cDC e pDC).
Confrontando i gruppi, abbiamo notato alcune differenze: nei pazienti LES c’era una frequenza maggiore di CD14Mono4 e CD16Mono2, mentre le pDC tendevano a diminuire. Ma la scoperta più intrigante è stata una tendenza all’aumento della proporzione del sottogruppo CD14Mono8 nei pazienti durante una fase di riacutizzazione (flare). Questo suggerisce che i monociti CD14Mono8 potrebbero giocare un ruolo cruciale nell’esacerbazione della malattia e forse diventare un biomarker per prevedere le riacutizzazioni.
Analizzando i geni espressi differentemente (DEG) in questi sottogruppi, abbiamo visto che nei pazienti LES, soprattutto quelli con malattia severa, i geni sovraregolati erano prevalentemente ISG (come ISG15, IFITM3, LY6E, IFI6, IFI44L, EPSTI1, STAT1). L’analisi GSEA sul sottogruppo CD14Mono8 ha confermato un arricchimento significativo di vie legate all’interferone (risposta a IFN-α, IFN-γ, difesa da infezioni virali). Insomma, più grave è il LES, più forte è l’impronta dell’interferone su questi monociti.
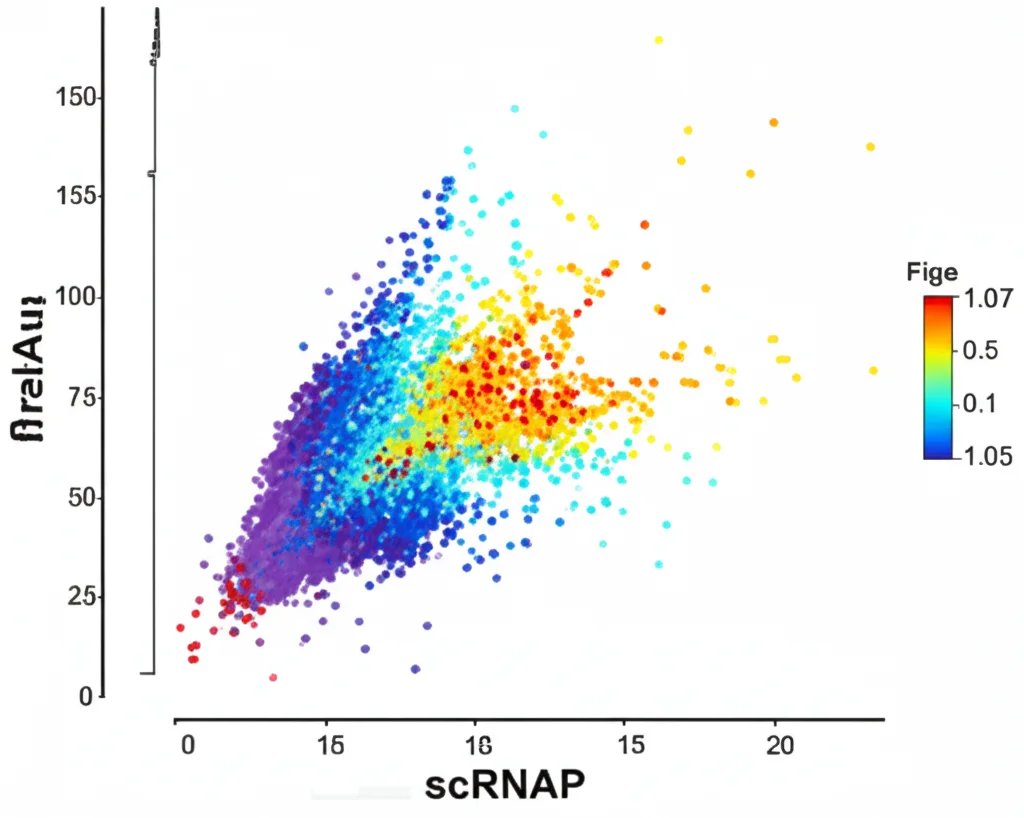
La Star Nascosta: I Monociti SIGLEC1+IRF7+
Scavando ancora più a fondo con dati scRNA-seq di altissima qualità (selezionati rigorosamente!), abbiamo fatto una scoperta davvero emozionante. Tra i vari sottogruppi di monociti CD14+, ne abbiamo identificato uno, chiamato CD14Mono7, che esprimeva alti livelli di due molecole chiave: SIGLEC1 (noto anche come CD169) e IRF7. IRF7 è un fattore di trascrizione cruciale per la produzione di IFN-α! Questo sottogruppo, quindi, sembrava particolarmente equipaggiato per partecipare al circolo vizioso dell’interferone.
La cosa ancora più sorprendente? Abbiamo trovato questi monociti SIGLEC1+IRF7+ (CD14Mono7) anche nel sangue di individui sani! È la prima volta che questo specifico sottogruppo viene identificato chiaramente nel sangue periferico sano tramite scRNA-seq. Anche nei sani, queste cellule mostrano livelli più alti di SIGLEC1, IRF7 e STAT1 rispetto agli altri monociti. Dati di citometria di massa hanno confermato la presenza di monociti SIGLEC1+ nei sani, principalmente tra i CD14+. Forse, in condizioni normali, queste cellule hanno un ruolo nel mantenere l’equilibrio immunitario? È un’ipotesi affascinante da esplorare.
Abbiamo creato delle “firme geniche” specifiche per questo e altri sottogruppi, verificandole con strumenti come AUCell e GSVA. Abbiamo anche creato una firma specifica per CD14Mono7 escludendo gli ISG comuni ad altre cellule immunitarie (CD14Mono7NoISGs), per poterla tracciare meglio nei dati di sangue intero.
La Prova del Nove: Correlazione Clinica e Conferma Sperimentale
Armati di queste firme geniche, siamo tornati ad analizzare i dati di trascrittomica (sia da PBMC che da sangue intero) di pazienti LES. Risultato? Le firme CD14Mono7 e CD14Mono7NoISGs erano significativamente arricchite nei pazienti LES, suggerendo un aumento di queste cellule. Inoltre, analizzando un dataset specifico (GSE88884) che conteneva dati clinici, abbiamo trovato una correlazione positiva significativa tra il punteggio di arricchimento delle firme CD14Mono7/CD14Mono7NoISGs e l’indice di attività della malattia (SLEDAI). Non solo: la firma era correlata negativamente con i livelli di complemento C3 e C4 (che diminuiscono quando il LES è attivo) e positivamente con i titoli di anticorpi anti-dsDNA (un classico marcatore di LES). Bingo! Questo lega direttamente l’espansione di questo sottogruppo alla gravità del Lupus.
Infine, la conferma sperimentale con la citometria a flusso su campioni di sangue freschi di 31 pazienti LES (divisi per attività di malattia) e 10 controlli sani. I risultati sono stati netti:
- La percentuale di monociti CD14+SIGLEC1+ era significativamente più alta nei pazienti LES rispetto ai controlli.
- La percentuale di monociti CD14+SIGLEC1+IRF7+ (il nostro sottogruppo CD14Mono7!) era anch’essa significativamente più alta nei pazienti LES.
- Ancora più importante: la percentuale di monociti CD14+SIGLEC1+IRF7+ era significativamente più alta nei pazienti con malattia più attiva (SLEDAI > 10) rispetto a quelli con malattia meno attiva (SLEDAI ≤ 10), e entrambi i gruppi erano significativamente più alti dei controlli sani.
Questo conferma che l’aumento dei monociti CD14+SIGLEC1+IRF7+ non solo distingue i pazienti LES dai sani, ma riflette anche la severità della malattia.

Cosa Significa Tutto Questo?
Il nostro studio ha fatto un passo avanti importante. Abbiamo dimostrato che nel LES non solo i monociti sono influenzati dall’interferone, ma che specifici sottogruppi si espandono, in particolare questo nuovo attore: i monociti CD14+SIGLEC1+IRF7+. Queste cellule, cariche di geni legati all’interferone e presenti in quantità maggiori nei pazienti con malattia attiva, sembrano giocare un ruolo cruciale nella patogenesi del LES.
La scoperta di questo sottogruppo, presente anche nei sani ma espanso e correlato alla gravità nel LES, apre scenari entusiasmanti:
- Biomarcatori Potenziali: Monitorare la percentuale di monociti CD14+SIGLEC1+IRF7+ potrebbe diventare un nuovo modo per valutare l’attività del LES e forse prevedere le riacutizzazioni.
- Target Terapeutici Potenziali: Se queste cellule sono così importanti nel guidare la malattia, potrebbero diventare un bersaglio per nuove terapie mirate a “spegnere” l’infiammazione nel LES.
Certo, la strada è ancora lunga. Serviranno studi più ampi, magari integrando dati bulk e single-cell in modo ancora più stretto, e bisognerà capire esattamente cosa fanno queste cellule e come interagiscono con il resto del sistema immunitario. Ma aver identificato questo specifico sottogruppo di monociti è un passo fondamentale che ci dà nuove speranze e nuove direzioni per combattere il Lupus. Continuate a seguirci per i prossimi aggiornamenti!
Fonte: Springer