Long COVID: Viaggio nel Sistema Immunitario Scombussolato dei Pazienti Non Vaccinati
Ciao a tutti! Oggi voglio portarvi con me in un’indagine affascinante, quasi da detective, nel complesso mondo del nostro sistema immunitario, in particolare quando si scontra con quel nemico subdolo che è stato il SARS-CoV-2. Parliamo di Long COVID, quella condizione che lascia strascichi fastidiosi e persistenti ben oltre la fase acuta dell’infezione. Cosa succede davvero dentro di noi? Perché alcuni, pur guariti dall’infezione iniziale, continuano a stare male per mesi, a volte anni?
Nel nostro studio, ci siamo concentrati su un gruppo specifico di persone: pazienti non vaccinati che sono stati ricoverati in ospedale durante le prime ondate della pandemia (tra marzo e ottobre 2020). Volevamo capire se ci fossero delle “firme” immunologiche particolari, dei segnali specifici nel loro sangue, che potessero spiegare perché sviluppavano sintomi persistenti. Abbiamo seguito questi pazienti nel tempo, analizzando il loro sistema immunitario in modo super dettagliato, quasi “stratificato”, durante la malattia acuta (che chiamiamo T0) e poi a distanza di circa 3 mesi dalla comparsa dei sintomi (T1). E per chi continuava ad avere problemi, abbiamo fatto un ulteriore controllo a distanza di 3 anni (T2).
Come abbiamo indagato: mettere il sistema immunitario sotto la lente
Immaginatevi di avere una mappa super dettagliata del sistema immunitario. Ecco, noi abbiamo cercato di crearla per i nostri pazienti. Abbiamo guardato:
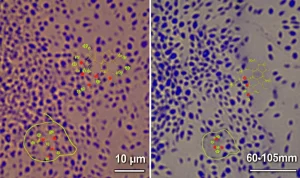
- Le cellule T e B, sia quelle specifiche che combattono direttamente il SARS-CoV-2, sia quelle “generiche”, usando una tecnica chiamata citometria a flusso.
- Gli anticorpi: quanti ce n’erano, quanto erano bravi a neutralizzare il virus e quanto erano capaci di attivare altre cellule immunitarie per distruggere le cellule infette (un processo chiamato ADCC).
- Le tracce di RNA virale nel sangue (RNAemia): c’era ancora “materiale genetico” del virus in circolazione anche dopo la fase acuta?
- Le citochine: molecole che sono come messaggeri dell’infiammazione e della risposta immunitaria.
Abbiamo confrontato 48 pazienti. Di questi, 38 (quasi l’80%!) a 3 mesi mostravano ancora sintomi (li abbiamo chiamati gruppo EPS+, Early Persistent Symptoms), mentre 10 stavano bene (gruppo EPS-). È importante notare che i due gruppi erano simili per età, sesso e gravità della malattia iniziale, quindi le differenze che abbiamo visto non dipendevano da questi fattori. I sintomi più comuni nel gruppo EPS+ erano stanchezza cronica (fatigue), difficoltà respiratorie (dispnea), perdita o alterazione di olfatto e gusto (anosmia/disgeusia), diarrea, dolori cronici e problemi di memoria o attenzione.
Cosa abbiamo scoperto: un sistema immunitario “fuori fase”
Qui le cose si fanno interessanti. Confrontando i due gruppi a 3 mesi (T1), abbiamo notato delle differenze significative nel modo in cui il loro sistema immunitario si era evoluto dopo la fase acuta (T0).
Nel gruppo con sintomi persistenti (EPS+), abbiamo visto che:
- La capacità degli anticorpi di neutralizzare il virus diminuiva drasticamente nel tempo, mentre nel gruppo guarito (EPS-) questa capacità aumentava. Un bel controsenso, vero?
- Anche se all’inizio (T0) tendevano ad avere più anticorpi totali contro la proteina RBD del virus (una parte chiave per l’infezione), questa quantità non aumentava significativamente nel tempo come succedeva nel gruppo EPS-.
- La capacità degli anticorpi di attivare l’ADCC (quel meccanismo di distruzione cellulare) non aumentava nel tempo come nel gruppo EPS-.
- Guardando le cellule B (le fabbriche degli anticorpi), quelle specifiche contro il virus (RBD-specifiche) e un tipo particolare di cellule B di memoria (le IgA+ MBCs, importanti per le mucose) non riuscivano ad aumentare nel tempo, a differenza del gruppo EPS-. Sembra quasi che la “maturazione” della risposta B fosse inceppata.
- Passando alle cellule T, abbiamo notato un aumento nel tempo di un tipo particolare di cellule T CD4 “effettrici di memoria” molto differenziate (chiamate TEMRA), ma questo aumento si vedeva solo nel gruppo EPS+. Queste cellule non sono necessariamente specifiche per il virus, potrebbero essere attivate “per sbaglio” (bystander activation).
- Al contrario, le cellule T CD4 specifiche contro il SARS-CoV-2 diminuivano nel tempo in entrambi i gruppi, ma questa riduzione sembrava più marcata nel gruppo EPS+.
- Tuttavia, alcune cellule T CD4 specifiche che producono citochine infiammatorie (come IFN-γ, IL-2, TNF-α) erano presenti a livelli più alti nel gruppo EPS+ in certi momenti (T0 o T1), suggerendo forse un tentativo “disperato” ma inefficace di combattere qualcosa.

In sostanza, nei pazienti con sintomi persistenti a 3 mesi, il sistema immunitario sembrava andare un po’ per conto suo: meno capacità neutralizzante, difficoltà a “raffinare” la risposta delle cellule B, e un accumulo di cellule T effettrici non specifiche (TEMRA) a fronte di una riduzione di quelle specifiche. Un quadro di disregolazione immunitaria su più livelli.
Il ruolo dell’RNA virale e dell’infiammazione
Ci siamo chiesti: cosa guida questa disregolazione? Abbiamo guardato all’RNAemia, cioè alla presenza di frammenti di RNA del virus nel sangue. Sorprendentemente, i livelli medi di RNAemia non erano significativamente diversi tra i due gruppi (EPS+ e EPS-) né al tempo T0 né al T1. Tuttavia, scavando più a fondo, abbiamo trovato delle correlazioni interessanti solo nel gruppo con sintomi persistenti (EPS+):
- All’inizio (T0), più alta era l’RNAemia, più alte erano le cellule CD4 TEMRA.
- A 3 mesi (T1), più alta era l’RNAemia, più alta era l’attività ADCC degli anticorpi.
Questo suggerisce che, anche se i livelli generali non differivano, la persistenza di materiale virale nel sangue potrebbe innescare risposte specifiche nei pazienti EPS+, spingendo verso l’accumulo di cellule T non specifiche (TEMRA) e verso un tipo di risposta anticorpale (ADCC) che, se eccessiva o mal diretta, potrebbe contribuire al danno tissutale. È un’ipotesi affascinante: forse non è tanto la quantità di virus residuo, ma come il sistema immunitario reagisce a quella presenza.
E l’infiammazione generale? Abbiamo misurato diverse citochine nel sangue. Anche qui, non abbiamo trovato differenze nette tra i gruppi EPS+ e EPS- a 3 mesi, né correlazioni forti tra queste citochine e la disregolazione immunitaria osservata. Sembra che, almeno in questa fase e in questi pazienti (che erano tutti gravemente malati all’inizio), l’infiammazione sistemica misurata nel sangue non fosse il motore principale dei sintomi persistenti a 3 mesi.

E a lungo termine? La sorpresa dei 3 anni
La storia si complica ulteriormente. Abbiamo ricontattato i pazienti del gruppo EPS+ (quelli con sintomi a 3 mesi) dopo circa 3 anni (T2). Di 33 che siamo riusciti a valutare, 10 avevano ancora sintomi persistenti (li abbiamo chiamati EPS+LPS+, Late Persistent Symptoms), mentre 23 erano finalmente guariti (EPS+LPS-). La domanda era: le differenze immunitarie che avevamo visto a 3 mesi (T1) potevano predire chi sarebbe stato ancora male a 3 anni?
La risposta è stata sorprendente: no. Analizzando i dati immunitari, l’RNAemia e le citochine misurate a T0 e T1, non abbiamo trovato differenze significative tra chi si sarebbe ripreso e chi no. Questo significa che la “fotografia” immunologica a 3 mesi, per quanto mostrasse una chiara disregolazione nei pazienti sintomatici, non era sufficiente a predire la persistenza dei sintomi a lunghissimo termine. Il Long COVID è davvero un puzzle complesso!

Cosa ci portiamo a casa?
Questo viaggio nel sistema immunitario dei pazienti non vaccinati con Long COVID ci ha insegnato molto. Abbiamo visto che chi ha sintomi persistenti a 3 mesi mostra una risposta immunitaria “sfasata” su più fronti: meno capacità di neutralizzare il virus, difficoltà a maturare la risposta delle cellule B (soprattutto IgA+ e specifiche per RBD), e un accumulo di cellule T effettrici (TEMRA) non specifiche, mentre quelle specifiche calano.
L’RNAemia, pur non essendo diversa in quantità tra chi ha sintomi e chi no, sembra giocare un ruolo subdolo, correlando con l’aumento delle cellule TEMRA all’inizio e con l’attività ADCC più tardi, suggerendo un possibile meccanismo di danno tissutale mediato da anticorpi in chi sviluppa Long COVID.
L’infiammazione sistemica misurata nel sangue, invece, non sembrava essere il fattore chiave in questa fase. E, cosa forse più importante, la disregolazione immunitaria osservata precocemente (a 3 mesi) non basta a spiegare chi continuerà ad avere sintomi per anni.
C’è ancora tantissimo da scoprire. Bisogna studiare più a fondo il legame tra RNAemia, persistenza virale magari nascosta in qualche tessuto, e questa strana risposta immunitaria. Il Long COVID rimane un avversario ostico, ma ogni studio come questo aggiunge un tassello importante per capirlo e, speriamo presto, per trovare modi efficaci per aiutare chi ne soffre. La ricerca non si ferma!
Fonte: Springer