DNA Danneggiato dagli Oncogeni: Abbiamo Scoperto Dove si Nasconde!
Ciao a tutti, appassionati di scienza e curiosi! Oggi voglio portarvi con me in un viaggio affascinante, quasi da detective, nel cuore pulsante delle nostre cellule, per capire qualcosa di più su un nemico subdolo: il cancro. In particolare, ci siamo concentrati su come certi “interruttori impazziti” – gli oncogeni – possano fare danni al nostro DNA e, soprattutto, dove preferiscano colpire.
Il Mistero del DNA Danneggiato: Dove Colpiscono gli Oncogeni?
Sappiamo che l’attivazione degli oncogeni è una delle scintille che possono innescare lo sviluppo del cancro. Questi geni, una volta “accesi” in modo anomalo, spingono le cellule a proliferare senza controllo e mettono sotto stress la replicazione del DNA. Immaginate un motore che va fuorigiri: prima o poi qualcosa si rompe. E infatti, questo stress porta a danni al DNA, che si accumulano in regioni specifiche del genoma, contribuendo a quella che chiamiamo instabilità genomica – un vero e proprio caos genetico che favorisce il cancro.
Però, c’è un “però”. L’interazione tra questi danni indotti dagli oncogeni e l’organizzazione della cromatina (il modo in cui il DNA è impacchettato nel nucleo) è ancora un campo pieno di misteri. La cromatina non è tutta uguale: c’è l’eucromatina, più “aperta” e attiva dal punto di vista trascrizionale (dove i geni vengono letti), e l’eterocromatina, super-condensata e generalmente silente. La domanda che ci siamo posti è: questa diversa “densità” della cromatina influenza dove si verificano i danni al DNA quando un oncogene si scatena?
QUANDO: La Nostra Lente d’Ingrandimento sul Nucleo Cellulare
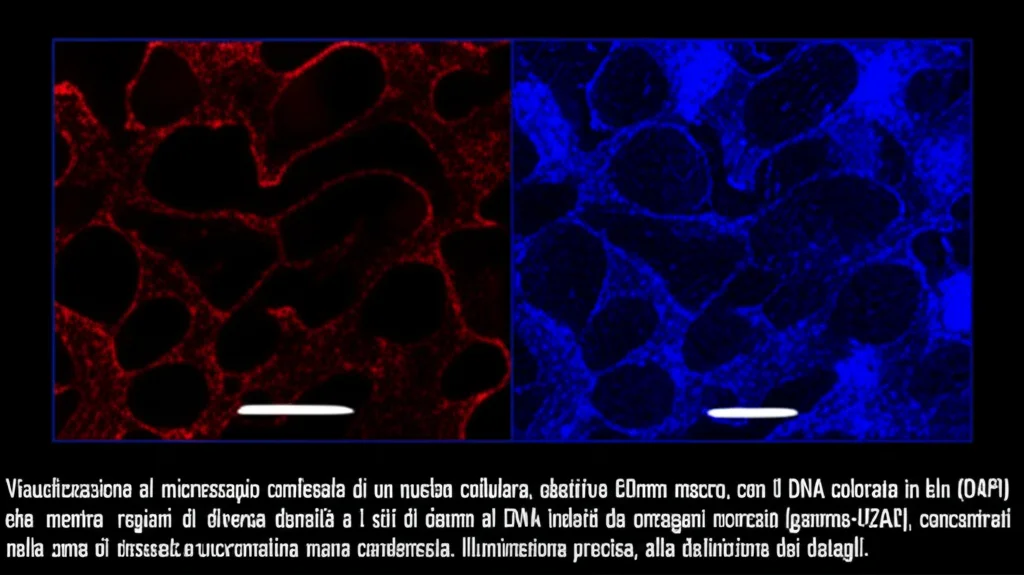
Per rispondere a questa domanda, abbiamo sviluppato un metodo che abbiamo battezzato QUANDO (QUantitative ANalysis of DNA cOunterstains). Sembra un nome da supereroe, e in un certo senso lo è per noi ricercatori! Si tratta di un’analisi quantitativa che ci permette di investigare la localizzazione subnucleare del danno al DNA, cellula per cellula. Abbiamo usato come modello delle cellule chiamate U937-PR9, che possono mimare la leucemia promielocitica acuta (LPA), un tipo di tumore del sangue.
Come funziona QUANDO? Utilizziamo tecniche di imaging avanzate, come la microscopia confocale a due colori. Un colore ci serve per marcare i “focolai” di danno al DNA, usando un indicatore chiamato γ-H2AX (che si illumina dove il DNA ha subito rotture a doppio filamento). L’altro colore, dato da un colorante come il DAPI, ci “disegna” il DNA stesso, permettendoci di distinguere le zone a bassa densità (eucromatina) da quelle ad alta densità (eterocromatina). Poi, con un po’ di magia matematica chiamata spettroscopia di cross-correlazione d’immagine (ICCS), mettiamo in relazione queste due mappe: quella del danno e quella della densità del DNA.
L’ICCS è fantastica perché non ci costringe a “ritagliare” prima le immagini in oggetti specifici, ma analizza le fluttuazioni di intensità spaziale dei segnali. In pratica, ci dice quanto spesso i segnali del danno al DNA (γ-H2AX) si sovrappongono a quelli delle regioni di DNA più o meno dense (DAPI).
Abbiamo anche calcolato, per ogni cellula, la densità media normalizzata del DNA nelle regioni danneggiate. Valori alti indicano che il danno è in zone dense (eterocromatina), valori bassi che è in zone “aperte” (eucromatina).
Mettiamo QUANDO alla Prova: L’Esperimento con le Cellule Leucemiche
Nel nostro studio, abbiamo usato le cellule U937-PR9 perché possiamo indurre l’espressione dell’oncogene PML-RARα, responsabile della LPA, semplicemente trattandole con solfato di zinco. Questo oncogene è una proteina di fusione che scombussola la normale segnalazione dell’acido retinoico e spinge le cellule a proliferare in modo anomalo.
Abbiamo confrontato tre situazioni:
- Cellule di controllo (CTRL), dove osserviamo il danno al DNA “spontaneo”, quello che avviene normalmente.
- Cellule trattate con solfato di zinco per 8 ore (Zn 8h), per attivare l’oncogene PML-RARα e vedere il danno da esso indotto.
- Cellule trattate con neocarzinostatina (NCS), un agente che mima gli effetti delle radiazioni e causa estese rotture del DNA, usato come controllo positivo per il danno massiccio.
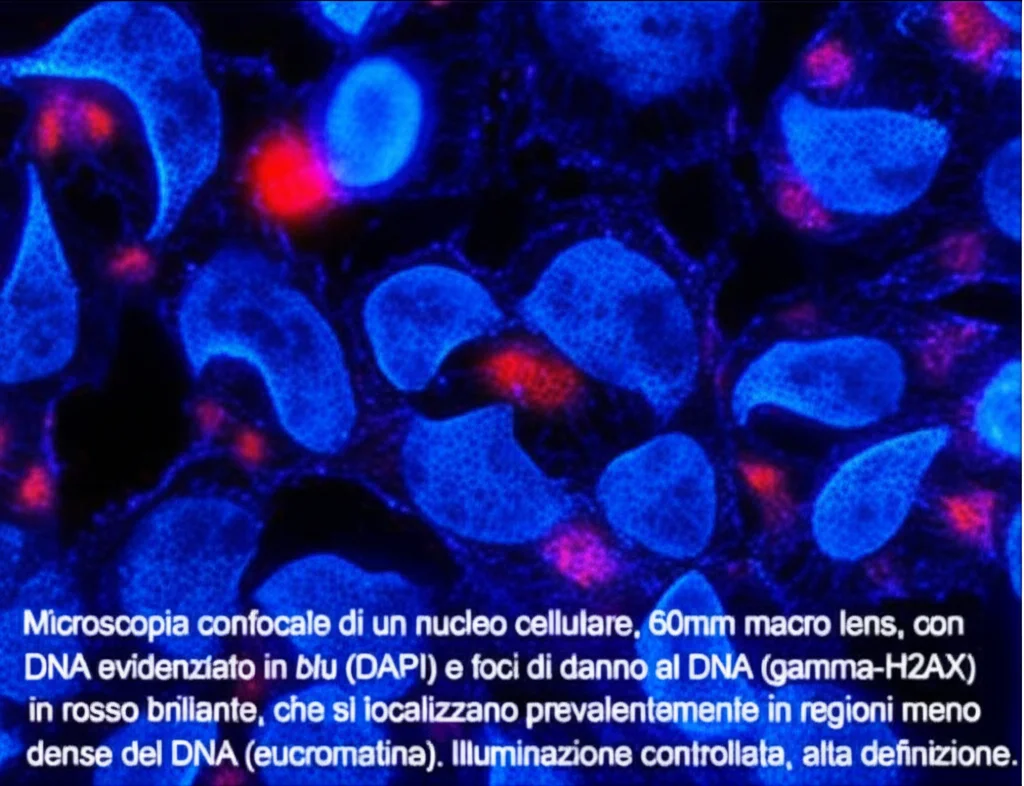
Prima di tutto, abbiamo validato il nostro metodo QUANDO usando marcatori noti: H3K9me3 per l’eterocromatina (che ci aspettavamo si trovasse in zone ad alta densità di DAPI) e Pol2 (RNA Polimerasi II) per l’eucromatina (che ci aspettavamo in zone a bassa densità di DAPI). E i risultati sono stati perfetti: H3K9me3 mostrava alta densità di DNA e alta colocalizzazione con l’eterocromatina, mentre Pol2 mostrava bassa densità e bassa colocalizzazione. QUANDO funzionava a meraviglia!
I Risultati Parlano Chiaro: Eucromatina nel Mirino (di Solito!)
E qui arriva il bello! Analizzando i focolai di γ-H2AX nelle nostre cellule sperimentali, abbiamo scoperto che:
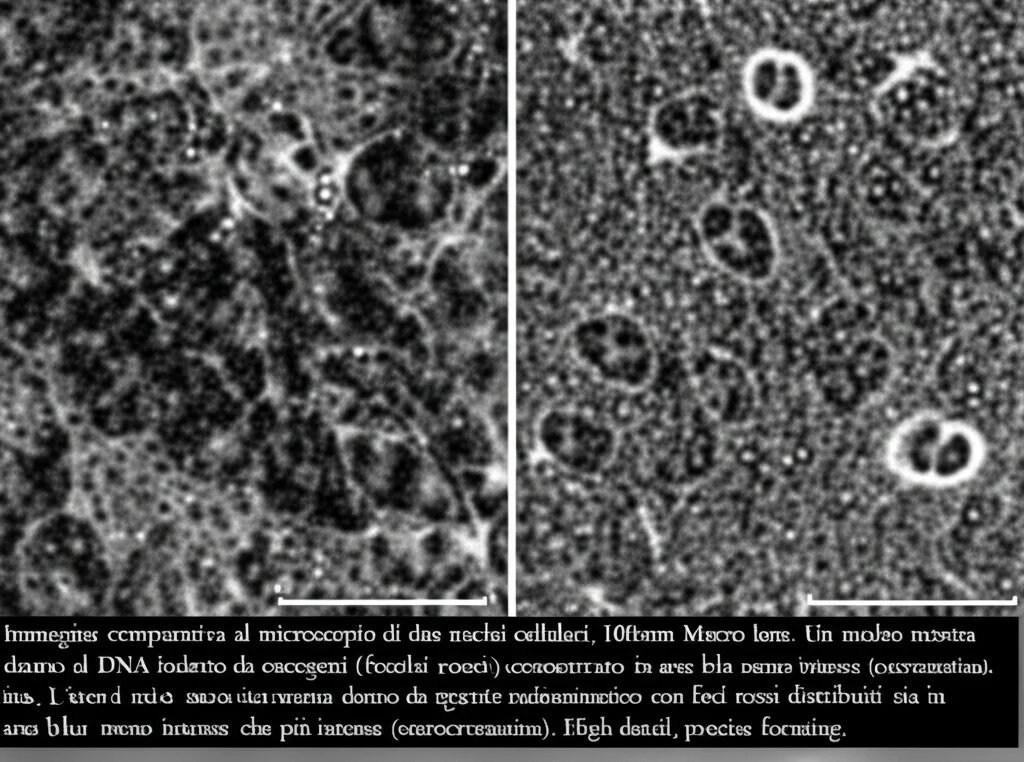
- Sia il danno al DNA spontaneo (nelle cellule di controllo) sia il danno indotto dall’attivazione dell’oncogene PML-RARα si localizzano prevalentemente nelle regioni eucromatiche, quelle meno dense e trascrizionalmente attive. Questo è stato confermato sia dall’analisi della densità del DNA (valori bassi) sia dalla colocalizzazione con l’eterocromatina (valori bassi o addirittura negativi, indicando una sorta di “repulsione”).
- Al contrario, quando il danno al DNA è indotto dall’agente radiomimetico NCS, i focolai di γ-H2AX appaiono distribuiti in modo più uniforme, trovandosi sia nelle regioni eucromatiche che in quelle eterocromatiche. In questo caso, la densità del DNA associata al danno era significativamente più alta, e anche la colocalizzazione con l’eterocromatina aumentava.
Quindi, sembra che gli oncogeni, almeno nel nostro modello, preferiscano danneggiare le parti più “accessibili” e attive del genoma. Questo potrebbe avere implicazioni importanti, perché l’eucromatina è dove i geni vengono letti e usati: un danno lì potrebbe avere conseguenze più dirette sulla funzionalità cellulare o sulla stabilità di geni cruciali.
Perché Tutto Questo è Importante? Implicazioni e Sguardi al Futuro
Queste scoperte, per quanto preliminari, sono entusiasmanti! Capire dove si localizza il danno al DNA indotto dagli oncogeni ci aiuta a comprendere meglio i meccanismi che portano all’instabilità genomica e alla progressione tumorale. La diversa localizzazione del danno potrebbe anche influenzare l’accessibilità ai meccanismi di riparazione del DNA. Se un danno avviene in una regione “aperta” o “chiusa” della cromatina, la cellula potrebbe rispondere in modo diverso per ripararlo.
Il nostro metodo QUANDO è uno strumento semplice ma potente, applicabile a qualsiasi immagine a due colori in cui un canale mostra la struttura di interesse (come i focolai di danno) e l’altro il DNA. In futuro, sarà interessantissimo applicare QUANDO a tecniche di imaging ancora più avanzate, come l’imaging su cellule vive (per vedere questi processi in tempo reale!) o la microscopia a super-risoluzione (per dettagli ancora più fini).
L’obiettivo finale? Contribuire a svelare i segreti dell’architettura della cromatina nell’instabilità genomica e, chissà, magari offrire nuovi spunti per bersagliare i meccanismi di riparazione del DNA nelle terapie contro il cancro. La strada è ancora lunga, ma ogni piccola scoperta è un passo avanti!
Spero che questo “tuffo” nel nucleo vi sia piaciuto. Continuate a seguirci per altre avventure scientifiche!
Fonte: Springer