Ferroptosi e Cancro Gastrico: lncRNA, i Nuovi Registi della Prognosi (e io ve li racconto!)
Amici scienziati e curiosi di scoperte mediche, mettetevi comodi! Oggi vi porto nel cuore pulsante della ricerca oncologica, un campo dove ogni giorno si combatte una battaglia silenziosa ma cruciale. Parleremo di cancro gastrico, un nemico subdolo, e di come nuove armi diagnostiche e prognostiche stiano emergendo da angoli inaspettati del nostro genoma. In particolare, vi svelerò come i cosiddetti RNA lunghi non codificanti (lncRNA), legati a un affascinante processo di morte cellulare chiamato ferroptosi, potrebbero rivoluzionare il modo in cui guardiamo a questa malattia.
Il Cancro Gastrico: Un Nemico Silenzioso e Aggressivo
Partiamo dalle basi, ma senza annoiarci. Il cancro gastrico (GC) è, purtroppo, uno dei tumori maligni più diffusi e con una prognosi spesso infausta. Pensate che a livello mondiale è il quinto per incidenza e la quarta causa di morte per cancro. Nonostante i progressi in chemioterapia, chirurgia, radioterapia, terapie mirate e immunoterapia, la sopravvivenza a 5 anni resta inferiore al 30%. Un dato che fa riflettere, vero? Attualmente, per capire come andrà un paziente, guardiamo a fattori come la dimensione del tumore, le metastasi ai linfonodi o a distanza, lo stadio e il tipo istologico. Ma c’è un “ma”: l’elevata eterogeneità tra i pazienti rende questi metodi non sempre perfetti. Ecco perché la caccia a marcatori molecolari più sensibili e specifici è più accesa che mai.
La Ferroptosi: Una Morte Cellulare Programmata… e Utile?
Qui entra in gioco la ferroptosi. Non storcete il naso al nome un po’ tecnico! Si tratta di un tipo di morte cellulare non apoptotica (cioè, diversa dal “suicidio cellulare” più noto) caratterizzata dall’accumulo di specie reattive dell’ossigeno (ROS) dipendenti dal ferro, ossidazione degli acidi grassi polinsaturi, accumulo di perossidi lipidici e danni da perossidazione fosfolipidica alle membrane cellulari. Un bel casino, insomma, ma potenzialmente un tallone d’Achille per le cellule tumorali! La ferroptosi è strettamente legata al metabolismo dei lipidi, degli amminoacidi, del ferro e del glutatione. Nel cancro gastrico, si è visto che è connessa alla tumorigenesi, al microambiente tumorale e alla resistenza ai farmaci. Potrebbe essere un nuovo marcatore oncologico e un bersaglio terapeutico? Noi pensiamo di sì!
Gli lncRNA: Registi Occulti nel Dramma del Cancro
E gli lncRNA? Immaginateli come dei lunghi filamenti di RNA (oltre 200 nucleotidi) che, a differenza dei loro cugini mRNA, non codificano per proteine, ma non per questo se ne stanno con le mani in mano. Anzi! Rappresentano l’80-90% di tutti gli RNA non codificanti e sono sempre più al centro dell’attenzione come biomarcatori per la diagnosi precoce e la prognosi di malattie, cancro incluso. Partecipano a una miriade di funzioni biologiche, come la tumorigenesi e le risposte immunitarie. E, cosa cruciale per il nostro discorso, studi recenti suggeriscono che gli lncRNA giochino un ruolo fondamentale nella regolazione della ferroptosi nel cancro. Possono agire, ad esempio, come “spugne” per altri RNA, prevenendo l’ossidazione e inibendo la ferroptosi. Insomma, dei veri e propri direttori d’orchestra molecolari!
Nonostante il loro potenziale, il valore degli lncRNA legati alla ferroptosi come indicatori prognostici e bersagli terapeutici nel cancro gastrico non è stato ancora esplorato a fondo. Ed è qui che entriamo in scena noi!
La Nostra Ricerca: Caccia agli lncRNA “Sentinella”
Il nostro obiettivo? Sviluppare un nuovo modello di rischio prognostico basato sugli lncRNA correlati alla ferroptosi e scovare nuovi marcatori diagnostici. Per farlo, ci siamo tuffati nei dati del The Cancer Genome Atlas (TCGA), una miniera d’oro di informazioni genomiche e cliniche. Abbiamo analizzato campioni tumorali di 375 pazienti e 32 campioni di controllo normali. Dopo una serie di filtraggi e analisi statistiche complesse (che vi risparmio, ma fidatevi, sono state rigorose!), siamo riusciti a identificare un gruppo di lncRNA potenzialmente legati alla ferroptosi e alla prognosi del cancro gastrico.
Abbiamo iniziato con 259 geni correlati alla ferroptosi identificati dal database FerrDb V1. Incrociando questi dati con l’espressione degli lncRNA nei campioni di cancro gastrico, abbiamo individuato ben 741 lncRNA correlati alla ferroptosi. Ma non ci siamo fermati qui!
Costruzione del Modello Prognostico: Otto lncRNA Sotto i Riflettori
Attraverso analisi di regressione di Cox univariata e analisi di Kaplan-Meier, abbiamo ristretto il campo a 16 lncRNA associati alla prognosi. Poi, con un’ulteriore regressione di Cox multivariata, abbiamo selezionato gli otto “magnifici” lncRNA per costruire il nostro modello prognostico. Questi sono: AL365181.3, MIR3142HG, PVT1, LINC01315, AL353804.1, HAGLR, AC005586.1 e AC245041.1. Sei di questi (AL365181.3, MIR3142HG, PVT1, LINC01315, AL353804.1, AC005586.1) sono risultati protettivi (alto livello = migliore sopravvivenza), mentre due (HAGLR, AC245041.1) sono risultati di rischio (alto livello = peggiore sopravvivenza).
Utilizzando i coefficienti di regressione e i livelli di espressione di questi otto lncRNA, abbiamo calcolato un “punteggio di rischio” per ogni paziente. Dividendo i pazienti in gruppi ad alto e basso rischio in base a questo punteggio, abbiamo osservato che quelli nel gruppo ad alto rischio avevano una sopravvivenza significativamente peggiore. Bingo! Le curve ROC (Receiver Operating Characteristic), uno strumento per valutare l’accuratezza predittiva, hanno dimostrato che il nostro modello era piuttosto bravo a prevedere la sopravvivenza a 1, 2 e 3 anni, con valori di AUC (Area Under the Curve) rispettivamente di 0.728, 0.755 e 0.759. Più alto è l’AUC (vicino a 1), migliore è il modello.
Validazione e Superiorità del Modello
Ma un bravo scienziato non si accontenta! Abbiamo verificato se questo raggruppamento per rischio potesse essere un fattore prognostico indipendente per la sopravvivenza globale (OS). Ebbene sì, l’analisi multivariata ha confermato che il nostro punteggio di rischio, insieme all’età, era un fattore prognostico indipendente. Anzi, il nostro modello di rischio si è dimostrato superiore alle tradizionali caratteristiche clinicopatologiche nel predire la prognosi del cancro gastrico! Per essere ancora più sicuri, abbiamo validato il tutto su una coorte di validazione interna (metà dei campioni iniziali scelti a caso), ottenendo risultati altrettanto incoraggianti. Questo ci dice che il nostro modello basato sugli lncRNA legati alla ferroptosi ha una buona capacità predittiva.
Il Nomogramma: Uno Strumento Clinico Pratico
Per rendere il tutto ancora più utile clinicamente, abbiamo sviluppato un nomogramma. Cos’è? Immaginatelo come un grafico che combina diversi fattori (età, sesso, grado del tumore, stadio clinico e il nostro punteggio di rischio) per calcolare un punteggio complessivo e predire la probabilità di sopravvivenza a 1 e 3 anni. Più alto il punteggio totale, peggiore la prognosi. Le curve di calibrazione hanno mostrato che il nostro nomogramma era ben allineato con la realtà, e l’analisi DCA (Decision Curve Analysis) ha confermato la sua superiorità clinica rispetto ai parametri tradizionali. Un passo avanti per personalizzare le previsioni!
Cosa Ci Dicono le Analisi Funzionali (GSEA e GO)?
Ok, il modello predice, ma quali sono i meccanismi biologici sottostanti? Per capirlo, abbiamo usato l’analisi GSEA (Gene Set Enrichment Analysis). Abbiamo scoperto che nel gruppo ad alto rischio erano attivi pathway legati all’adesione cellulare, all’interazione citochina-recettore, alla via di segnalazione TGF-β e alla via Hippo. Nel gruppo a basso rischio, invece, erano arricchiti pathway come la fosforilazione ossidativa, la via di segnalazione di p53 e il metabolismo dell’acido arachidonico. Molti di questi sono cruciali per la progressione tumorale, la ferroptosi e la risposta immunitaria. L’analisi GO (Gene Ontology) sui geni differenzialmente espressi tra i due gruppi ha indicato un coinvolgimento nella proliferazione delle cellule epiteliali e nel metabolismo dei lipidi. Tutto torna!
Focus su HAGLR: Un lncRNA Chiave
Tra gli otto lncRNA del nostro modello, uno in particolare ha attirato la nostra attenzione: HAGLR. Era uno dei due lncRNA “a rischio” e risultava significativamente sovraespresso nei tessuti tumorali gastrici rispetto ai tessuti normali adiacenti, sia nelle nostre analisi qRT-PCR su 27 coppie di campioni freschi, sia nei dati TCGA. Un’alta espressione di HAGLR era associata a stadi tumorali (T e N) più avanzati e a metastasi a distanza. Abbiamo anche visto che HAGLR era molto espresso in diverse linee cellulari di cancro gastrico rispetto a cellule epiteliali gastriche normali.
A questo punto, la domanda era d’obbligo: cosa fa HAGLR? Per scoprirlo, abbiamo “silenziato” HAGLR in due linee cellulari di cancro gastrico (AGS e HGC-27) usando la tecnica degli shRNA. I risultati sono stati netti:
- La proliferazione cellulare è diminuita significativamente (test CCK-8 e formazione di colonie).
- La capacità di migrazione cellulare si è ridotta (test scratch wound-healing e transwell).
Quindi, silenziare HAGLR sembra inibire la crescita e la diffusione delle cellule tumorali gastriche. Interessante, vero?
HAGLR e Ferroptosi: Un Legame Inaspettato
Ma non è finita qui! Abbiamo voluto vedere se HAGLR avesse un ruolo nell’apoptosi e, soprattutto, nella ferroptosi.
- L’apoptosi (la morte cellulare programmata “classica”) aumentava significativamente dopo il silenziamento di HAGLR.
- Per la ferroptosi, abbiamo indotto questo processo con erastina (un noto induttore) e poi abbiamo controllato vari marcatori. Ebbene, nelle cellule con HAGLR silenziato e trattate con erastina, abbiamo osservato un ulteriore aumento di:
- Specie reattive dell’ossigeno (ROS) intracellulari.
- Malondialdeide (MDA), un prodotto della perossidazione lipidica.
- Ioni ferro bivalente (Fe2+).
E una diminuzione del glutatione (GSH), un antiossidante.
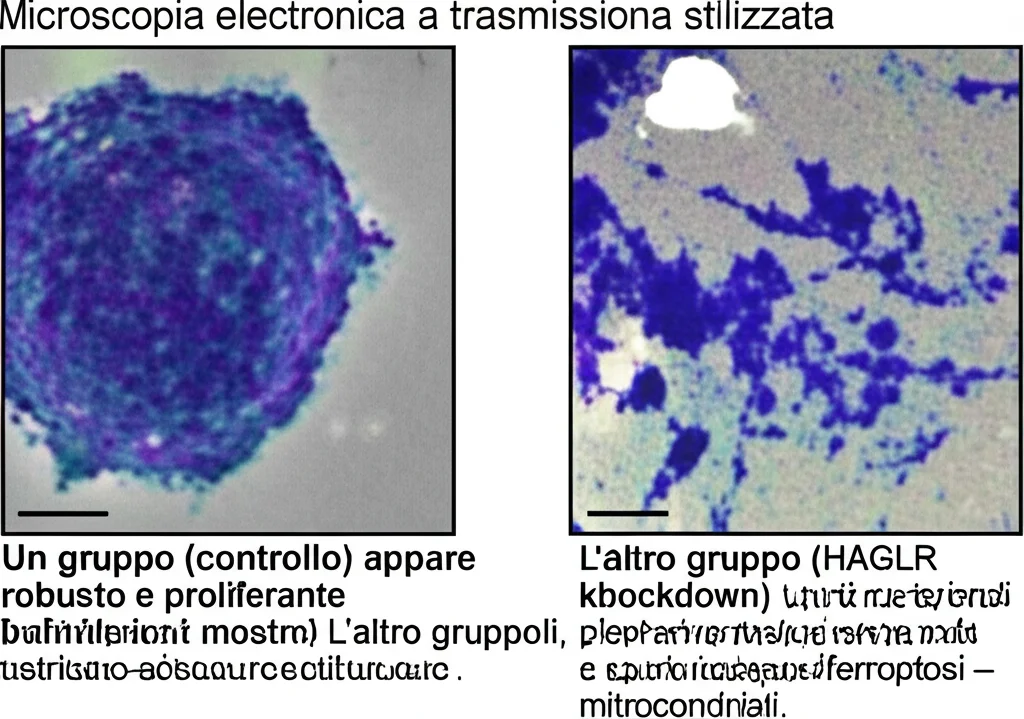
La microscopia elettronica a trasmissione ha rivelato che il silenziamento di HAGLR induceva cambiamenti morfologici tipici della ferroptosi nei mitocondri (più piccoli, creste ridotte, membrana esterna rotta). Inoltre, abbiamo visto che il silenziamento di HAGLR portava a un aumento di ACSL4 (una proteina pro-ferroptosi) e a una diminuzione di GPX4 (una proteina anti-ferroptosi). Tutti questi dati suggeriscono che HAGLR potrebbe avere un effetto inibitorio sulla ferroptosi nelle cellule di cancro gastrico, e quindi la sua eliminazione la favorirebbe.
Ferroptosi, Immunità e Cancro: Un Triangolo Complesso
Le nostre analisi GSEA avevano già suggerito un legame con la risposta immunitaria. Utilizzando l’analisi ssGSEA (single-sample GSEA), abbiamo quantificato i livelli di infiltrazione di cellule immunitarie e l’attività di pathway immunologici. Abbiamo scoperto che nel gruppo ad alto rischio (quello con prognosi peggiore e, presumibilmente, meno ferroptosi grazie ad HAGLR) c’era un aumento significativo di cellule immunitarie come cellule B, cellule dendritiche, macrofagi, mastociti, neutrofili, cellule NK e cellule T regolatorie (Treg). Anche pathway come la co-stimolazione delle APC e la risposta all’IFN di tipo II erano più attivi. Questo è un campo complesso: ad esempio, i macrofagi M2 (immunosoppressivi) sono più resistenti alla ferroptosi. Un arricchimento di macrofagi nel gruppo ad alto rischio potrebbe indicare una maggiore presenza di M2, contribuendo alla prognosi infausta. È un puzzle affascinante che merita ulteriori indagini.

Limiti e Prospettive Future
Come ogni studio, anche il nostro ha dei limiti. Il modello prognostico è stato costruito e validato usando dati dal TCGA, quindi sarebbe importante verificarlo su coorti esterne per confermarne l’applicabilità generale. Inoltre, alcuni degli lncRNA identificati sono poco studiati e meritano approfondimenti. Abbiamo iniziato a svelare il ruolo di HAGLR, ma c’è ancora tanto da scoprire sui meccanismi molecolari precisi con cui questi otto lncRNA influenzano la ferroptosi e la progressione del cancro gastrico.
In conclusione, abbiamo costruito e identificato un nuovo modello di rischio prognostico basato su otto lncRNA correlati alla ferroptosi (AL365181.3, MIR3142HG, PVT1, LINC01315, AL353804.1, HAGLR, AC005586.1 e AC245041.1) nel cancro gastrico. Il nostro studio ha anche dimostrato che HAGLR gioca un ruolo importante nella progressione del GC e nella regolazione della ferroptosi, suggerendo che potrebbe diventare un promettente bersaglio terapeutico. La strada è ancora lunga, ma ogni passo ci avvicina a comprendere meglio e a combattere più efficacemente questo tumore. E io, da parte mia, non vedo l’ora di raccontarvi i prossimi sviluppi!
Fonte: Springer