LINC01123: Ho Scoperto Come Questo Gene ‘Cattivo’ Peggiora i Danni dell’Ictus!
Ciao a tutti! Oggi voglio parlarvi di una scoperta che mi ha davvero appassionato nel campo delle neuroscienze, qualcosa che potrebbe aprire nuove strade per combattere i danni causati dall’ictus. Parliamo di ischemia cerebrale e del danno da riperfusione, un nemico subdolo che colpisce il cervello quando il flusso sanguigno viene ripristinato dopo un’interruzione. E al centro di tutto c’è un protagonista inaspettato: un lungo RNA non codificante chiamato LINC01123.
L’Ictus e il Paradosso della Riperfusione (CIRI)
Immaginate questa situazione: un vaso sanguigno nel cervello si blocca (ischemia). Le cellule cerebrali, private di ossigeno e nutrienti, iniziano a soffrire. La terapia più efficace, come la trombolisi o la trombectomia, mira a riaprire quel vaso il più velocemente possibile. Sembra la soluzione perfetta, no? Eppure, proprio quando il sangue torna a fluire (riperfusione), può scatenarsi un secondo round di danni, noto come danno da ischemia/riperfusione cerebrale (CIRI). È un paradosso crudele: la cura stessa può peggiorare le cose!
Questo CIRI è un processo complesso che coinvolge:
- Stress ossidativo (un’esplosione di molecole dannose chiamate radicali liberi, ROS)
- Infiammazione
- Apoptosi (morte cellulare programmata)
- Danni alla barriera emato-encefalica
Capire cosa scatena e alimenta il CIRI è fondamentale per trovare terapie più efficaci. Ed è qui che entra in gioco la nostra molecola.
LINC01123: Un Nuovo Attore sulla Scena dell’Ictus
Nel vasto mondo del nostro genoma, ci sono lunghi tratti di RNA che non codificano per proteine, i cosiddetti lncRNA (Long non-coding RNA). Per anni sono stati considerati “rumore di fondo”, ma stiamo scoprendo che svolgono ruoli cruciali nella regolazione dei geni. LINC01123 è uno di questi. Era già noto per il suo coinvolgimento in alcuni tipi di cancro, ma uno studio precedente aveva suggerito un suo aumento nel sangue di pazienti con infarto cerebrale acuto. Questo mi ha incuriosito: che ruolo poteva avere LINC01123 proprio nel cuore del danno da CIRI?
Cosa Abbiamo Scoperto: LINC01123 è un “Aggravante”
Per investigare, abbiamo usato due modelli sperimentali:
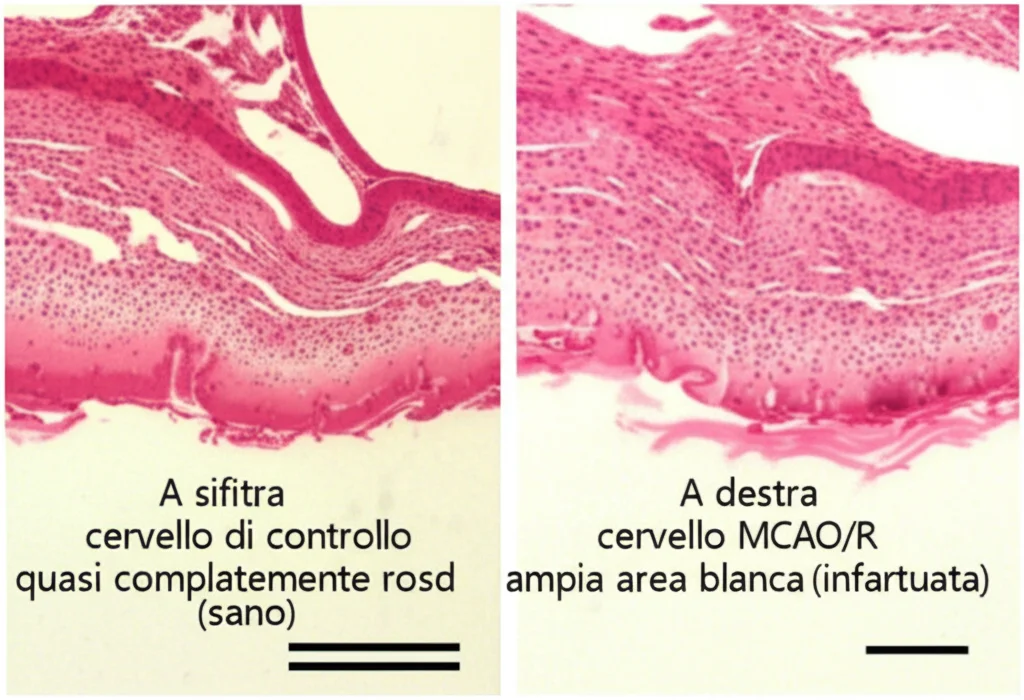
- Modello in vivo: Ratti sottoposti a occlusione dell’arteria cerebrale media seguita da riperfusione (MCAO/R), un modello standard per simulare l’ictus e il CIRI nell’uomo.
- Modello in vitro: Cellule neuronali umane (linea SH-SY5Y) sottoposte a deprivazione di ossigeno e glucosio seguita da reossigenazione (OGD/R), per mimare l’ischemia/riperfusione a livello cellulare.
I risultati sono stati chiari e consistenti: in entrambi i modelli, i livelli di LINC01123 aumentavano significativamente durante il CIRI. Era come se il cervello, sotto stress, producesse di più questa molecola.
Ma la vera domanda era: questo aumento è una conseguenza innocua o LINC01123 contribuisce attivamente al danno? Per rispondere, abbiamo fatto l’esperimento chiave: abbiamo “silenziato” LINC01123 nei ratti prima di indurre l’ictus e nelle cellule prima dell’OGD/R.
I risultati sono stati sorprendenti e incoraggianti! Silenziare LINC01123 ha portato a:
- Riduzione del danno cerebrale nei ratti (minor volume dell’infarto, minor edema cerebrale, migliori punteggi neurologici).
- Minore morte cellulare (apoptosi) sia nei ratti che nelle cellule. Abbiamo visto meno cellule positive al test TUNEL (un marcatore di apoptosi) e un riequilibrio delle proteine pro e anti-apoptotiche (meno Bax e caspasi-3 attivata, più Bcl-2).
- Diminuzione dello stress ossidativo: meno ROS, meno malondialdeide (MDA, un prodotto della perossidazione lipidica) e livelli più alti di superossido dismutasi (SOD, un antiossidante endogeno).
- Riduzione dei livelli di HIF-1α, un fattore chiave nella risposta cellulare all’ipossia.
In pratica, togliere di mezzo LINC01123 proteggeva il cervello e le cellule neuronali dagli effetti devastanti del CIRI! Questo ci ha detto che LINC01123 non è solo un marcatore, ma un agente attivo che peggiora il danno.
Il Meccanismo: Come LINC01123 Fa Danni? L’Asse miR-654-5p/METTL7A
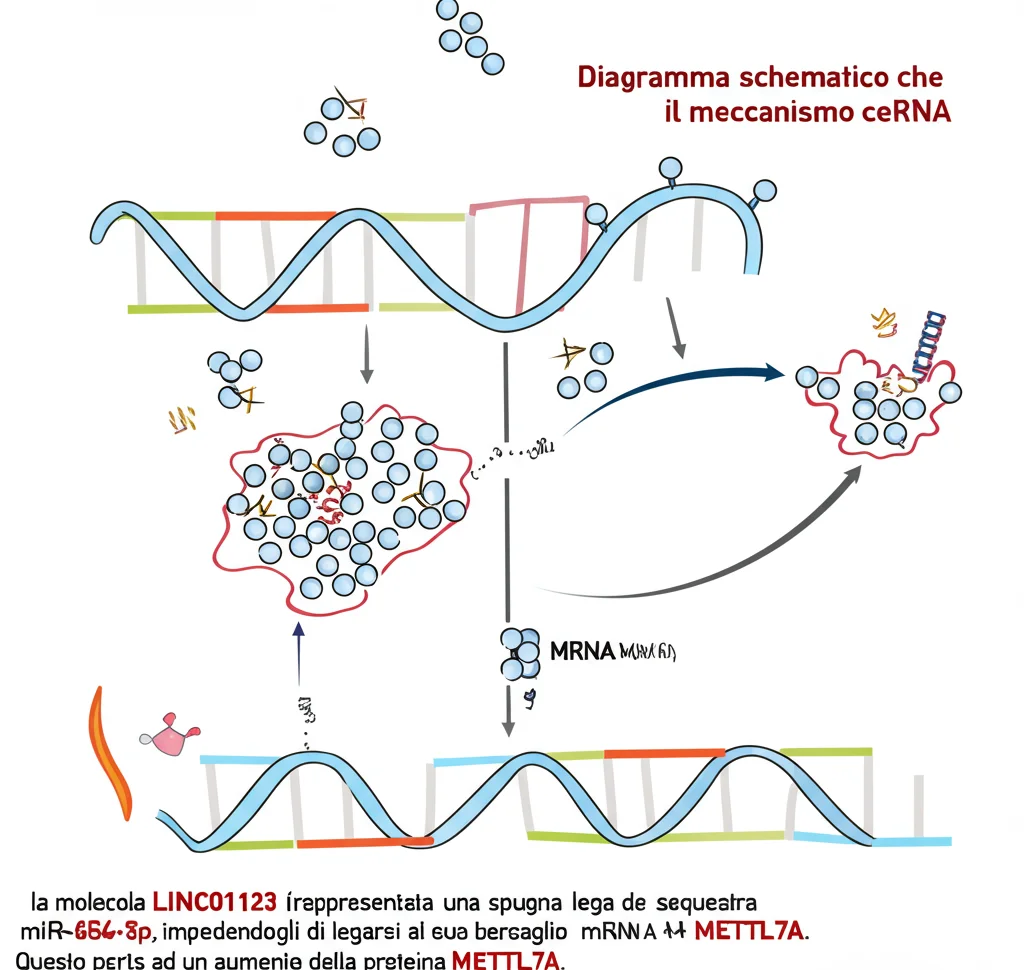
Ok, LINC01123 è “cattivo”, ma come agisce? Molti lncRNA funzionano come “spugne” molecolari (ceRNA – competitive endogenous RNA). Immaginate che le cellule abbiano dei piccoli controllori chiamati microRNA (miRNA) che normalmente silenziano altri geni. Gli lncRNA possono legarsi a questi miRNA, impedendo loro di fare il loro lavoro.
Ci siamo chiesti se LINC01123 funzionasse così. Attraverso analisi bioinformatiche e test di laboratorio (FISH, RNA pull-down, Luciferase assay, RIP), abbiamo scoperto che LINC01123 si trova principalmente nel citoplasma delle cellule (dove può interagire con i miRNA) e lega specificamente un miRNA chiamato miR-654-5p.
E cosa fa miR-654-5p? Studi precedenti suggerivano che fosse poco espresso nell’ictus ischemico. Noi abbiamo confermato che i suoi livelli erano bassi nelle nostre cellule OGD/R. Inoltre, silenziando LINC01123, i livelli di miR-654-5p aumentavano! Questo confermava l’ipotesi della spugna: LINC01123 “sequestra” miR-654-5p, riducendone la disponibilità.
Il passo successivo era capire quale gene fosse controllato da miR-654-5p. Usando database e ulteriori esperimenti, abbiamo identificato il bersaglio: una proteina chiamata METTL7A (Methyltransferase Like 7A). Abbiamo verificato che:
- miR-654-5p si lega direttamente all’mRNA di METTL7A e ne reprime l’espressione.
- I livelli di METTL7A erano alti nelle cellule OGD/R (coerentemente con i bassi livelli di miR-654-5p).
- Silenziando LINC01123 o aumentando artificialmente miR-654-5p, i livelli di METTL7A diminuivano.
- Bloccando miR-654-5p (con un inibitore) si annullava l’effetto benefico del silenziamento di LINC01123, riportando alti i livelli di METTL7A e peggiorando di nuovo apoptosi e stress ossidativo.
- Al contrario, aumentando artificialmente METTL7A si annullavano gli effetti protettivi del silenziamento di LINC01123.
Il quadro era completo: LINC01123 aumenta nel CIRI → sequestra miR-654-5p → miR-654-5p non può più reprimere METTL7A → METTL7A aumenta → METTL7A promuove apoptosi e stress ossidativo → il danno da CIRI peggiora.
Cosa Significa Tutto Questo per il Futuro?
Questa scoperta è entusiasmante perché identifica un nuovo meccanismo molecolare alla base del danno da riperfusione nell’ictus. L’asse LINC01123/miR-654-5p/METTL7A rappresenta un potenziale bersaglio terapeutico. Immaginate di poter sviluppare un farmaco che blocchi specificamente LINC01123 o che ripristini i livelli di miR-654-5p nel cervello subito dopo un ictus. Potrebbe essere un modo per limitare il danno secondario della riperfusione e migliorare l’esito per i pazienti.
Certo, la strada è ancora lunga. Questo studio ha delle limitazioni: abbiamo usato una linea cellulare e non neuroni primari, e non abbiamo verificato l’asse miR-654-5p/METTL7A direttamente nel modello animale. Serviranno ulteriori ricerche, anche su campioni clinici, per confermare questi risultati e capire se LINC01123 possa diventare un vero bersaglio terapeutico o un biomarcatore per il CIRI.
Ma ogni grande viaggio inizia con un primo passo, e credo che aver svelato il ruolo di LINC01123 sia un passo importante nella giusta direzione per combattere una delle complicazioni più insidiose dell’ictus. È la bellezza della ricerca: pezzo dopo pezzo, illuminiamo i meccanismi complessi della vita e della malattia, sperando di trovare nuove soluzioni.
Fonte: Springer