Lattato nelle Vacche da Latte: Amico o Nemico? Scopriamo il Suo Lato Oscuro sulla Ghiandola Mammaria
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi ha davvero affascinato e che riguarda le nostre amiche mucche da latte. Parliamo di lattato. Sì, proprio quella molecola che associamo spesso alla fatica muscolare dopo un allenamento intenso. Ma sapete una cosa? Nel mondo delle vacche da latte, il lattato gioca un ruolo molto più complesso e, a volte, un po’ insidioso, soprattutto a livello della ghiandola mammaria.
Per anni abbiamo considerato il lattato quasi come un prodotto di scarto del metabolismo del glucosio, specialmente quando l’ossigeno scarseggia. Ma la ricerca recente, inclusa quella su cui si basa questo articolo, ci sta mostrando una faccia completamente nuova del lattato: non solo un “rifiuto”, ma un vero e proprio messaggero cellulare, capace di influenzare un sacco di processi, persino la produzione di latte e la salute della mammella.
Il Lattato e la Produzione di Latte: Un Legame Inaspettato
Immaginate la scena: stalle piene di magnifiche vacche Holstein. Abbiamo osservato un gruppo di queste signore, dividendole in base alla concentrazione di lattato nel loro latte. E qui arriva la prima sorpresa: le vacche con livelli più alti di lattato nel latte tendevano ad avere una produzione di latte inferiore, sia in termini di quantità totale che di contenuto di lattosio e grassi. Non solo, ma presentavano anche una conta di cellule somatiche (SCC) più alta – un indicatore che qualcosa, a livello di salute della mammella, non va proprio liscio, spesso legato a infiammazioni o infezioni.
Ma non è finita qui. Abbiamo misurato anche alcuni indicatori di stress ossidativo nel latte. Lo stress ossidativo, in parole povere, è uno squilibrio tra la produzione di molecole dannose (i radicali liberi, o ROS) e la capacità del corpo di neutralizzarle con gli antiossidanti. Ebbene, nelle vacche con più lattato, abbiamo trovato livelli più alti di malondialdeide (MDA) e ossido nitrico sintasi totale (T-NOS) – entrambi segnali di “maretta” ossidativa. Al contrario, i livelli di importanti antiossidanti come la glutatione perossidasi (GSH-Px), la superossido dismutasi (SOD) e la capacità antiossidante totale (T-AOC) erano più bassi. Insomma, un quadro che suggerisce un ambiente più “stressato” nella ghiandola mammaria di queste vacche.
Dentro le Cellule Mammarie: Cosa Succede Davvero?
Per capire meglio cosa combinasse il lattato a livello cellulare, ci siamo spostati in laboratorio, usando delle cellule epiteliali mammarie bovine chiamate MAC-T. Abbiamo trattato queste cellule con diverse concentrazioni di lattato di sodio e abbiamo guardato cosa succedeva. I risultati? Praticamente uno specchio di quanto visto nelle vacche!
Aumentando il lattato, aumentavano anche i livelli di ROS e MDA all’interno delle cellule. E, di nuovo, diminuivano gli antiossidanti come GSH-Px, T-AOC e SOD. Questo ci ha confermato che il lattato, di per sé, sembra proprio innescare una risposta di stress ossidativo in queste cellule.
Il Ruolo Chiave di HIF1α: Un Regista Inatteso
Ma come fa il lattato a causare tutto questo scompiglio? Qui entra in gioco un personaggio chiave: una proteina chiamata HIF1α (Hypoxia Inducible Factor 1 subunit alpha). Normalmente, HIF1α si attiva quando c’è poco ossigeno (ipossia) e aiuta le cellule ad adattarsi. In condizioni normali di ossigeno, viene rapidamente degradata.
Il colpo di scena è che il lattato riesce a stabilizzare HIF1α anche quando l’ossigeno c’è! Lo fa inibendo gli enzimi (le prolil-idrossilasi, PHD) che normalmente “marcano” HIF1α per la distruzione. Quindi, più lattato c’è, più HIF1α si accumula nella cellula, anche in condizioni normali.
E perché questo è importante? Perché HIF1α è un fattore di trascrizione: una volta stabile, entra nel nucleo della cellula e accende o spegne specifici geni. Abbiamo visto che nelle cellule trattate con lattato, l’espressione di HIF1α aumentava, così come quella di geni legati allo stress ossidativo (come HMOX1 e FOXO3). L’analisi del trascrittoma (l’insieme di tutti i geni attivi in una cellula) ha confermato che le vie metaboliche più influenzate dal lattato erano proprio quelle legate alla risposta allo stress ossidativo e, guarda caso, alla segnalazione di HIF1.
L’Orologio Biologico Va Fuori Sincrono
Ma la storia si complica ulteriormente. Sapete che le nostre cellule, incluse quelle della ghiandola mammaria, hanno un loro orologio biologico interno, un ritmo circadiano che regola tantissime funzioni nell’arco delle 24 ore, inclusa la sintesi del latte? Questo orologio è governato da un complesso meccanismo di geni e proteine “orologio”, come CLOCK e BMAL1.
E qui arriva l’altra scoperta sorprendente: il lattato, attraverso la stabilizzazione di HIF1α, riesce a scombinare questo orologio circadiano!
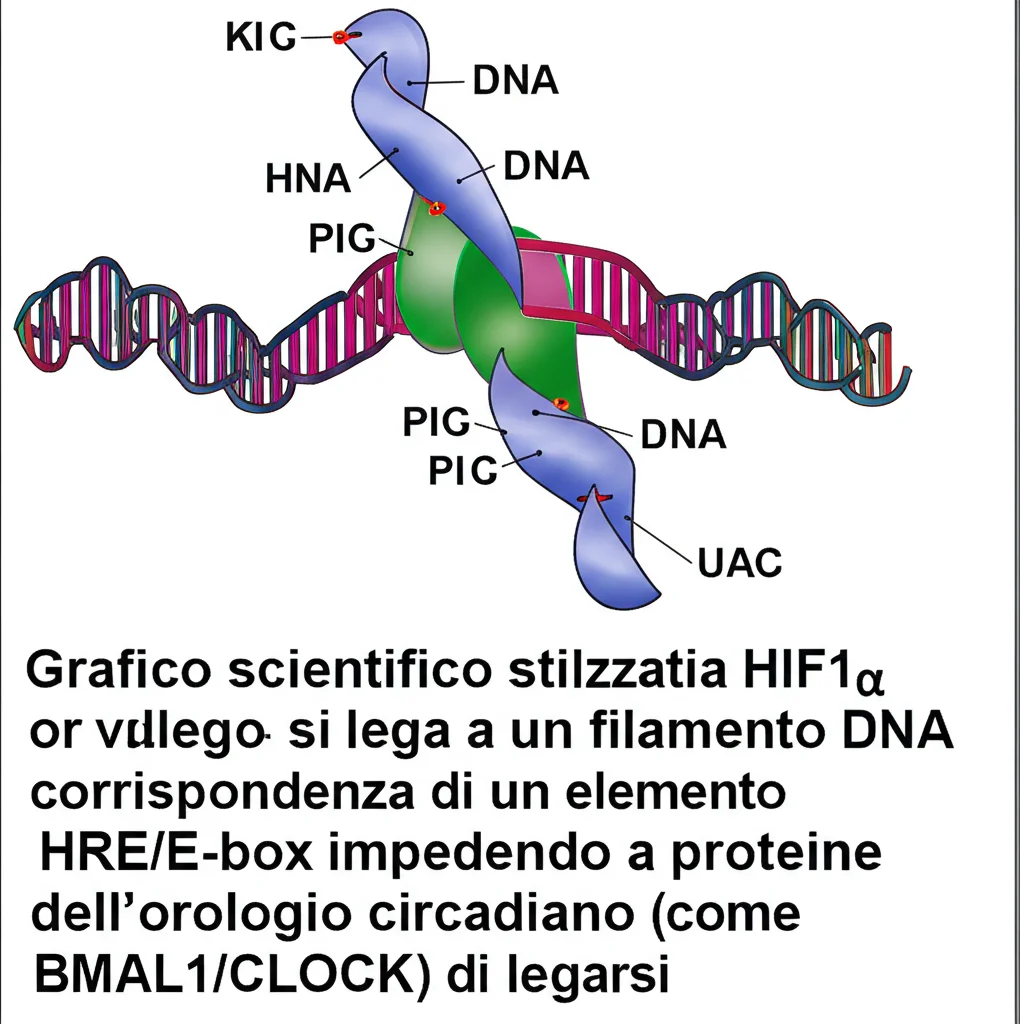
Come? Sembra che HIF1α e i fattori chiave dell’orologio circadiano (come BMAL1/CLOCK) si leghino a sequenze di DNA molto simili, chiamate HRE (Hypoxia Response Elements) per HIF1α e E-box per l’orologio. Queste sequenze si trovano nei promotori di molti geni, inclusi quelli coinvolti nello stress ossidativo (come HMOX1, FOXO3) e alcuni geni dell’orologio stesso (come BMAL1).
Quando il lattato stabilizza HIF1α, quest’ultimo diventa più “aggressivo” nel legarsi a queste sequenze HRE/E-box. In pratica, è come se HIF1α e BMAL1/CLOCK si contendessero gli stessi “parcheggi” sul DNA. Con più HIF1α in giro grazie al lattato, questo “vince” più spesso la competizione, occupando siti che normalmente sarebbero gestiti dall’orologio circadiano.

Il risultato è un’alterazione del normale ritmo di espressione di molti geni. Abbiamo visto che trattando le cellule con lattato, molti geni perdevano il loro normale ritmo circadiano, altri lo acquisivano in modo anomalo, e altri ancora cambiavano la loro “fase” (il momento di picco di attività nelle 24 ore). In particolare, geni legati al metabolismo del glutatione (un antiossidante chiave) e alla glicolisi acquisivano ritmicità alterate.
Curiosamente, mentre l’espressione dei geni dell’orologio come BMAL1, CREB1 e SERPINE1 aumentava a livello di mRNA (il messaggero) con il trattamento al lattato (probabilmente a causa di questa competizione sui promotori), i livelli delle proteine BMAL1 e CLOCK non sembravano aumentare allo stesso modo. Era proprio HIF1α a farla da padrone, accumulandosi grazie al lattato.
La Prova del Nove: Silenziare HIF1α
Per essere sicuri che fosse proprio HIF1α il colpevole principale di questo doppio misfatto (stress ossidativo + disturbo circadiano), abbiamo fatto un esperimento “spegnendolo”. Usando una tecnica chiamata RNA interference (siRNA), abbiamo ridotto la quantità di HIF1α nelle cellule MAC-T, anche in presenza di lattato.
I risultati sono stati chiari: riducendo HIF1α, si riduceva anche lo stato di stress ossidativo nelle cellule e si ripristinava, almeno in parte, la normale espressione dei geni legati all’orologio circadiano. Questo ha confermato il ruolo centrale di HIF1α stabilizzato dal lattato in questo processo. Abbiamo anche verificato con una tecnica chiamata ChIP-qPCR che, in presenza di lattato, HIF1α si lega effettivamente ai promotori di geni come BMAL1, HMOX1 e FOXO3.
Cosa Ci Portiamo a Casa?
Questa ricerca ci apre una finestra affascinante su come un metabolita apparentemente semplice come il lattato possa avere effetti così profondi sulla fisiologia della ghiandola mammaria. Abbiamo scoperto un meccanismo inedito: il lattato induce stress ossidativo non solo direttamente, ma anche scombinando l’orologio biologico cellulare attraverso la stabilizzazione di HIF1α e la conseguente competizione per i siti di legame sul DNA.
Questo meccanismo di “occupazione competitiva degli elementi trascrizionali” potrebbe essere un modo nuovo per regolare lo stato ossidativo nelle cellule mammarie e, forse, anche in altri tessuti. Capire questi processi è fondamentale perché ci offre potenziali nuove strategie nutrizionali o di gestione per migliorare la salute della mammella nelle vacche da latte, ridurre disturbi metabolici e, magari, ottimizzare anche la produzione di latte, rispettando i ritmi biologici dell’animale.
Insomma, il lattato non è solo un prodotto di scarto, ma un attore complesso sulla scena biologica. Studiarlo ci aiuta a capire meglio come funzionano le nostre preziose vacche da latte e come possiamo aiutarle a stare meglio e a produrre in modo più sano e sostenibile. Una sfida complessa, ma incredibilmente stimolante!
Fonte: Springer