Cancro Orale: Smascherato il Duo Maligno KLF7/ITGA2, Nuova Speranza Terapeutica Contro le Cellule Staminali
Ciao a tutti! Oggi voglio parlarvi di una scoperta che potrebbe davvero cambiare le carte in tavola nella lotta contro una forma di cancro piuttosto ostica: il carcinoma orale a cellule squamose (OSCC). Sapete, quel tipo di tumore che colpisce la bocca, la lingua, le gengive… Purtroppo, nonostante i progressi, la sopravvivenza a 5 anni resta ferma al 50%, soprattutto perché spesso viene diagnosticato tardi e tende a ripresentarsi o a dare metastasi. E uno dei motivi principali di questa tenacia è la presenza delle cosiddette cellule staminali tumorali (CST).
Chi sono queste Cellule Staminali Tumorali (CST)?
Immaginatele come le “regine” del tumore. Sono una piccola popolazione di cellule che hanno la capacità incredibile di auto-rinnovarsi (cioè creare copie di sé stesse) e di dare origine a tutte le altre cellule diverse che compongono il tumore. Ma la cosa peggiore è che sono delle vere maestre della resistenza: resistono alla chemio, alla radio e persino all’immunoterapia. Ecco perché eliminarle è diventato il Sacro Graal della ricerca oncologica. Se riusciamo a colpire le CST, potremmo finalmente sconfiggere la resistenza ai farmaci e ridurre le recidive. Fantastico, no? Ma come fare?
La Caccia al Regolatore Chiave: Ecco KLF7!
Per trovare un modo per attaccare queste CST nel cancro orale (le chiameremo OCSC), abbiamo deciso di andare a fondo, analizzando i dati di singole cellule tumorali provenienti da pazienti. È come fare un’indagine super dettagliata, cellula per cellula. E indovinate un po’? Abbiamo identificato un “sospettato principale”, una molecola chiamata KLF7.
Perché proprio KLF7? Beh, abbiamo notato diverse cose intriganti:
- Era particolarmente abbondante in un sottogruppo di cellule tumorali che mostravano caratteristiche tipiche delle staminali (alta “potenzialità di sviluppo”, attivazione di vie legate alla staminalità).
- La sua espressione era più alta nei tumori OSCC rispetto ai tessuti normali.
- I pazienti con alti livelli di KLF7 avevano una prognosi peggiore (brutto segno, ma indicativo della sua importanza!).
- Studi precedenti suggerivano un suo ruolo nel mantenimento delle nicchie delle cellule staminali in altri contesti.
- Nelle biopsie, KLF7 si trovava spesso nelle stesse zone di marcatori noti delle cellule staminali tumorali come CD44 e CD133.
Insomma, tutti gli indizi puntavano su KLF7 come un possibile “direttore d’orchestra” della staminalità nelle OCSC.
KLF7: Il Test del Nove
Ovviamente, non ci siamo fermati agli indizi. Abbiamo voluto prove concrete! Abbiamo preso delle linee cellulari di OSCC e abbiamo “spento” il gene KLF7 (tecnicamente si chiama knockdown). I risultati sono stati chiari:
- L’espressione di geni chiave per la staminalità (come NANOG) diminuiva.
- La capacità delle cellule di formare “tumorsfere” (piccoli aggregati tumorali che mimano la capacità di auto-rinnovamento delle CST) si riduceva drasticamente, sia in numero che in dimensione.
- La percentuale di cellule positive per marcatori staminali (come CD133) o con alta attività di un enzima legato alla staminalità (ALDH) calava.
- Anche la capacità di dare origine a nuovi tumori in esperimenti *in vivo* (topi) diminuiva significativamente.
Al contrario, quando abbiamo “acceso” KLF7 (sovraespressione), abbiamo osservato l’effetto opposto: più staminalità, più tumorsfere, più marcatori positivi. Interessante notare che KLF7 sembrava influenzare anche la capacità delle cellule di muoversi e invadere (processo noto come transizione epitelio-mesenchimale o EMT, spesso legato alla staminalità). Quindi, KLF7 è davvero un pezzo grosso nel regolare le proprietà staminali dell’OSCC.

Il Problema: KLF7 è Intoccabile (o Quasi)
Ok, abbiamo trovato KLF7. Ma c’è un problema: KLF7 è un fattore di trascrizione. Significa che agisce dentro il nucleo della cellula, regolando l’accensione e lo spegnimento di altri geni. Queste molecole sono notoriamente difficili da colpire con farmaci specifici. Sarebbe come cercare di fermare un direttore d’orchestra lanciandogli una pallina da ping pong nel bel mezzo di un concerto!
La Soluzione: Trovare il Complice Giusto! Ecco ITGA2!
Quindi, abbiamo pensato: se non possiamo fermare il direttore, forse possiamo bloccare uno dei suoi strumenti principali? Abbiamo usato una tecnica chiamata ChIP-seq per vedere quali geni KLF7 controllasse direttamente. È come spiare KLF7 per vedere dove si “lega” sul DNA per attivare altri geni. Tra i vari candidati, uno ha attirato la nostra attenzione: ITGA2.
Perché ITGA2?
- È un gene che codifica per una proteina che si trova sulla superficie della cellula (molto più facile da raggiungere per un farmaco!).
- Questa proteina, l’integrina alfa-2 (ITGA2), funge da “antenna” o recettore, permettendo alla cellula di interagire con l’ambiente circostante, in particolare con la matrice extracellulare (MEC), una specie di impalcatura che tiene insieme i tessuti.
- Anche ITGA2 era particolarmente espresso nel sottogruppo di cellule staminali che avevamo identificato.
- Come KLF7, alti livelli di ITGA2 nei pazienti OSCC erano associati a una prognosi peggiore.
- Abbiamo confermato con esperimenti (saggi luciferasi) che KLF7 si lega proprio alla regione “promotore” del gene ITGA2, attivandone la trascrizione. Spegnendo KLF7, diminuiva anche ITGA2; accendendo KLF7, ITGA2 aumentava.
- Nelle biopsie, ITGA2 si trovava spesso insieme a KLF7 e ai marcatori staminali CD44 e CD133.
Sembrava proprio che ITGA2 fosse il “braccio destro” di KLF7 nel mantenere la staminalità!
ITGA2: L’Antenna che Mantiene Vive le CST
Per essere sicuri, abbiamo fatto esperimenti simili a quelli fatti per KLF7, ma questa volta spegnendo direttamente ITGA2. E voilà! Gli effetti erano quasi identici:
- Meno tumorsfere.
- Meno cellule CD133+ e con alta attività ALDH.
- Ridotta capacità di formare tumori *in vivo*.
- Ridotta capacità di migrazione.
La prova definitiva? Abbiamo preso cellule in cui avevamo spento KLF7 (e quindi con bassa staminalità) e abbiamo riacceso artificialmente solo ITGA2. Indovinate? La staminalità e la capacità migratoria sono state in gran parte ripristinate! Questo dimostra che l’asse KLF7/ITGA2 è davvero cruciale.

Come Funziona ITGA2? Il Legame con il Collagene
Ma come fa ITGA2 a mantenere la staminalità? Essendo un’integrina, il suo lavoro è legarsi a componenti della MEC. Il suo partner preferito è il collagene di tipo I. Abbiamo visto che quando ITGA2 si lega al collagene (grazie a una regione specifica chiamata dominio MIDAS), invia segnali all’interno della cellula che attivano delle vie di comunicazione cellulare note per essere importanti per la sopravvivenza, la crescita e, appunto, la staminalità. Tra queste vie ci sono PI3K-AKT, MAPK e Hippo (in particolare, impedisce a una proteina chiamata YAP1 di essere inattivata). In pratica, legandosi al collagene, ITGA2 dice alla cellula: “Ehi, sei nell’ambiente giusto, continua a fare la staminale!”.
La Svolta Terapeutica: Bloccare l’Interazione ITGA2-Collagene con TC-I 15
A questo punto, l’idea è diventata chiara: se blocchiamo l’interazione tra ITGA2 e il collagene, forse possiamo “spegnere” i segnali pro-staminalità? Abbiamo testato questa ipotesi usando una piccola molecola, un inibitore chiamato TC-I 15, che è noto per interferire proprio con questo legame.
I risultati sono stati entusiasmanti:
- *In vitro*, TC-I 15 ha effettivamente impedito a ITGA2 di legarsi al collagene.
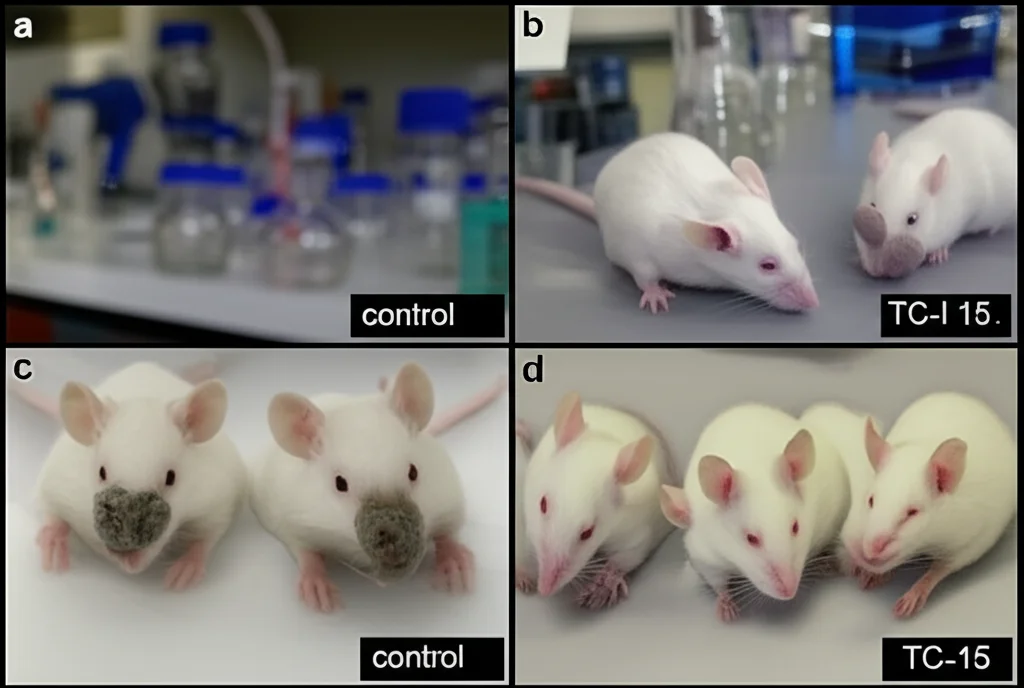
- *In vivo*, nei topi con tumori OSCC umani (xenotrapianti), il trattamento con TC-I 15 ha ridotto significativamente la crescita del tumore.
- Nei tumori trattati, abbiamo visto una riduzione dell’attivazione delle vie PI3K-AKT e MAPK e un aumento dell’inattivazione di YAP1 (proprio come quando spegnevamo ITGA2!).
- Inoltre, la percentuale di cellule staminali CD133+ nei tumori trattati era diminuita.
Ma la vera ciliegina sulla torta è arrivata quando abbiamo combinato TC-I 15 con un chemioterapico standard usato per l’OSCC, il cisplatino. Sappiamo che le CST contribuiscono alla resistenza alla chemio. Ebbene, la combinazione di TC-I 15 e cisplatino ha ridotto la crescita tumorale molto di più rispetto al cisplatino da solo! Questo suggerisce che bloccare ITGA2 non solo combatte il tumore direttamente, ma lo rende anche più sensibile alla chemioterapia. È una strategia anti-CST che sembra funzionare!
Cosa Significa Tutto Questo?
Questa ricerca ci dice che l’asse KLF7/ITGA2 è un meccanismo fondamentale che le cellule staminali del cancro orale usano per mantenersi tali, sfruttando l’interazione con il loro microambiente (la MEC, tramite il collagene). Abbiamo identificato in ITGA2 un bersaglio terapeutico promettente: è sulla superficie cellulare, quindi accessibile, e colpirlo sembra non solo ridurre la staminalità ma anche aumentare l’efficacia della chemio.
Certo, siamo ancora all’inizio. La maggior parte degli esperimenti sono stati fatti *in vitro* o su modelli animali, e serviranno studi su modelli più complessi (come organoidi derivati da pazienti) e poi trial clinici per confermare questi risultati nell’uomo. Ma la strada sembra promettente! Potremmo avere tra le mani una nuova arma per rendere la vita molto più difficile a quelle cellule staminali tumorali che rendono il cancro orale così difficile da curare. Incrociamo le dita!
Fonte: Springer