Iridati di Bario: Il Segreto Ionico per Catalizzatori Super-Resistenti all’Acido!
Ciao a tutti, appassionati di scienza e tecnologia! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta succedendo nel mondo dell’energia pulita, in particolare nella produzione di idrogeno verde tramite elettrolisi dell’acqua. Sapete, l’idrogeno è considerato un vettore energetico chiave per il futuro, ma produrlo in modo efficiente e sostenibile è una bella sfida.
Uno dei metodi più promettenti è l’elettrolisi dell’acqua con membrane a scambio protonico (PEM), che sono compatte ed efficienti. Però, c’è un “però”: l’ambiente all’interno di questi elettrolizzatori è fortemente acido e corrosivo. Questo mette a dura prova i materiali usati come catalizzatori, specialmente all’anodo, dove avviene la reazione di sviluppo dell’ossigeno (OER – Oxygen Evolution Reaction).
L’Iridio: Un Eroe Resistente ma Raro
In questo ambiente ostile, pochi elementi riescono a sopravvivere e a fare il loro lavoro catalitico. L’iridio (Ir) è praticamente l’unico eroe che garantisce sia un’alta attività catalitica sia una sufficiente resistenza alla corrosione in condizioni così estreme. Pensate, è un metallo prezioso e raro, il che ovviamente pone un problema di costi e disponibilità su larga scala.
Ecco perché la ricerca si sta concentrando su come usare l’iridio in modo più intelligente, magari combinandolo con altri elementi in ossidi complessi. L’idea è ottenere catalizzatori super performanti ma con meno iridio possibile. Tra questi, gli iridati complessi, in particolare quelli con una struttura chiamata perovskite esagonale, hanno attirato molta attenzione.
La Struttura Fa la Differenza: Le Perovskiti Esagonali
Immaginate la struttura di questi materiali come un edificio costruito con mattoncini specifici. Negli iridati di tipo AIrO3 (dove A può essere Calcio, Stronzio o Bario), i “mattoncini” fondamentali sono ottaedri [IrO6] (un atomo di iridio circondato da sei di ossigeno). Nelle perovskiti esagonali, questi ottaedri sono collegati tra loro condividendo intere “facce”, non solo spigoli o vertici come in altre strutture. Questa condivisione di facce crea una connessione molto forte e robusta, quasi una sorta di “super-colla” tra gli atomi di iridio.
Questa robustezza è fondamentale perché uno dei principali motivi per cui i catalizzatori a base di iridio si degradano non è tanto la dissoluzione dell’iridio stesso (che è molto resistente), ma piuttosto un fenomeno chiamato ossidazione dell’ossigeno reticolare. In pratica, durante la reazione OER, l’ossigeno che fa parte della struttura stessa del catalizzatore può essere “strappato via” e trasformato in ossigeno gassoso (O2). Se questo accade, la struttura si indebolisce e può collassare. La condivisione di facce rende questo processo molto più difficile: bisognerebbe rompere simultaneamente tre legami ossigeno tra due ottaedri adiacenti, un evento piuttosto improbabile!
Il Nostro Studio: Drogare per Migliorare
Partendo da questo presupposto, abbiamo preso un iridato specifico, il BaIrO3 (iridato di bario) con una struttura esagonale di tipo 9R (un modo per descrivere l’impilamento specifico degli strati atomici), e abbiamo provato a “drogarlo”. No, non in quel senso! In chimica dei materiali, “drogare” significa introdurre piccole quantità di altri elementi nella struttura per modificarne le proprietà.
Abbiamo aggiunto diversi metalli di transizione (Manganese Mn, Cobalto Co, Nichel Ni, Indio In, Niobio Nb e Tantalio Ta) al BaIrO3 e abbiamo studiato cosa succedeva alla sua struttura e, soprattutto, alla sua durabilità in acido forte (pH circa 0.1, come nell’elettrolizzatore PEM).
![Immagine macro fotorealistica della struttura cristallina di un iridato di bario esagonale, tipo perovskite 9R. Obiettivo macro 100mm, alta definizione, illuminazione controllata per evidenziare gli ottaedri [IrO6] che condividono le facce, mostrando la connettività robusta del materiale.](https://scienzachiara.it/wp-content/uploads/2025/05/223/080_immagine-macro-fotorealistica-della-struttura-cristallina-di-un-iridato-di-bario-esagonale-tipo-perovskite-9r-obiettivo-macro.webp)
Risultati Sorprendenti: Ordine Atomico e Trasformazioni Strutturali
La prima cosa interessante che abbiamo notato è che, tranne nel caso del Manganese (Mn), l’aggiunta degli altri metalli induceva una trasformazione della struttura cristallina! Il BaIrO3 originale (tipo 9R) si trasformava in altre varianti della perovskite esagonale:
- Tipo 6H con Cobalto (Co), Nichel (Ni) e Indio (In).
- Tipo 12R con Niobio (Nb) e Tantalio (Ta).
Ma la cosa ancora più affascinante è che questi atomi “ospiti” non si distribuivano a caso nella struttura. Grazie a tecniche di microscopia elettronica a trasmissione a scansione (STEM) ad altissima risoluzione, che ci permettono di “vedere” le singole colonne atomiche, abbiamo scoperto che questi cationi (Co, Ni, In, Nb, Ta) andavano a occupare delle posizioni ben precise e ordinate! Si posizionavano specificamente nei siti che fanno da “ponte” tra i gruppi di ottaedri [IrO6] condividenti le facce (che nelle strutture 6H e 12R formano dimeri [Ir2O9] o trimeri [Ir3O12]). Il Manganese, invece, si distribuiva casualmente al posto dell’iridio, senza cambiare la struttura 9R originale.
Il Test di Durabilità: Chi Vince e Chi Perde?
Abbiamo poi messo alla prova tutti questi materiali drogati sottoponendoli a cicli elettrochimici in acido forte, simulando le condizioni operative dell’OER. I risultati sono stati netti:
- I campioni drogati con Mn, Co, Ni e In mostravano un peggioramento significativo dell’attività catalitica e della stabilità rispetto al BaIrO3 puro. Analisi successive hanno confermato che questi elementi tendono a dissolversi nell’acido, indebolendo la struttura.
- Al contrario, i campioni drogati con Niobio (Nb) e Tantalio (Ta) (quelli con struttura 12R) non solo mantenevano un’alta attività OER, ma mostravano una durabilità eccezionale, addirittura superiore a quella del BaIrO3 di partenza! In particolare, il Ba4NbIr3O12 si è rivelato il campione più stabile di tutti.

Il Segreto della Stabilità: Il Legame Ionico dei Cationi d0
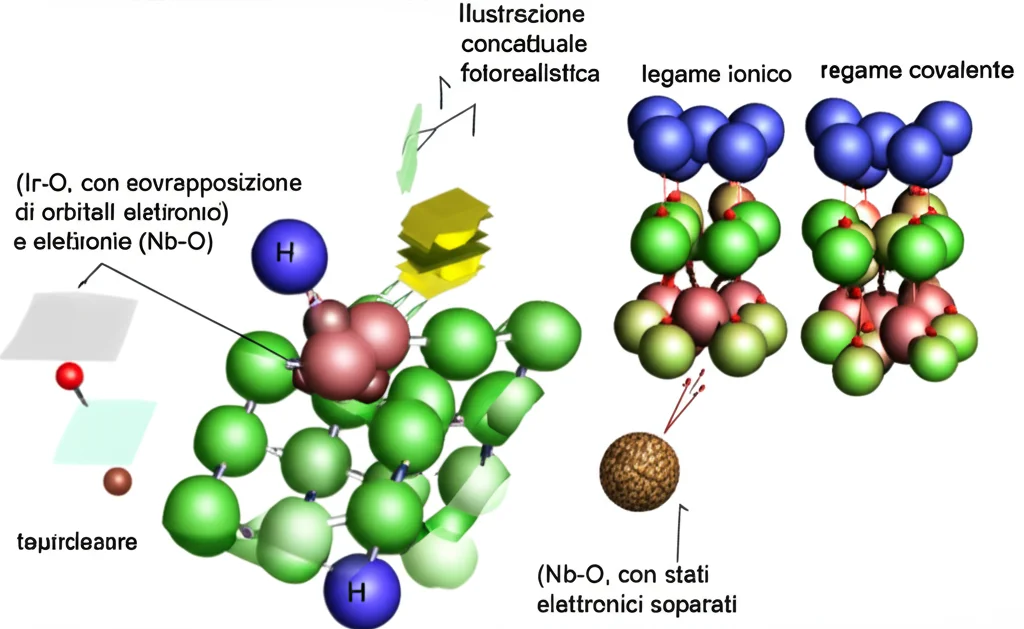
Ma perché Nb e Ta fanno questa enorme differenza? La chiave sta nella loro natura elettronica e nel tipo di legame che formano con l’ossigeno. Sia il Niobio (Nb5+) che il Tantalio (Ta5+) sono cationi cosiddetti “d0”. Questo termine tecnico significa che i loro orbitali elettronici più esterni di tipo “d” sono completamente vuoti.
Questa configurazione elettronica porta Nb5+ e Ta5+ a formare un legame molto forte e prevalentemente ionico con gli atomi di ossigeno vicini. Immaginate il legame ionico come un’attrazione elettrostatica molto forte, quasi come due magneti potenti che si attraggono. Al contrario, il legame tra Iridio e Ossigeno (Ir-O) ha un carattere più covalente, dove gli elettroni sono più condivisi, rendendo questi siti attivi per la catalisi ma anche più suscettibili all’ossidazione dell’ossigeno reticolare.
Cosa succede quindi nei campioni con Nb e Ta? Questi cationi, posizionati strategicamente nei siti di “ponte”, grazie al loro forte legame ionico con l’ossigeno, “blindano” quegli atomi di ossigeno. Li rendono energeticamente molto meno propensi a partecipare alla reazione OER e a essere strappati via dalla struttura. In pratica, sopprimono l’ossidazione dell’ossigeno reticolare proprio nei punti più vulnerabili (i ponti tra i trimeri [Ir3O12]), preservando l’integrità strutturale del catalizzatore. Calcoli teorici (DFT) hanno confermato questa ipotesi, mostrando che gli stati elettronici dell’ossigeno legato a Nb/Ta si trovano a livelli energetici più bassi (più stabili) rispetto a quelli dell’ossigeno legato all’Iridio.
E il Bario? Un Sacrificio Necessario?
Un’altra cosa che abbiamo osservato è che il Bario (Ba), come altri metalli alcalino-terrosi, tende comunque a dissolversi nell’elettrolita acido durante i cicli. Questo porta a un certo irruvidimento della superficie delle particelle e alla formazione di uno strato superficiale un po’ disordinato, quasi amorfo (lo chiamiamo stato paracristallino). Potrebbe sembrare un problema, ma in realtà questa dissoluzione iniziale aumenta l’area superficiale attiva del catalizzatore, contribuendo a migliorare l’attività apparente.
La cosa fondamentale è che, nonostante la perdita di Bario e l’amorfizzazione superficiale, la struttura portante dei trimeri [Ir3O12], protetta dall’effetto stabilizzante del Niobio (o Tantalio) nei siti di ponte, rimane incredibilmente robusta. Abbiamo visto che la carica persa per la dissoluzione del Bario viene compensata dall’ingresso di protoni (H+) dall’elettrolita, formando una sorta di ossiidrossido superficiale, ma il “cuore” del catalizzatore resiste. Simulazioni di dinamica molecolare (AIMD) hanno confermato che anche senza Bario, la struttura a trimeri e l’ordine a medio raggio vengono mantenuti.

Conferme Sperimentali: Meno Ossigeno Reticolare Coinvolto
Per avere una prova diretta che Nb e Ta riducessero il coinvolgimento dell’ossigeno della struttura, abbiamo usato una tecnica super sensibile chiamata TOF-SIMS. Abbiamo fatto funzionare i catalizzatori in un elettrolita preparato con acqua contenente un isotopo pesante dell’ossigeno (18O invece del normale 16O). Analizzando la superficie delle particelle dopo i cicli, abbiamo misurato quanto 18O proveniente dall’elettrolita si era scambiato con l’ossigeno della struttura. Risultato? Il campione Ba4NbIr3O12 mostrava una concentrazione di 18O significativamente inferiore rispetto al BaIrO3 puro, confermando che il suo ossigeno reticolare era molto meno coinvolto nella reazione. Anche analisi di spettroscopia di assorbimento di raggi X (XAS) sul bordo K dell’ossigeno hanno indicato che l’ambiente elettronico attorno all’iridio (il cosiddetto “ligand field splitting”) rimaneva stabile o addirittura si rafforzava leggermente durante i cicli nel campione con Niobio, supportando l’idea di una struttura [IrO6] preservata.
Un’Osservazione sui Test di Durabilità
Durante questo studio, abbiamo anche fatto un’osservazione importante sui metodi usati per testare la durabilità dei catalizzatori. Spesso si usa un test chiamato cronopotenziometria (CP), dove si misura per quanto tempo il catalizzatore riesce a mantenere una certa densità di corrente costante. Abbiamo però notato che questo test è molto sensibile alla dimensione delle particelle del catalizzatore. Particelle più piccole, avendo un’area superficiale maggiore, richiedono un potenziale più basso per raggiungere la stessa corrente e quindi sembrano durare molto di più, anche se il materiale intrinsecamente non è più stabile.
Per un confronto più equo della stabilità intrinseca dei materiali, abbiamo trovato che test come la voltammetria ciclica (CV) o la cronoamperometria (CA), condotti a potenziale costante (o in un range di potenziale fisso), danno risultati molto più consistenti e indipendenti dalla dimensione delle particelle. E anche con questi metodi, il nostro Ba4NbIr3O12 si è confermato il campione più duraturo tra quelli testati, superando anche l’IrO2 commerciale (un riferimento comune).
Conclusioni e Prospettive
Cosa ci portiamo a casa da questa ricerca? Beh, abbiamo dimostrato che giocando con la chimica a livello atomico, in particolare introducendo in modo ordinato cationi specifici come Nb5+ e Ta5+ (cationi d0 con forte legame ionico con l’ossigeno) negli iridati di bario, possiamo migliorare enormemente la loro stabilità strutturale e la loro longevità come catalizzatori OER in ambiente acido.
Questo approccio, basato sul controllo dell’ordine chimico e della natura del legame, apre strade interessanti per progettare catalizzatori a base di ossidi più duraturi, non solo per l’elettrolisi dell’acqua ma potenzialmente anche per altre reazioni elettrochimiche. L’idea di usare cationi d0 per “proteggere” l’ossigeno reticolare potrebbe essere applicata anche ad altri sistemi.
Insomma, la caccia a catalizzatori migliori per l’idrogeno verde continua, e capire a fondo come funziona la materia a livello atomico è la nostra arma migliore!
Fonte: Springer