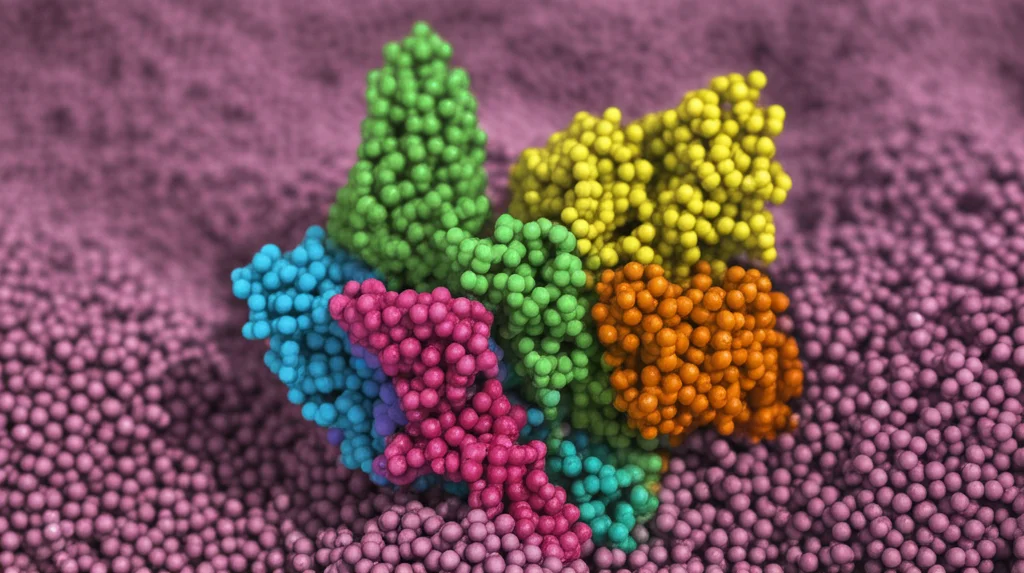
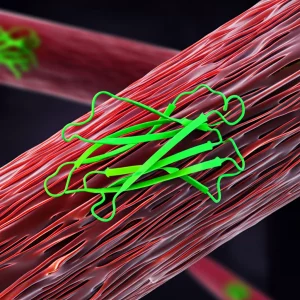
Il Ballo Segreto del Cuore: Nuove Danze Molecolari nel Canale al Sodio
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel cuore pulsante delle nostre cellule cardiache, per spiare da vicino uno dei suoi protagonisti molecolari: il canale al sodio voltaggio-dipendente, noto come NaV1.5. Pensate a lui come a un guardiano sofisticato che controlla il flusso di ioni sodio, essenziale per il battito cardiaco. Ma come ogni personaggio complesso, ha i suoi segreti, specialmente in una sua parte chiamata dominio C-terminale (CTD).
Un Dominio Misterioso: Il CTD
Per molto tempo, capire cosa facesse esattamente questo CTD è stato un vero rompicapo. Le tecniche come la criomicroscopia elettronica (CryoEM) ci hanno mostrato un’istantanea: il CTD che interagisce con un’altra parte del canale, il cosiddetto “cancello di inattivazione” (IGATE), un anello citosolico cruciale che collega i domini III e IV del canale. Sembrava una coppia affiatata.
Ma la biologia molecolare è piena di sorprese! Durante i nostri precedenti tentativi di modellare al computer l’intera struttura del NaV1.5, utilizzando simulazioni di dinamica molecolare (MD) sempre più potenti, abbiamo assistito a qualcosa di inaspettato: in alcuni casi, questa coppia si separava! Il CTD si staccava dall’IGATE. Questo ci ha fatto drizzare le antenne: se il CTD non è sempre legato all’IGATE, con chi altro potrebbe interagire?
L’Indizio dell’IQ Motif
Altri studi, usando tecniche diverse come la spettroscopia NMR, avevano già lanciato un’ipotesi intrigante. Avevano dimostrato che un CTD ricostituito in laboratorio poteva legarsi a un piccolo pezzo di proteina chiamato “motivo IQ”. La cosa interessante è che anche questo motivo IQ fa parte della lunga coda C-terminale del canale NaV1.5 stesso, un po’ più a valle del CTD “classico”. Immaginate il CTD che, invece di tenersi all’IGATE, si gira e interagisce con un suo vicino sulla stessa catena proteica!
Questa scoperta NMR era basata su frammenti della proteina. La domanda che ci siamo posti è stata: questa interazione tra CTD e motivo IQ è davvero possibile nel contesto del canale NaV1.5 completo, immerso nel suo ambiente naturale, la membrana cellulare lipidica?
Simulazioni Avanzate per Svelare il Mistero
Ed è qui che entra in gioco la potenza delle simulazioni MD moderne. Abbiamo sfruttato gli ultimi miglioramenti nei modelli computazionali (i cosiddetti “force fields” come ff19SB per le proteine, lipid21 per i lipidi e il modello d’acqua OPC) per costruire un modello virtuale super dettagliato del NaV1.5 completo, inserito in un doppio strato lipidico simulato, con tanto di acqua e sali.
Abbiamo lanciato ben quattro simulazioni indipendenti, ognuna della durata di un microsecondo (che nel mondo molecolare è un tempo considerevole!). In tutte e quattro, abbiamo visto il complesso CTD-motivo IQ rimanere stabile per tutta la durata della simulazione. Era come osservare una nuova coppia molecolare che danzava armoniosamente.
Ma non ci siamo fermati qui. Per essere sicuri, abbiamo fatto altre quattro simulazioni. Questa volta, abbiamo iniziato con il CTD “libero”, non legato né all’IGATE né al motivo IQ. Cosa è successo? In nessuna di queste simulazioni abbiamo visto il CTD legarsi spontaneamente al motivo IQ.
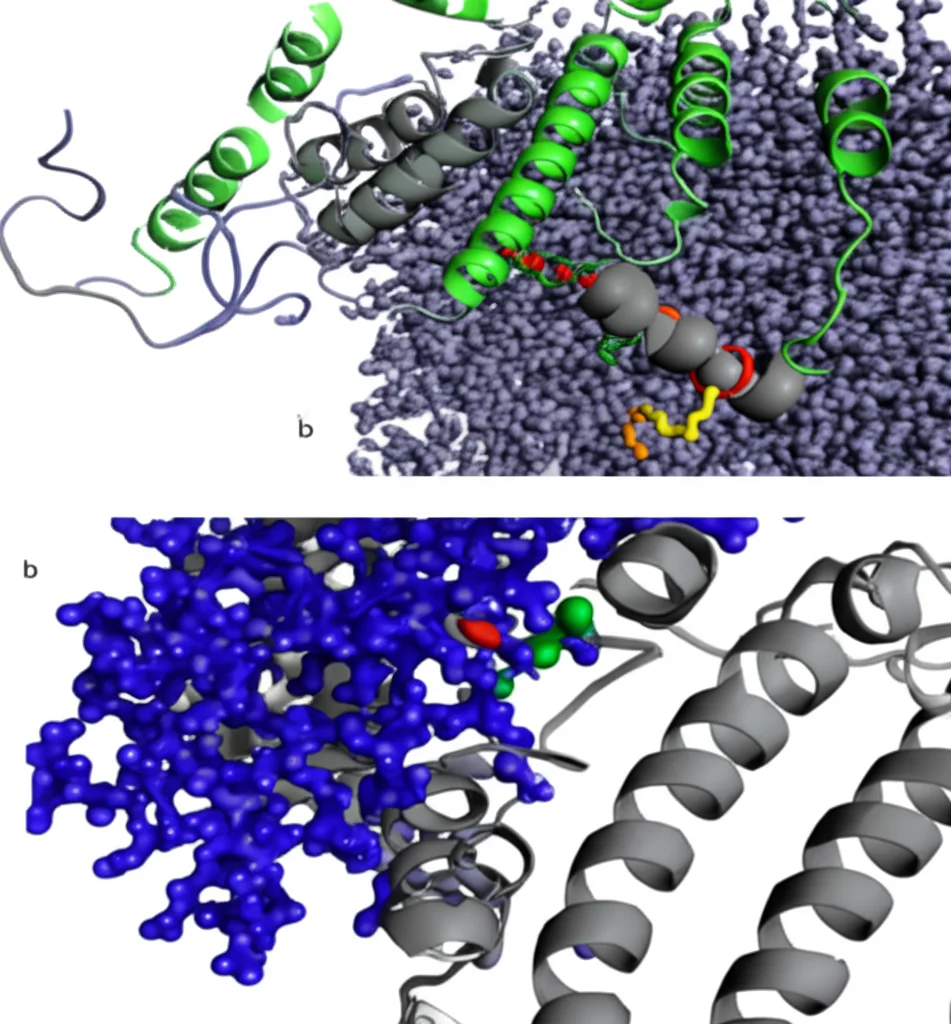
Questo risultato è fondamentale! Suggerisce che per il CTD esistono almeno tre “stati” energeticamente favorevoli, tre posizioni preferite:
- Legato all’IGATE (come visto in CryoEM).
- Legato al motivo IQ (come suggerito da NMR e confermato dalle nostre simulazioni).
- Libero da entrambi.
Un vero e proprio interruttore molecolare con più posizioni!
Zoom sull’Interazione CTD-IQ: Un Abbraccio Molecolare
Andando a vedere più da vicino come il CTD e il motivo IQ si “abbracciano” nelle nostre simulazioni, abbiamo scoperto dettagli affascinanti. L’interazione principale avviene tra le eliche I e IV del CTD e l’elica che costituisce il motivo IQ (chiamata elica VI). Si posizionano in modo “antiparallelo”, come due ballerini che si fronteggiano.
Al centro di questo legame c’è un’interazione idrofobica, una sorta di “repulsione per l’acqua” che spinge le parti non polari delle molecole a stare vicine. In particolare, un amminoacido chiamato Fenilalanina 1912 (F1912) sul motivo IQ si incastra perfettamente tra due altri amminoacidi aromatici sul CTD: la Fenilalanina 1791 (F1791) e la Tirosina 1795 (Y1795) sull’elica I. È come una chiave che entra nella sua serratura. La Y1795 interagisce anche con un’Isoleucina (I1908) del motivo IQ.
Ma non è solo una questione idrofobica! Abbiamo visto anche la formazione di due “ponti salini”, legami elettrostatici tra amminoacidi carichi positivamente e negativamente: E1784 (negativo) sul CTD con R1919 (positivo) sull’IQ, e D1792 (negativo) sul CTD con R1913 (positivo) sull’IQ. Questi ponti aggiungono ulteriore stabilità al complesso.
La cosa incredibile è che questi dettagli combaciano perfettamente con i dati sperimentali NMR! Gli amminoacidi che noi vediamo coinvolti nell’interazione sono proprio quelli che mostravano i maggiori cambiamenti (Chemical Shift Perturbations, CSPs) negli esperimenti NMR quando il peptide IQ veniva aggiunto al CTD. È una bellissima conferma reciproca tra simulazione e esperimento.
Effetti a Catena: Come l’Interazione CTD-IQ Influenza il Canale
Ok, abbiamo stabilito che questa interazione CTD-IQ è plausibile e stabile. Ma cambia qualcosa nel resto del canale? Abbiamo analizzato come la posizione del CTD (legato all’IGATE, legato all’IQ, o libero) influenzi il comportamento generale del NaV1.5.
Abbiamo notato sottili differenze:
- Interazioni con la membrana: Quando il CTD è libero, altre parti citosoliche del canale sembrano avere più “spazio” per interagire con i lipidi della membrana (le teste idrofiliche PC).
- Flessibilità molecolare: La dinamica, la “flessibilità” di alcune regioni del canale, specialmente i linker tra i domini principali e la parte finale della coda C-terminale, cambia a seconda di dove si trova il CTD. Questo potrebbe influenzare come altre proteine accessorie si legano al canale o come esso viene modificato chimicamente.
- Sensori di voltaggio: I sensori di voltaggio sono le parti del canale che percepiscono i cambiamenti elettrici della membrana e fanno aprire o chiudere il poro. Abbiamo osservato che la posizione del CTD, in particolare quando è legato al motivo IQ, sembra influenzare leggermente la struttura dei sensori di voltaggio del dominio III (DIII). L’elica S4 di questo dominio mostra una curvatura particolare, quasi adagiandosi sull’interfaccia tra la parte idrofilica e idrofobica della membrana. È un’osservazione intrigante che merita ulteriori studi. Potrebbe essere un modo in cui il canale “sente” o interagisce con l’ambiente lipidico circostante.
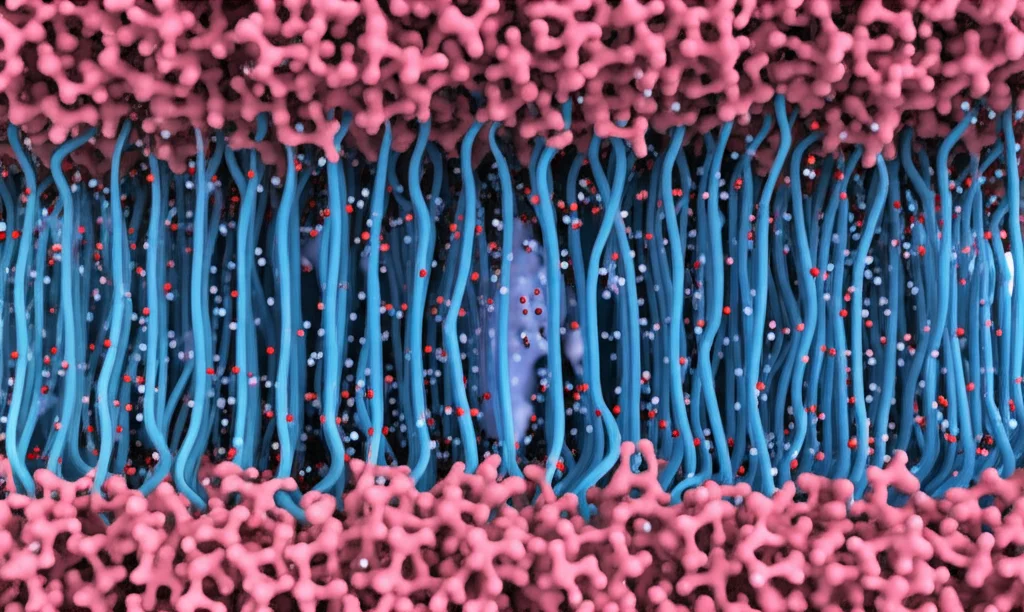
Nonostante questi cambiamenti, la struttura generale del poro del canale (le eliche S5 e S6 che formano il passaggio per gli ioni) non sembrava modificarsi drasticamente nelle nostre simulazioni (che durano microsecondi, mentre l’apertura del canale avviene in millisecondi). I nostri modelli, indipendentemente dalla posizione del CTD, assomigliavano di più alle strutture CryoEM note dello stato “non-conduttivo” (chiuso o inattivato) del canale.
Un Dettaglio Sorprendente: La Rotazione di DIVS6
C’è però un dettaglio strutturale che ci ha colpito. In tutti i nostri modelli simulati (CTD-IGATE, CTD-IQ, CTD-FREE), abbiamo osservato una rotazione specifica nell’elica S6 del dominio IV (DIVS6). Questa rotazione posiziona un amminoacido, la Metionina 1766 (M1766), in modo tale da poter interagire con la Fenilalanina 1486 (F1486), che fa parte del “laccio” del cancello di inattivazione.
La cosa curiosa è che, nelle strutture CryoEM sperimentali, questa interazione M1766-F1486 e la relativa rotazione di DIVS6 si vedono chiaramente solo quando il canale è legato a un farmaco antiaritmico, la ranolazina. Nelle strutture senza farmaco, sembra essere un altro amminoacido (N1765) a interagire con F1486. Le nostre simulazioni, invece, suggeriscono che l’interazione M1766-F1486 potrebbe avvenire anche senza ranolazina, indipendentemente da dove si trovi il CTD. Questa rotazione di DIVS6 sposta anche un altro amminoacido, L1772, in una posizione chiave vicino al cancello di attivazione (AGATE), una posizione che nelle strutture CryoEM senza ranolazina è occupata da I1771.
Cosa significa tutto questo? È ancora presto per dirlo con certezza. Potrebbe essere una differenza legata ai limiti delle simulazioni (come l’assenza di un potenziale di membrana realistico) o potrebbe indicare che la conformazione “tipo-ranolazina” è più accessibile di quanto si pensasse. È un altro pezzo del puzzle che dovremo esplorare.
Implicazioni Cliniche e Prospettive Future
Perché tutto questo interesse per i balletti molecolari del CTD? Perché mutazioni in questa regione del canale NaV1.5 sono associate a gravi aritmie cardiache, come la sindrome del QT lungo (LQT3). Ad esempio, una mutazione R1913H nel motivo IQ, che secondo i nostri modelli rompe uno dei ponti salini che stabilizzano il complesso CTD-IQ, è nota per aumentare la “corrente tardiva” di sodio, un fenomeno pro-aritmico. Capire come queste interazioni (CTD-IGATE, CTD-IQ) sono regolate e come le mutazioni le alterano è cruciale per comprendere la malattia e sviluppare nuove terapie.
Certo, il nostro lavoro è solo un passo. Le simulazioni, per quanto potenti, hanno limiti. La scala temporale di un microsecondo potrebbe non essere sufficiente per catturare tutti gli eventi possibili, come il legame spontaneo del CTD libero o l’apertura completa del canale. Inoltre, non abbiamo considerato l’effetto del potenziale di membrana, la composizione specifica dei lipidi nel cuore, le modificazioni chimiche che avvengono sulla proteina dopo la sua sintesi, o l’interazione con altre proteine partner come la Calmodulina (CaM) o i fattori di crescita dei fibroblasti (FGF), che si sa legano proprio vicino o sul motivo IQ e potrebbero modularne l’interazione con il CTD.

Il quadro che emerge è quello di un dominio C-terminale dinamico, capace di adottare diverse conformazioni e interazioni (almeno tre: CTD-IGATE, CTD-IQ, CTD-FREE). È probabile che il passaggio tra questi stati sia finemente regolato e fondamentale per il corretto funzionamento del canale durante il ciclo cardiaco. Forse l’interazione CTD-IGATE si rompe per prima, e poi, magari in risposta a segnali specifici (cambiamenti di voltaggio, legame di altre proteine?), si forma l’interazione CTD-IQ.
Il nostro viaggio nel cuore molecolare del NaV1.5 continua. Abbiamo aperto una nuova porta sulla complessità di questo canale vitale, svelando una potenziale danza molecolare tra il CTD e il motivo IQ. Ogni nuova scoperta ci avvicina a comprendere meglio come funziona il nostro cuore e cosa va storto nelle malattie cardiache. Restate sintonizzati per i prossimi capitoli di questa affascinante storia molecolare!
Fonte: Springer