Il Segreto Molecolare di Elk-1: Come un Interruttore Fosforilato Accende i Nostri Geni!
Ciao a tutti, appassionati di scienza e curiosi dei meccanismi della vita! Oggi voglio portarvi con me in un viaggio affascinante nel cuore delle nostre cellule, per scoprire come fanno a “decidere” quali geni accendere e quando. Immaginate il nostro DNA come un’immensa libreria di istruzioni, e le proteine come operai specializzati che leggono solo certi libri (i geni) al momento giusto. Ma chi dà l’ordine? E come?
Il Regista Molecolare: Il Complesso Mediatore
Uno dei protagonisti di questa storia è un enorme complesso proteico chiamato Mediatore. Pensatelo come un vero e proprio regista molecolare, un intermediario cruciale che collega i segnali esterni della cellula alla macchina che legge il DNA, la RNA polimerasi II (Pol II). Il Mediatore riceve istruzioni da altre proteine, i fattori di trascrizione, che si legano a specifiche sequenze del DNA e dicono al Mediatore: “Ehi, qui bisogna attivare questo gene!”. Il Mediatore, a sua volta, “parla” con la Pol II e la aiuta a iniziare il suo lavoro di trascrizione. È un sistema elegantissimo, ma pieno di dettagli ancora misteriosi. Come fanno esattamente questi fattori di trascrizione a “parlare” con il Mediatore?
Un Attore Chiave: Elk-1 e il Segnale Ras-MAPK
Qui entra in scena un fattore di trascrizione specifico, chiamato Elk-1. Elk-1 è particolarmente interessante perché risponde a una cascata di segnali molto importante nella cellula, la via Ras-MAPK. Questa via è come una catena di comando che si attiva quando la cellula riceve certi stimoli dall’esterno, ad esempio segnali che le dicono di crescere o dividersi. Quando la via Ras-MAPK è attiva, uno dei suoi ultimi “messaggeri”, la chinasi ERK, fa una cosa fondamentale: aggiunge dei gruppi fosfato a Elk-1. Questo processo si chiama fosforilazione ed è come accendere un interruttore su Elk-1. Solo quando è fosforilato, Elk-1 diventa veramente attivo e capace di stimolare la trascrizione di geni importanti, come quelli chiamati “geni precoci immediati” (ad esempio Egr1 e Fos), che sono cruciali per la risposta cellulare.
Il Punto di Contatto: MED23
Sappiamo da tempo che Elk-1 fosforilato interagisce con il complesso Mediatore, e in particolare con una sua subunità specifica chiamata MED23. MED23 fa parte della “coda” del Mediatore, una regione specializzata proprio nel ricevere segnali dai fattori di trascrizione. Se togliamo MED23 dalle cellule, Elk-1 fosforilato non riesce più ad attivare i suoi geni bersaglio! Questo ci dice che MED23 è il punto di contatto essenziale, la “presa” a cui Elk-1 si deve collegare. Ma come avviene questo collegamento a livello molecolare? Qual è la forma di questa “presa” e della “spina” di Elk-1? Fino ad ora, era un mistero, soprattutto perché le parti dei fattori di trascrizione che interagiscono con il Mediatore (i domini di attivazione) sono spesso disordinate e flessibili, difficili da “fotografare”.
La Rivelazione della Struttura: Una Stretta di Mano Molecolare
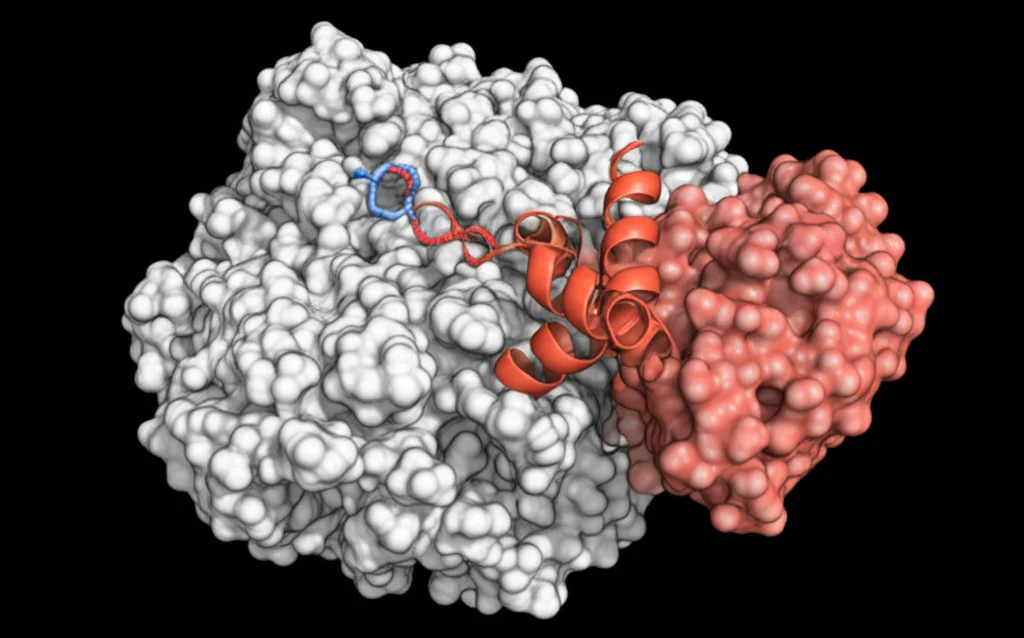
Ed ecco la parte entusiasmante! Utilizzando una tecnica potentissima chiamata crio-microscopia elettronica (cryo-EM), siamo riusciti a ottenere un’immagine ad altissima risoluzione, quasi a livello atomico (3.0 Ångström!), del complesso formato da MED23 umano e dal dominio di attivazione di Elk-1 fosforilato. È come essere riusciti finalmente a vedere la stretta di mano molecolare tra queste due proteine!
Cosa abbiamo scoperto? Elk-1 si lega a MED23 usando una piccola sequenza di amminoacidi idrofobici (che “non amano” l’acqua): PSIHFWSTLSPP. Chiamiamola MBM (Motif Binding MED23). All’interno di questa sequenza c’è uno degli amminoacidi chiave fosforilati, la Serina 383 (S383p). È incredibile vedere come questa sequenza si ripieghi in modo preciso, formando una sorta di “curva stretta” attorno a un residuo centrale, la Fenilalanina (la F in HFWS). Questa Fenilalanina (F378 di Elk-1) si infila profondamente in una “tasca” sulla superficie concava di MED23, come una chiave nella sua serratura. Altri due amminoacidi idrofobici di Elk-1, Isoleucina 376 (I) e Leucina 382 (L), si accomodano in altre tasche vicine su MED23, stabilizzando ulteriormente il legame.

Curiosamente, il gruppo fosfato su S383p non sembra interagire direttamente in modo esteso con MED23, ma punta verso l’esterno. Allora perché la fosforilazione è così importante? Gli studi precedenti e i nostri dati di affinità (misurati con una tecnica chiamata SPR) suggeriscono che la fosforilazione, anche in siti vicini, sia necessaria per indurre un cambiamento conformazionale in Elk-1 stesso, rendendo la sequenza MBM accessibile e pronta per legarsi a MED23. È come se l’interruttore della fosforilazione non solo accendesse Elk-1, ma gli desse anche la forma giusta per inserirsi nella presa di MED23. Abbiamo visto che anche la fosforilazione in altri siti vicini (come T368 e S389) può aiutare il legame, suggerendo un meccanismo di regolazione fine basato su fosforilazioni multiple.
L’Effetto Domino: Cambiamenti Allosterici in MED23
Ma la storia non finisce qui! La cosa forse più affascinante è che il legame di Elk-1 su un lato di MED23 (la faccia concava) provoca dei cambiamenti strutturali che si propagano attraverso la proteina fino alla faccia opposta (la faccia convessa). È un classico esempio di allosteria: un legame in un punto influenza l’attività o la forma di un punto distante.
Nello specifico, abbiamo osservato che una regione di MED23 sulla faccia convessa, un segmento di 19 amminoacidi che abbiamo chiamato “HR4-lid” (coperchio HR4), diventa dinamica e disordinata quando Elk-1 si lega. Prima del legame, questo “coperchio” era ben strutturato e copriva una parte della superficie. Dopo il legame, il coperchio si “apre” o diventa flessibile, esponendo una nuova area sulla superficie di MED23.
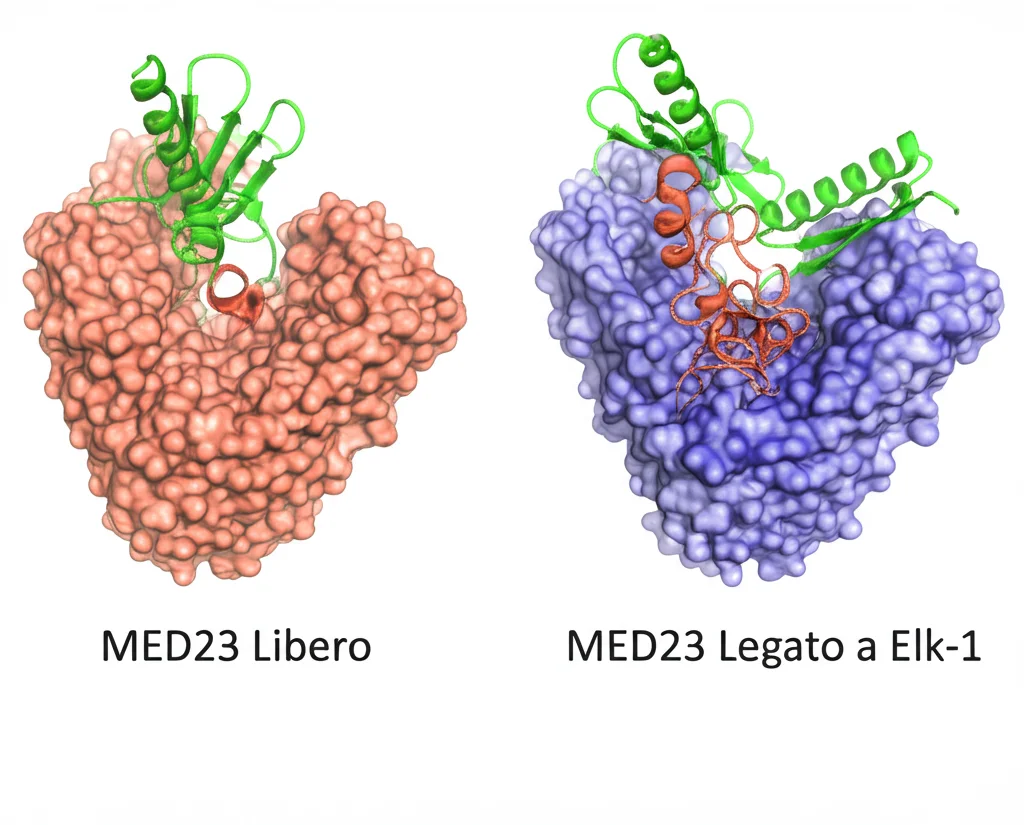
Cosa significa? Questa nuova superficie esposta potrebbe essere un sito di interazione per altre proteine! MED23 non serve solo a reclutare il Mediatore, ma ha anche ruoli successivi, ad esempio nel promuovere l’allungamento della trascrizione da parte della Pol II o nel modificare la cromatina (l’impalcatura del DNA). Forse, legando Elk-1, MED23 cambia forma per poter chiamare a raccolta altri attori necessari per completare l’attivazione del gene. È un’ipotesi eccitante che apre nuove strade di ricerca.
La Prova del Nove: La Mutazione G382F
Per essere sicuri che la nostra struttura riflettesse davvero quello che succede nelle cellule, abbiamo fatto un esperimento cruciale. Abbiamo notato che nella tasca di MED23 dove si infila la Fenilalanina F378 di Elk-1, c’è un amminoacido di MED23 molto piccolo, una Glicina (G382), che non ha una catena laterale ingombrante. Ci siamo chiesti: cosa succederebbe se sostituissimo questa Glicina con un amminoacido molto più grande, come una Fenilalanina (che è proprio come quella di Elk-1)? La nostra idea era che questa mutazione, chiamata G382F, avrebbe “riempito” la tasca, impedendo a F378 di Elk-1 di entrare.
Abbiamo creato questa versione mutante di MED23 e l’abbiamo testata. In provetta, MED23 G382F non riusciva più a legare Elk-1 fosforilato, a differenza della versione normale (WT). Poi siamo passati alle cellule. Abbiamo usato cellule speciali (chiamate MEF) a cui era stato tolto il gene MED23. In queste cellule, Elk-1 non funziona. Reintroducendo MED23 normale, l’attività di Elk-1 veniva ripristinata. Ma reintroducendo la versione mutante G382F, Elk-1 rimaneva inattivo! Questo dimostra che quel singolo contatto strutturale che avevamo identificato è assolutamente essenziale per la funzione di Elk-1 nella cellula.

La cosa interessante è che la mutazione G382F non impediva a MED23 di funzionare con un *altro* attivatore trascrizionale (chiamato E1A CR3), che si lega anch’esso a MED23 ma evidentemente in un sito diverso. Questo conferma la specificità dell’interazione che abbiamo scoperto per Elk-1. Abbiamo anche visto che nelle cellule con MED23 G382F, l’attivazione dei geni bersaglio di Elk-1 (come Egr1, Egr2, Egr3, Fos) in risposta a stimoli esterni (come l’aggiunta di siero) era fortemente compromessa, proprio come nelle cellule senza MED23.
Perché è Importante? Implicazioni e Prospettive Future
Questa scoperta è un tassello fondamentale per capire come viene regolata l’espressione genica, uno dei processi più basilari della vita. Abbiamo svelato i dettagli molecolari di come un segnale esterno (via Ras-MAPK) si traduce, tramite la fosforilazione di Elk-1, in un contatto specifico con il Mediatore (via MED23), portando all’attivazione dei geni. Abbiamo visto come questo contatto non sia statico, ma induca cambiamenti dinamici (allosteria) nella macchina del Mediatore, suggerendo meccanismi di regolazione ancora più complessi.
Capire queste interazioni è cruciale anche dal punto di vista medico. La via Ras-MAPK è spesso iperattiva in molti tipi di cancro, e Elk-1 gioca un ruolo in queste patologie. Avere una mappa dettagliata di come Elk-1 interagisce con MED23 potrebbe, in futuro, aprire la strada allo sviluppo di farmaci mirati che possano bloccare specificamente questa interazione in contesti patologici, senza magari interferire con altre funzioni essenziali del Mediatore.
Il mondo della biologia molecolare è pieno di queste macchine incredibilmente sofisticate e precise. Ogni nuova struttura che riusciamo a “vedere”, come questa di MED23-Elk-1, è una finestra su come funziona la vita a livello fondamentale. È un privilegio poter esplorare questi meccanismi e condividere con voi l’emozione di queste scoperte! Continueremo a indagare per svelare altri segreti del nostro genoma e delle proteine che lo governano. Alla prossima avventura molecolare!
Fonte: Springer



![Visualizzazione artistica e fotorealistica di due strutture cristalline polimorfiche (Forma I e Forma II) illuminate da luce UV. La Forma I mostra molecole che cambiano forma (isomerizzazione cis-trans), mentre la Forma II mostra molecole che si uniscono (fotodimerizzazione [2+2]). Lente macro 105mm, illuminazione drammatica UV simulata, alta definizione dei dettagli molecolari e delle diverse risposte alla luce.](https://scienzachiara.it/wp-content/uploads/2025/05/137_visualizzazione-artistica-e-fotorealistica-di-due-strutture-cristalline-polimorfiche-forma-i-e-forma-ii-illuminate-da-luce-300x209.webp)

