Insulino-Resistenza e Grasso Cardiaco: Un Duo Pericoloso per il Cuore Iperteso (Anche Senza Diabete!)
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi ha davvero fatto riflettere, un legame nascosto ma potentissimo che riguarda il nostro cuore, specialmente se soffriamo di pressione alta. Parliamo di insulino-resistenza (IR), quel fenomeno subdolo che spesso precede il diabete, e di come possa fare danni al cuore interagendo con un attore inaspettato: il grasso epicardico (EAT), quel cuscinetto di grasso che avvolge il nostro muscolo cardiaco.
Sapete, l’ipertensione è una vecchia conoscenza, una delle malattie croniche più diffuse che mette a rischio la nostra salute. Chi ne soffre, soprattutto se la pressione non è ben controllata, rischia di sviluppare fibrosi diffusa nel ventricolo sinistro e problemi nella fase di rilassamento del cuore (disfunzione diastolica). Spesso, ipertensione e diabete vanno a braccetto, ma cosa succede *prima* che il diabete si manifesti? Cosa succede quando c’è solo l’insulino-resistenza?
Cos’è l’Insulino-Resistenza e Perché Dovrebbe Interessarci?
L’insulino-resistenza è, in parole povere, quando le nostre cellule diventano un po’ “sorde” all’insulina, l’ormone che regola gli zuccheri nel sangue. Il corpo deve produrne di più per ottenere lo stesso effetto, e questa condizione è considerata la miccia per tante malattie moderne: sindrome metabolica, fegato grasso, aterosclerosi e, ovviamente, il diabete di tipo 2. Già da sola, l’IR aumenta parecchio il rischio di problemi cardiovascolari. Ma il suo legame specifico con la fibrosi cardiaca nei pazienti ipertesi non era ancora chiarissimo.
Una cosa importante da capire: la fibrosi nel cuore di un iperteso, nelle fasi iniziali, può essere diversa da quella causata da un infarto (che è spesso irreversibile). Nell’ipertensione, la fibrosi e l’ipertrofia (l’ingrossamento del muscolo cardiaco) possono comparire presto, ma sono potenzialmente reversibili! Ecco perché intervenire subito sull’IR è fondamentale: potremmo rallentare o addirittura invertire la progressione della fibrosi e ridurre eventi cardiovascolari gravi.
Il Ruolo Ambiguo del Grasso Intorno al Cuore (EAT)
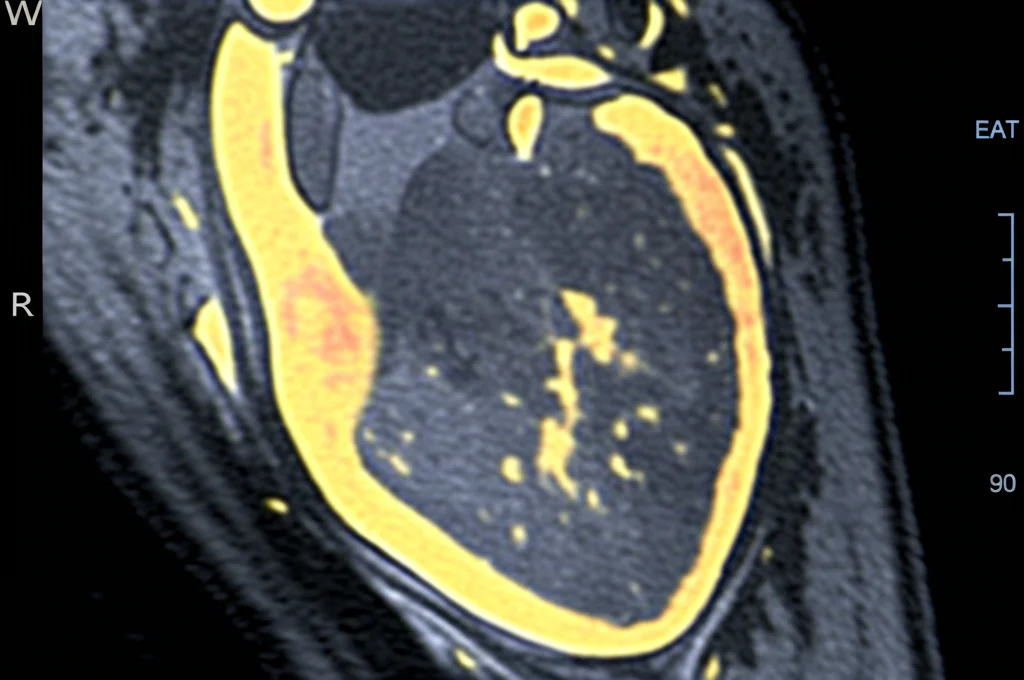
Negli ultimi anni, il grasso epicardico (EAT) ha attirato molta attenzione. È un tessuto affascinante perché ha una doppia faccia. Da un lato, può proteggere il cuore grazie alla sua capacità di produrre calore, un po’ come il grasso bruno. Dall’altro, però, se “impazzisce” (come succede spesso in chi ha sindrome metabolica o IR), può diventare dannoso. Inizia a secernere sostanze pro-infiammatorie e che promuovono la crescita cellulare (citochine), che possono peggiorare la fibrosi e la disfunzione diastolica. Insomma, un amico che può trasformarsi in nemico.
Per misurare l’insulino-resistenza in modo semplice, abbiamo usato l’indice Trigliceridi-Glucosio (TyG). Studi recenti hanno mostrato che questo indice è correlato alla fibrosi miocardica misurata con una tecnica super avanzata, la risonanza magnetica cardiaca (CMR), in particolare tramite un parametro chiamato volume extracellulare (ECV). Un TyG alto, quindi, sembra andare di pari passo con un cuore più “rigido” e fibrotico e con un maggior rischio cardiovascolare.
La Nostra Indagine: Cosa Abbiamo Cercato di Capire?
La domanda che ci siamo posti era: in pazienti ipertesi, ma senza diabete conclamato, l’insulino-resistenza (misurata col TyG) peggiora la fibrosi cardiaca? E che ruolo gioca il grasso epicardico (EAT) in tutto questo?
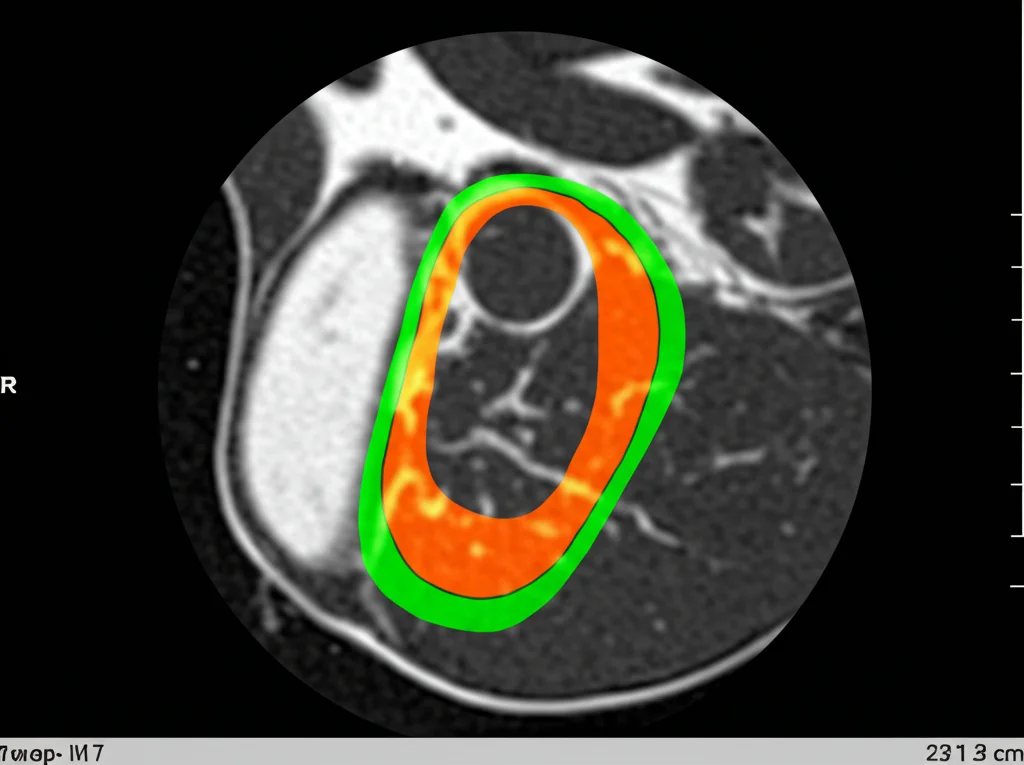
Per scoprirlo, abbiamo coinvolto 166 pazienti ipertesi, reclutati tra il 2015 e il 2024 in due centri medici in Cina. Questi pazienti sono stati sottoposti a risonanza magnetica cardiaca (CMR) per misurare con precisione:
- Il volume del grasso epicardico (EAT)
- La fibrosi diffusa (tramite parametri come il Native T1 e l’ECV)
- La funzione di “spremitura” del cuore in diverse direzioni (tramite lo strain globale radiale GRS, circonferenziale GCS e longitudinale GLS)
Abbiamo calcolato il loro indice TyG e li abbiamo divisi in due gruppi: quelli con TyG più basso (≤ 7.24) e quelli con TyG più alto (> 7.24). Abbiamo anche incluso 30 volontari sani come gruppo di controllo. Abbiamo escluso pazienti con diabete, malattie coronariche note, problemi seri alle valvole cardiache, insufficienza renale grave o una funzione di pompa del cuore già molto ridotta.
Risultati Sorprendenti: L’IR e l’EAT Fanno Squadra Contro il Cuore
E qui arrivano i risultati interessanti! Confrontando i gruppi, abbiamo visto che:
- I pazienti ipertesi, in generale, avevano più grasso epicardico (EAT), valori di Native T1 ed ECV più alti (cioè più fibrosi) e una peggiore funzione di strain (GRS, GCS, GLS più bassi) rispetto ai controlli sani.
- Ma la vera differenza l’abbiamo vista tra i due gruppi di ipertesi: il gruppo con TyG più alto (maggiore insulino-resistenza) aveva significativamente più EAT, Native T1 ed ECV più elevati (più fibrosi!) e strain peggiore (GRS, GCS, GLS più bassi) rispetto al gruppo con TyG basso.
- L’analisi statistica (regressione logistica binaria) ha confermato che sia l’indice TyG che il volume di EAT (indicizzato per la superficie corporea) erano predittori indipendenti di avere un alto valore di ECV (cioè tanta fibrosi). Questo significa che entrambi contribuiscono al problema, anche tenendo conto di altri fattori come età, sesso, BMI, pressione sanguigna, fumo, alcol, farmaci, ecc.
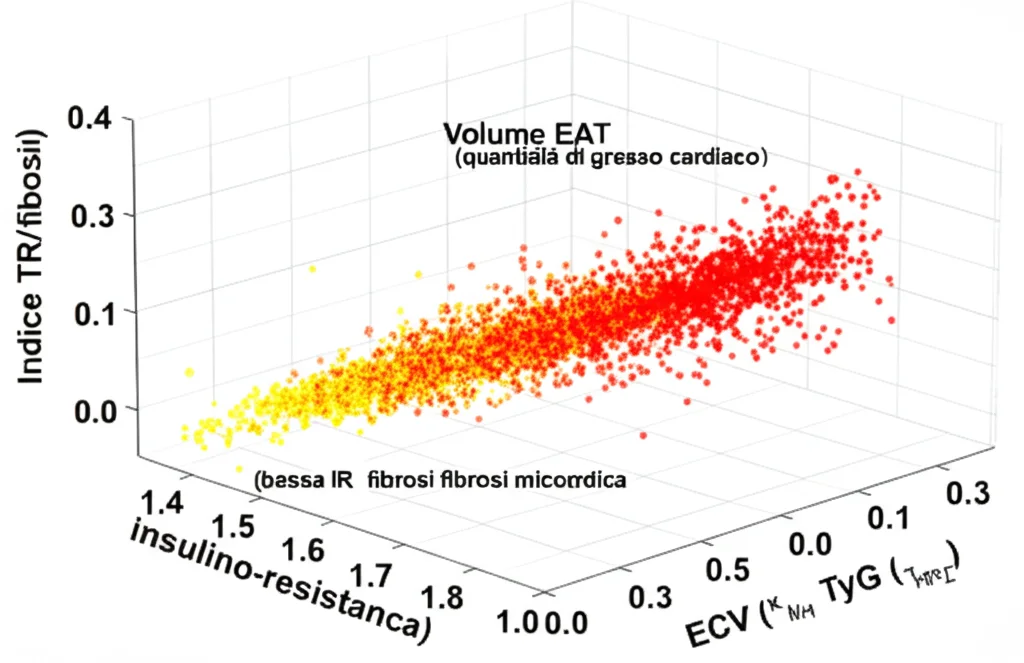
Il Colpo di Scena: l’EAT come “Mediatore”
Ma la scoperta forse più affascinante è arrivata dall’analisi di mediazione. Questa analisi ci aiuta a capire *come* un fattore ne influenza un altro. Ebbene, abbiamo scoperto che l’EAT gioca un ruolo di mediatore nella relazione tra TyG ed ECV. In pratica, sembra che l’insulino-resistenza (alto TyG) non aumenti la fibrosi (alto ECV) solo direttamente, ma anche *attraverso* un’alterazione del grasso epicardico (EAT). L’IR peggiora la situazione agendo sull’EAT, e questo EAT “alterato” contribuisce poi alla fibrosi. Lo stesso meccanismo di mediazione è stato osservato anche per il Native T1.
Questo suggerisce che l’insulino-resistenza, anche nelle sue fasi iniziali in persone non diabetiche, può cambiare la funzione fisiologica del grasso epicardico, trasformandolo da potenziale protettore a promotore di fibrosi.
Cosa Ci Portiamo a Casa?
Questi risultati sono importanti per diversi motivi. Primo, ci dicono che dobbiamo prestare attenzione all’insulino-resistenza molto presto nei pazienti ipertesi, anche se non hanno ancora il diabete. Combattere l’IR potrebbe essere una strategia chiave per prevenire o rallentare la fibrosi cardiaca.
Secondo, il grasso epicardico (EAT) si conferma un attore importante nella salute del cuore e un potenziale bersaglio terapeutico. Non basta guardare solo quanto EAT c’è (il volume), ma bisogna considerare anche il contesto metabolico, in particolare la presenza di IR. Nuovi farmaci, come gli agonisti del GLP1R e gli inibitori SGLT2, sembrano promettenti nel ridurre l’EAT, ma forse agire sull’ambiente che lo circonda (riducendo l’IR, lo stress ossidativo) potrebbe essere altrettanto cruciale per “calmare” questo tessuto e impedirgli di fare danni.
Certo, il nostro studio ha delle limitazioni: è retrospettivo, il numero di pazienti non è enorme e non abbiamo potuto controllare tutti i fattori legati allo stile di vita. Serviranno studi futuri, magari prospettici e multicentrici, per confermare questi risultati e approfondire i meccanismi.
Tuttavia, il messaggio chiave è forte e chiaro: l’insulino-resistenza è un nemico silenzioso per il cuore iperteso, e sembra agire in parte “corrompendo” il grasso che lo circonda. Intervenire precocemente sull’IR potrebbe davvero fare la differenza per la salute a lungo termine del nostro cuore.
Fonte: Springer