Brucellosi: Come Fregare il Batterio Agendo sull’Ospite? Il Ruolo Chiave di SIRT2!
Ciao a tutti! Oggi voglio parlarvi di una battaglia silenziosa che avviene all’interno delle cellule, una lotta tra un batterio subdolo, la *Brucella*, e le difese del nostro corpo, o meglio, del corpo dei bovini in questo caso specifico, ma con implicazioni che potrebbero riguardare anche noi umani. Parleremo di come questo batterio cerca di sopravvivere e di come noi, studiando i meccanismi cellulari, stiamo cercando di dargli del filo da torcere.
Il Nemico: La Brucella e la Brucellosi
La *Brucella* è un batterio Gram-negativo, un tipetto tosto che causa la brucellosi, una malattia zoonotica diffusa in tutto il mondo. Cosa significa zoonotica? Che può passare dagli animali all’uomo. Negli animali, provoca principalmente aborti e infertilità, mentre negli umani i sintomi sono vari e debilitanti: febbre ondulante (la famosa febbre maltese), sudorazioni notturne, dolori articolari, e nei casi gravi anche meningite o polmonite. Il problema è che non esiste ancora un vaccino umano sicuro ed efficace, e le terapie antibiotiche tradizionali, spesso basate su cocktail di farmaci, stanno incontrando sempre più resistenza da parte del batterio. Insomma, affidarsi solo agli antibiotici inizia a mostrare i suoi limiti.
La *Brucella* è particolarmente brava a nascondersi e sopravvivere all’interno delle cellule ospiti, come i macrofagi (le nostre cellule spazzine del sistema immunitario) e, come vedremo oggi, le cellule trofoblastiche, che sono fondamentali nella placenta. Per farlo, usa un arsenale di “trucchi” molecolari, come il suo lipopolisaccaride (LPS) o il sistema di secrezione di tipo IV (T4SS), per eludere le risposte immunitarie dell’ospite. In pratica, è un maestro del mimetismo e della manipolazione.
Un Attore Chiave: La Proteina SIRT2
Qui entra in gioco una proteina affascinante chiamata SIRT2. Cos’è? È un enzima, una deacetilasi NAD+-dipendente presente nei mammiferi. Detta così sembra complicato, ma pensatela come un “regolatore” molecolare. La sua funzione principale è rimuovere piccoli gruppi chimici (gruppi acetile) da altre proteine, modificandone così l’attività. SIRT2 si trova principalmente nel citoplasma, ma in certe condizioni, come durante la divisione cellulare o, appunto, durante un’infezione, può spostarsi nel nucleo.
Recenti studi hanno iniziato a collegare SIRT2 a tantissimi processi cellulari: ciclo cellulare, metabolismo, cancro, immunità e, cosa che ci interessa particolarmente, le interazioni tra ospite e patogeno. Si è visto, ad esempio, che inibire SIRT2 può aiutare a combattere infezioni da *Mycobacterium tuberculosis*, *Listeria*, *Staphylococcus aureus* e *Salmonella*. Ma che ruolo gioca nella brucellosi? Fino ad ora, era un mistero.
La Nostra Indagine: Cosa Abbiamo Scoperto nelle Cellule Placentari Bovine
Ed è qui che entra in campo la nostra ricerca. Ci siamo chiesti: cosa fa SIRT2 quando la *Brucella* infetta le cellule trofoblastiche della placenta bovina (chiamate BTCs)? Queste cellule sono un bersaglio cruciale per la *Brucella*, dato che l’infezione può portare all’aborto.
Abbiamo infettato queste cellule in laboratorio con un ceppo vaccinale di *Brucella abortus* (A19) – usato per sicurezza in strutture ad alta biosicurezza (BSL-3) – e abbiamo osservato cosa succedeva.
Prima scoperta: L’infezione da *Brucella* fa aumentare la quantità di proteina SIRT2 nelle cellule BTCs dopo 48 ore. Non solo, abbiamo visto che SIRT2 tende a spostarsi dal citoplasma al nucleo durante l’infezione. Interessante, no? Il batterio sembra “stimolare” la produzione e la localizzazione di questo regolatore.
Seconda scoperta: L’infezione induce apoptosi, cioè la morte cellulare programmata, in queste cellule. L’apoptosi è spesso un meccanismo di difesa dell’ospite: la cellula infetta si “suicida” per eliminare il patogeno. Abbiamo visto un aumento delle cellule apoptotiche e dell’espressione di Caspasi-3, una proteina chiave nell’esecuzione dell’apoptosi.
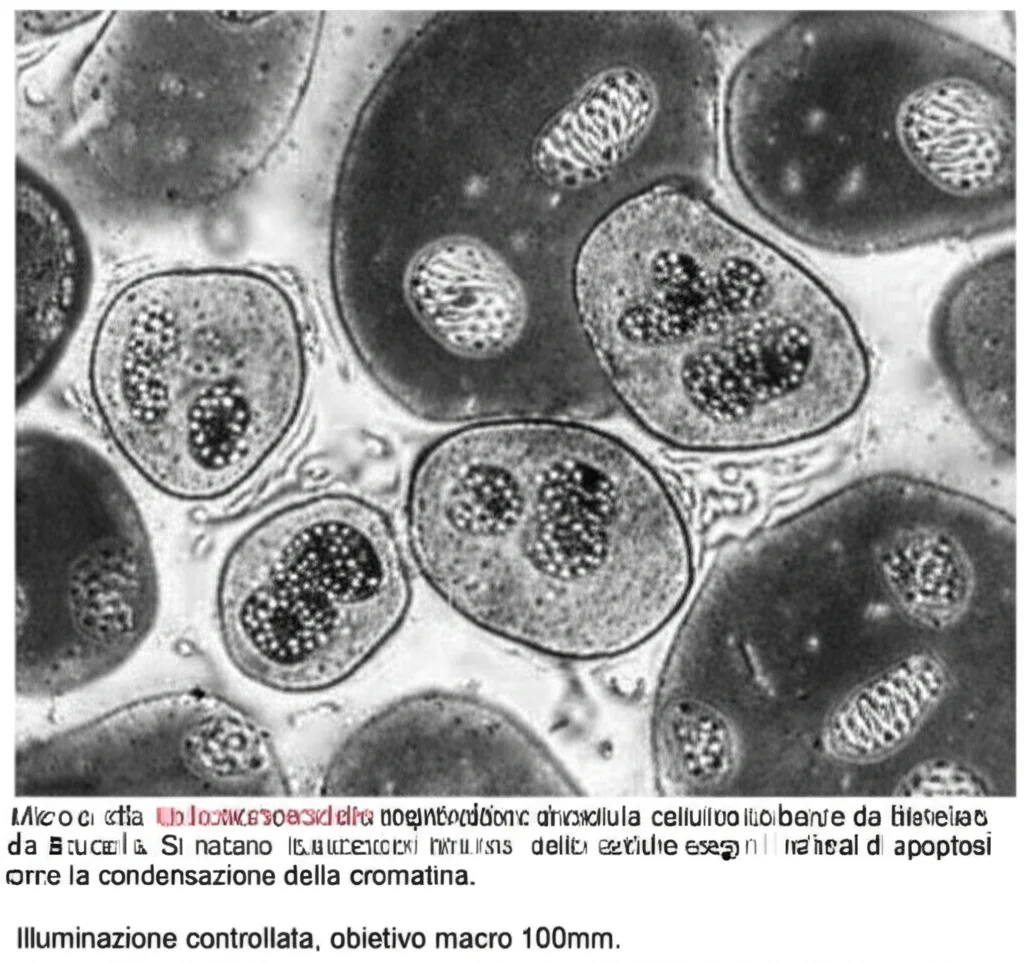
Terza scoperta (e qui viene il bello!): L’apoptosi indotta da *Brucella* sembra legata a un danno ai mitocondri. I mitocondri sono le “centrali energetiche” della cellula, ma sono anche cruciali nel processo apoptotico. Abbiamo osservato che nelle cellule infette, il potenziale di membrana mitocondriale (un indicatore della loro salute) diminuiva, mentre aumentavano i livelli di specie reattive dell’ossigeno (ROS, molecole dannose prodotte in condizioni di stress) e diminuivano i livelli di ATP (l’energia cellulare). Inoltre, abbiamo visto alterazioni nell’espressione di geni legati al DNA mitocondriale e alla sua replicazione. Insomma, i mitocondri soffrivano.
Inibire SIRT2: Un Colpo Basso alla Brucella?
A questo punto, ci siamo chiesti: se l’infezione aumenta SIRT2, e SIRT2 è coinvolta nelle infezioni, cosa succede se la blocchiamo? Abbiamo usato un inibitore specifico di SIRT2, chiamato AGK2, sulle cellule infette.
I risultati sono stati sorprendenti!
- Più apoptosi: Inibendo SIRT2, l’apoptosi indotta da *Brucella* aumentava significativamente! Sembra che SIRT2, normalmente, cerchi di *frenare* questo processo di autodistruzione cellulare indotto dal batterio.
- Meno batteri: Conseguentemente, la sopravvivenza intracellulare della *Brucella* diminuiva drasticamente dopo 24 e 48 ore. Meno cellule ospiti vive e vegete significa meno “case” per il batterio.
- Danno mitocondriale accentuato: L’inibizione di SIRT2 peggiorava ulteriormente la situazione dei mitocondri (potenziale di membrana più basso, più ROS).
Abbiamo anche guardato più da vicino le proteine coinvolte nell’apoptosi mitocondriale. Inibendo SIRT2, aumentava l’espressione di Bax (una proteina pro-apoptotica che agisce sui mitocondri) e di Caspasi-3. Aumentava anche il rilascio di Citocromo C (Cyt-C) dai mitocondri al citoplasma, un segnale chiave che innesca la cascata apoptotica. Inoltre, abbiamo osservato un aumento di DRP1, una proteina coinvolta nella fissione mitocondriale, suggerendo alterazioni nella dinamica di questi organelli.
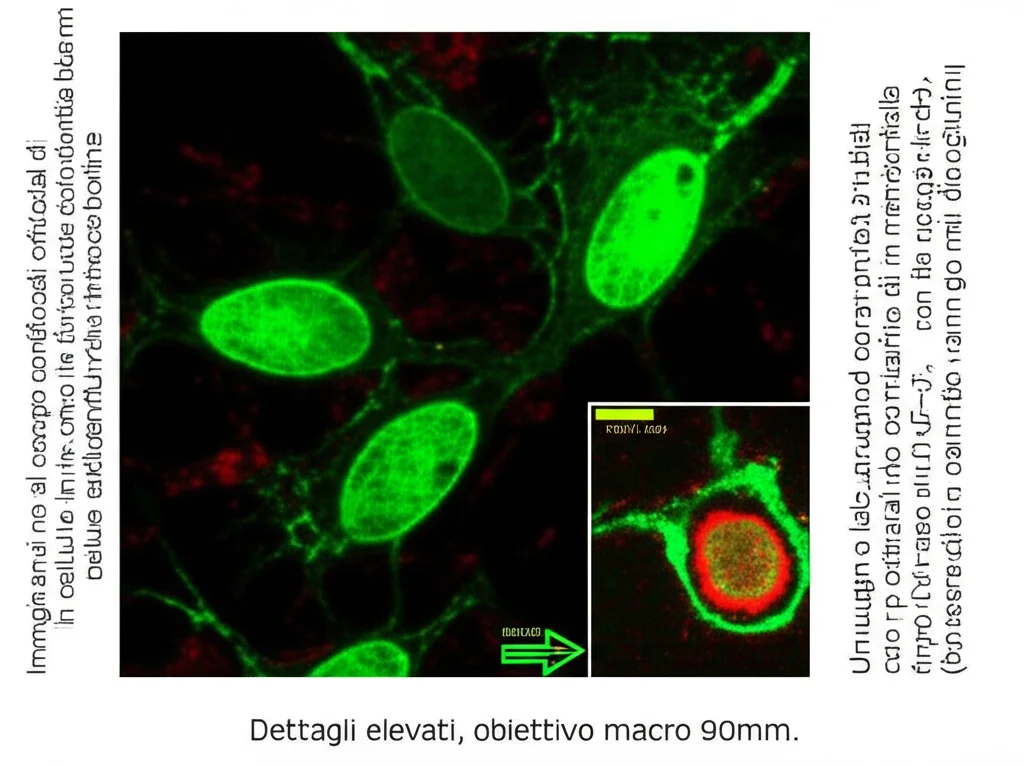
Il Legame con P53: Un Possibile Meccanismo
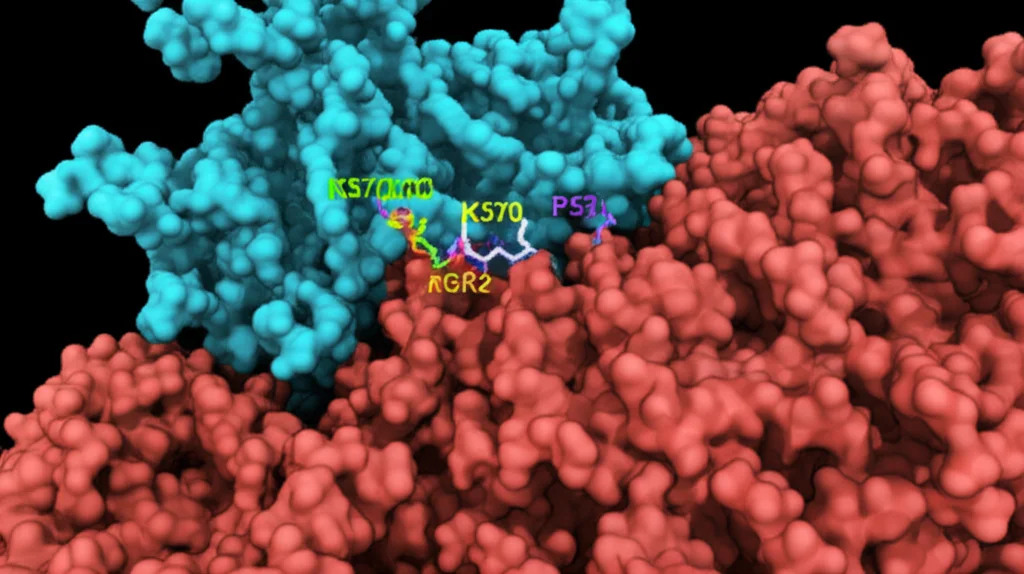
Come fa SIRT2 a frenare l’apoptosi? Un possibile colpevole è la famosa proteina P53, nota come “guardiano del genoma”, che gioca un ruolo cruciale anche nell’apoptosi. Sappiamo che SIRT2 può interagire con P53 e deacetilarla (rimuovere quel famoso gruppo acetile). La deacetilazione spesso inattiva P53 o ne modifica la funzione.
Nel nostro studio, abbiamo visto che inibendo SIRT2 nelle cellule infette, i livelli totali di P53 diminuivano, ma aumentavano i livelli di P53 acetilata in una posizione specifica (K370). Questo suggerisce che SIRT2, normalmente, deacetila P53 in K370, e questa azione potrebbe essere parte del suo effetto anti-apoptotico che favorisce la *Brucella*. Togliendo di mezzo SIRT2, P53 (acetilata) potrebbe contribuire maggiormente all’apoptosi. È un’ipotesi affascinante che merita ulteriori indagini!
Cosa Significa Tutto Questo? Verso Nuove Terapie
Questi risultati sono entusiasmanti perché suggeriscono che SIRT2 gioca un ruolo pro-sopravvivenza per la *Brucella* all’interno delle cellule ospiti, almeno nelle cellule trofoblastiche bovine. Sembra che il batterio “sfrutti” SIRT2 per limitare l’apoptosi mitocondriale della cellula ospite, garantendosi così un ambiente più confortevole per replicarsi.
Inibire SIRT2, quindi, potrebbe rappresentare una strategia di “terapia diretta all’ospite” (Host-Directed Therapy, HDT). Invece di colpire direttamente il batterio (come fanno gli antibiotici), si agisce su un componente della cellula ospite (SIRT2) per renderla meno ospitale e potenziare le sue difese naturali (come l’apoptosi). Questo approccio potrebbe essere particolarmente utile per combattere i batteri intracellulari e aggirare il problema dell’antibiotico-resistenza.
Sfide e Prospettive Future
Ovviamente, la strada è ancora lunga. SIRT2 è coinvolta in molti processi cellulari, quindi inibirla potrebbe avere effetti collaterali imprevisti. Bisogna capire a fondo tutti i meccanismi in gioco e valutare la sicurezza di un approccio del genere. Inoltre, l’*Brucella* è un maestro della manipolazione e probabilmente attiva molte altre vie di segnalazione cellulare che ancora non conosciamo a fondo.
La nostra ricerca, però, apre una nuova finestra sulla complessa interazione tra *Brucella* e cellula ospite e identifica SIRT2 come un potenziale bersaglio terapeutico. È un passo avanti nella comprensione della patogenesi della brucellosi e nella ricerca di strategie innovative per combatterla.
In conclusione, abbiamo scoperto che mettere i bastoni tra le ruote a SIRT2 sembra aiutare le cellule a liberarsi dell’infezione da *Brucella* attivando più efficacemente il loro programma di autodistruzione mitocondriale. Una strategia intrigante che potrebbe, in futuro, affiancare o persino sostituire le terapie attuali. Continueremo a indagare!
Fonte: Springer