Cancro Esofageo: Spegnere YAP per Accendere le Difese Cellulari contro Fumo e Alcol
Ciao a tutti! Oggi voglio parlarvi di qualcosa di affascinante e, diciamocelo, un po’ complesso, che riguarda il cancro esofageo e come certi nostri comportamenti, tipo fumare o bere alcolici, possano influenzare il suo sviluppo a livello cellulare. Ma la parte più intrigante è che forse abbiamo trovato un interruttore molecolare che potrebbe aiutarci a contrastarlo!
Il problema del cancro esofageo e i suoi “vicini”
Il cancro dell’esofago (EC) è una brutta bestia. Nonostante i passi avanti nella diagnosi e nelle terapie, la sopravvivenza a lungo termine non è migliorata tantissimo negli ultimi decenni. Perché? Beh, in gran parte perché non capiamo ancora a fondo come nasce e si sviluppa. Sappiamo che alcol, fumo e bevande bollenti sono fattori di rischio importanti, ma cosa succede esattamente dentro le nostre cellule?
Una cosa interessante emersa di recente è che non solo il tumore stesso è problematico. Anche i tessuti *vicino* al tumore, quelli che chiamiamo tessuti paracancerosi (PCT), che una volta pensavamo fossero “normali” o benigni, in realtà mostrano segni di instabilità genetica. È come se il “campo” intorno al tumore fosse già “minato”, pronto a far scoppiare il cancro vero e proprio. Questo ci ha fatto drizzare le antenne: forse è proprio lì, in quei tessuti apparentemente sani, che si nasconde la chiave per capire e prevenire la malattia?
I soliti sospetti: fumo e alcol sotto la lente molecolare
In questo studio, ci siamo concentrati proprio su questo. Abbiamo preso pazienti con carcinoma squamoso dell’esofago (ESCC), la forma più comune, e abbiamo analizzato non solo il tessuto tumorale, ma anche il tessuto paracanceroso (vicino al tumore, ≤ 2.5 cm) e il tessuto normale distale (più lontano, > 5 cm). Volevamo vedere se e come il fumo e/o il consumo di alcol (abitudini molto comuni tra questi pazienti, ahimè) influenzassero due specifici meccanismi cellulari: la via di segnale Hippo e la piroptosi.
La maggior parte dei pazienti nel nostro studio (ben 41 su 56) aveva una storia di fumo e/o alcol. E i risultati sono stati chiari: nei fumatori e/o bevitori, i geni chiave di entrambe le vie (Hippo e piroptosi) erano significativamente più alterati rispetto ai non fumatori/non bevitori, sia nel tessuto tumorale che, in parte, nel tessuto paracanceroso. Questo suggerisce fortemente che fumo e alcol “scombinano” questi meccanismi cellulari, spingendo le cellule verso il cancro.
Dentro le cellule: Hippo e Piroptosi, chi sono costoro?
Ok, ma cosa sono queste vie Hippo e piroptosi? Cerchiamo di semplificare.
- La via di segnale Hippo è come un controllore del traffico cellulare. Regola la dimensione degli organi e la rigenerazione dei tessuti. Quando funziona bene, tiene a bada la crescita cellulare eccessiva. Una proteina chiave in questa via si chiama YAP (Yes-associated protein). Se la via Hippo è “spenta” o inibita, YAP diventa iperattiva, entra nel nucleo della cellula e dice alla cellula di proliferare e migrare. Non a caso, in molti tumori, inclusi quelli esofagei, la via Hippo è spesso disregolata e YAP è “accesa”.
- La piroptosi, invece, è un tipo particolare di morte cellulare programmata. Non è una morte silenziosa come l’apoptosi; è una morte “infiammatoria”. La cellula si gonfia, scoppia e rilascia segnali che allertano il sistema immunitario. Immaginatela come un allarme antincendio cellulare. Durante lo sviluppo di un tumore, la piroptosi può essere una cosa buona: aiuta a eliminare le cellule potenzialmente pericolose e a richiamare le difese immunitarie per combattere il tumore. Proteine chiave qui sono NLRP3, ASC, CASPASE-1 e GSDMD (la proteina che “buca” la membrana cellulare).
Quindi, riassumendo: via Hippo inibita (con YAP attiva) = brutto segno (proliferazione). Piroptosi attiva = buon segno (eliminazione cellule e allarme immunitario).
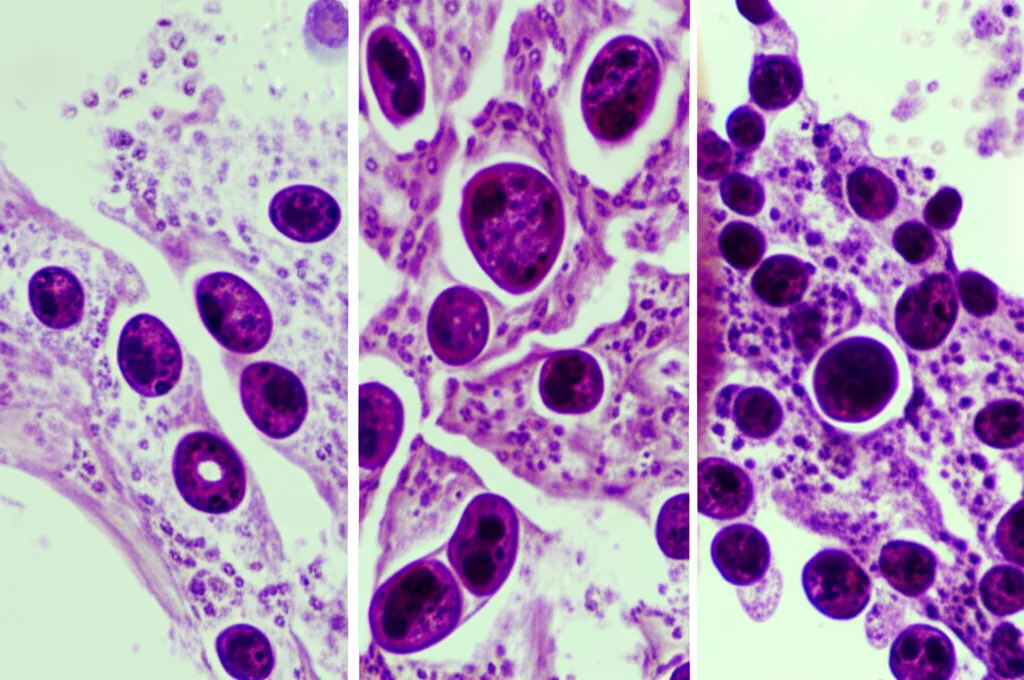
Cosa abbiamo visto nei tessuti e in laboratorio?
Analizzando i tessuti dei pazienti, abbiamo visto che nel tessuto tumorale vero e proprio (EC), la via Hippo era chiaramente inibita (meno LATS1, più YAP e TAZ attive) e anche la piroptosi era soppressa (meno GSDMD e CASPASE-1, anche se NLRP3 e ASC aumentavano, forse come tentativo di reazione iniziale). Questo conferma l’idea che per far crescere un tumore, le cellule devono sia proliferare incontrollatamente (YAP attiva) sia evitare di autodistruggersi (piroptosi spenta).
La cosa interessante è successa nel tessuto paracanceroso (PCT). Lì, abbiamo visto delle alterazioni iniziali in alcuni geni/proteine (come Lats1, Nlrp3 e Asc), soprattutto nei pazienti fumatori/bevitori, ma le intere vie Hippo e piroptosi non erano ancora completamente “spente” come nel tumore. Era come se il tessuto fosse in bilico, vulnerabile.
Per capire meglio, siamo passati al laboratorio. Abbiamo preso dei pezzettini di tessuto paracanceroso e li abbiamo coltivati in vitro, esponendoli a una combinazione di alcol (4.0%) ed estratto di fumo di sigaretta (CSE) a diverse concentrazioni. Ebbene, cosa è successo?
Con l’aggiunta di CSE (da solo al 5.8% o in combinazione con alcol), le cellule del PCT hanno iniziato a mostrare eterogeneità (forme strane, nuclei ingranditi, divisioni anomale) e persino a trasformarsi in cellule cancerose! E, parallelamente a questi cambiamenti morfologici, abbiamo osservato proprio quello che sospettavamo: la via Hippo si inibiva (YAP si attivava) e la piroptosi veniva soppressa. Era come se fumo e alcol, agendo insieme, spingessero queste cellule “in bilico” oltre il limite, attivando YAP e spegnendo il loro sistema di autodistruzione.
La svolta: e se spegnessimo YAP?
A questo punto, ci siamo chiesti: se l’attivazione di YAP è così centrale nel promuovere il cancro e bloccare la piroptosi in queste cellule esposte a fumo e alcol, cosa succederebbe se provassimo a inibire YAP?
Abbiamo usato una molecola chiamata Verteporfina (VPF), nota proprio per essere un inibitore di YAP. L’abbiamo aggiunta alle colture di PCT che stavano diventando cancerose a causa della combinazione alcol + CSE (la dose più alta, 5.8%). I risultati sono stati sorprendenti!
Con dosi crescenti di VPF (specialmente la dose più alta, 9 μM):
- I cambiamenti cellulari verso il cancro sono stati bloccati o invertiti. Le cellule tornavano ad avere un aspetto più normale.
- L’attività di YAP è diminuita significativamente (come confermato anche dalla fluorescenza).
- La via Hippo si è riattivata (più LATS1 e pLATS1).
- E, cosa cruciale, la piroptosi è stata promossa! Abbiamo visto un aumento delle proteine GSDMD e CASPASE-1.
Cosa significa tutto questo? Una nuova speranza?
Questi esperimenti in vitro suggeriscono un meccanismo affascinante: nei tessuti esofagei esposti a fattori di rischio come fumo e alcol, l’attivazione della proteina YAP sembra essere un evento chiave che non solo spinge le cellule a proliferare, ma blocca anche un importante meccanismo di difesa, la piroptosi. Inibendo YAP con la Verteporfina, siamo riusciti a “riaccendere” la piroptosi e a fermare la trasformazione cancerosa delle cellule paracancerose.
L’ipotesi, quindi, è che la down-regolazione (cioè l’inibizione) di YAP potrebbe prevenire la carcinogenesi indotta da fumo e alcol nel tessuto paracanceroso esofageo proprio perché promuove la morte cellulare via piroptosi. È come se togliendo il freno alla piroptosi (inibendo YAP), permettessimo alle cellule potenzialmente pericolose di autodistruggersi prima che diventino un tumore vero e proprio.
Questo apre scenari molto interessanti per il futuro. Potremmo pensare a strategie terapeutiche mirate a YAP, magari proprio nei pazienti ad alto rischio (fumatori, bevitori) o nelle fasi molto precoci della malattia, quando il tumore si sta ancora sviluppando a partire da queste lesioni “pre-cancerose” nel tessuto paracanceroso.
Certo, siamo ancora all’inizio. Questo studio ha dei limiti: il numero di pazienti non era enorme, manca una validazione su modelli animali (in vivo) e servono più dati sulla sicurezza della Verteporfina per questo uso. Però, l’idea che agire su YAP possa riattivare le difese naturali della cellula come la piroptosi è davvero promettente e merita di essere esplorata a fondo. Chissà che non sia una nuova strada per combattere questo difficile tumore.
Fonte: Springer