Ferroptosi Addio! La Nuova Speranza dalle Staminali Ossee per la Tua Schiena
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona tantissimo e che potrebbe davvero cambiare le carte in tavola per chi soffre di problemi alla schiena, in particolare di degenerazione del disco intervertebrale (IVDD). Sapete, quel fastidioso problema che causa dolore cronico e limita la vita di tante persone.
Da tempo, noi ricercatori guardiamo con grande interesse alle cellule staminali mesenchimali ossee (BMSC) come potenziale terapia. L’idea è semplice e geniale: trapiantare queste cellule nei dischi danneggiati per aiutarli a rigenerarsi. Funzionano in diversi modi: riducono la morte delle cellule locali, si trasformano in cellule simili a quelle del nucleo polposo (la parte centrale del disco), migliorano la matrice extracellulare e spengono l’infiammazione. Sembra fantastico, vero?
Il Tallone d’Achille delle Terapie con BMSC
Purtroppo, c’è un “ma”. Uno dei grossi ostacoli è che, una volta trapiantate, queste preziose cellule si trovano in un ambiente davvero ostile. I dischi degenerati sono pieni di stress ossidativo (OS), un po’ come una città invasa dallo smog. Questo stress è dovuto a uno squilibrio chimico, con un eccesso di specie reattive dell’ossigeno (ROS), molecole aggressive che danneggiano le cellule. Le nostre povere BMSC, catapultate in questo ambiente difficile, spesso non ce la fanno a sopravvivere a lungo e la loro efficacia terapeutica diminuisce drasticamente. È un peccato, perché il potenziale c’è tutto!
Ferroptosi: Il Killer Silenzioso delle BMSC
Qui entra in gioco un processo cellulare di cui forse avete sentito parlare meno: la ferroptosi. Non è la solita morte cellulare programmata (apoptosi), ma un tipo specifico di “suicidio” cellulare che dipende dal ferro ed è indotto proprio dallo stress ossidativo. Immaginate il ferro (in particolare lo ione ferroso, Fe2+) che, in eccesso, reagisce con i ROS (come nella reazione di Fenton) scatenando un incendio di perossidazione lipidica. I grassi delle membrane cellulari vanno letteralmente a fuoco, e la cellula muore.
Nei nostri studi precedenti, abbiamo scoperto che la ferroptosi è una delle principali cause della scarsa sopravvivenza delle BMSC sia in laboratorio (quando le esponiamo a stress) sia dopo il trapianto nei dischi degenerati. Quindi, la domanda sorge spontanea: se riuscissimo a bloccare la ferroptosi, potremmo migliorare la sopravvivenza delle BMSC e rendere la terapia più efficace? Io credo proprio di sì!

Prominin-2: Un Possibile Scudo Contro la Ferroptosi
E qui la storia si fa interessante. Abbiamo identificato una proteina chiamata Prominin-2. Pensatela come una specie di buttafuori cellulare. Studi precedenti (anche nostri!) hanno mostrato che Prominin-2 aiuta le cellule a difendersi dalla ferroptosi in due modi principali:
- Butta fuori il ferro in eccesso dalla cellula, riducendo il carburante per quell’incendio di cui parlavamo.
- Inibisce l’espressione di un’altra proteina, un regolatore chiamato BACH1.
BACH1 è un personaggio chiave in questa storia. È un fattore di trascrizione sensibile allo stress ossidativo che, normalmente, tende a sopprimere i geni antiossidanti. Insomma, quando c’è BACH1 in giro, le difese della cellula contro lo stress ossidativo sono più basse, rendendola più vulnerabile alla ferroptosi. Quindi, il fatto che Prominin-2 riesca a tenere a bada BACH1 è una gran bella notizia! Ma come fa esattamente? Questo è quello che abbiamo voluto approfondire.
Svelare il Meccanismo: Come Prominin-2 Neutralizza BACH1
Ci siamo messi al lavoro per capire meglio il legame tra Prominin-2 e BACH1. Abbiamo scoperto qualcosa di affascinante: Prominin-2 non agisce a livello di DNA per bloccare la produzione di BACH1 (il suo mRNA, cioè le istruzioni per costruirlo, non cambiava). Invece, fa qualcosa di più diretto: promuove la degradazione della proteina BACH1 già esistente.
Come? Attraverso un meccanismo chiamato ubiquitinazione. È come se Prominin-2 aiutasse ad attaccare delle etichette “da eliminare” (l’ubiquitina) sulla proteina BACH1. Queste etichette vengono poi riconosciute dal sistema di smaltimento della cellula (il proteasoma), che distrugge BACH1. Abbiamo visto che aumentando Prominin-2, l’ubiquitinazione di BACH1 aumentava e la sua “vita media” si accorciava drasticamente, soprattutto in condizioni di stress ossidativo indotto in laboratorio con una sostanza chiamata TBHP. Abbiamo anche verificato che bloccando il proteasoma (con MG132), la degradazione di BACH1 si fermava, mentre bloccando un’altra via di smaltimento (i lisosomi, con CQ), l’effetto era minore. Questo conferma che è proprio la via ubiquitina-proteasoma quella potenziata da Prominin-2 per liberarsi di BACH1. Fantastico, no? Liberarsi di BACH1 significa potenziare le difese anti-ferroptosi!
Il Ruolo Nascosto di GLS e la Catena di Comando
Ma perché eliminare BACH1 è così importante per fermare la ferroptosi? Abbiamo detto che BACH1 sopprime i geni antiossidanti. Uno dei sistemi antiossidanti più importanti della cellula si basa sul glutatione (GSH), una molecola che neutralizza i pericolosi perossidi lipidici grazie all’enzima GPX4. La sintesi del GSH richiede diversi “ingredienti” e passaggi. BACH1 ostacola questa sintesi.
Noi ci siamo concentrati su un enzima specifico coinvolto in questo processo: la glutaminasi (GLS). GLS trasforma la glutammina in glutammato, un precursore essenziale per produrre GSH. Abbiamo ipotizzato che BACH1 potesse agire proprio bloccando GLS. E avevamo ragione! Negli esperimenti, abbiamo visto che quando BACH1 era presente e attivo (sotto stress da TBHP), i livelli di GLS calavano. Ma se eliminavamo BACH1 (usando una tecnica chiamata shRNA), i livelli di GLS risalivano, anche in presenza di TBHP!
Per confermare l’importanza di GLS, abbiamo usato un suo inibitore specifico, il BPTES. Quando abbiamo trattato le cellule stressate (con TBHP) anche con BPTES, la situazione peggiorava: meno cellule sopravvivevano, aumentavano i danni (misurati come rilascio di LDH), i livelli di ROS e di malondialdeide (MDA, un marcatore della perossidazione lipidica) schizzavano alle stelle, e i mitocondri mostravano i segni tipici della ferroptosi. Inoltre, i livelli di GSH calavano e quelli di glutammato pure. Questo dimostra che GLS è davvero cruciale per proteggere le BMSC dalla ferroptosi indotta da stress ossidativo.
Chi Tira le Fila? Il Ruolo di HSF1
C’era ancora un pezzo del puzzle da sistemare. Come viene regolata Prominin-2? Abbiamo scoperto un altro attore importante: HSF1 (Heat Shock Factor Protein 1). HSF1 è un fattore di trascrizione che si attiva in risposta a vari stress, incluso quello ossidativo, e aiuta la cellula a difendersi. Analizzando database e facendo esperimenti specifici (ChIP-qPCR), abbiamo dimostrato che HSF1 si lega direttamente al promotore del gene PROM2 (quello che contiene le istruzioni per Prominin-2) e ne attiva la trascrizione. In condizioni di stress da TBHP, i livelli di HSF1 diminuivano, e di conseguenza anche quelli di Prominin-2. Ma se aumentavamo artificialmente HSF1 nelle cellule, anche i livelli di Prominin-2 risalivano, proteggendole meglio dalla ferroptosi.
Quindi, abbiamo delineato una vera e propria catena di comando protettiva:
HSF1 → attiva PROM2 → aumenta Prominin-2 → promuove degradazione di BACH1 → smette di inibire GLS → aumenta GLS → aumenta GSH → combatte la ferroptosi!
Dalla Provetta alla Pratica: Test sul Campo (nei Ratti)
Tutto molto bello in laboratorio, ma funziona anche in un organismo vivente? Per scoprirlo, abbiamo creato un modello di IVDD nei ratti, inducendo la degenerazione dei loro dischi lombari. Poi abbiamo diviso i ratti in gruppi e abbiamo iniettato nei dischi danneggiati:
- Soluzione salina (controllo negativo)
- BMSC normali (modificate con un vettore vuoto, LV-NC)
- BMSC modificate per sovraesprimere Prominin-2 (LV-PROM2)
- BMSC con sovraespressione di Prominin-2 e pre-trattate con Hemin, un inibitore che degrada specificamente BACH1.
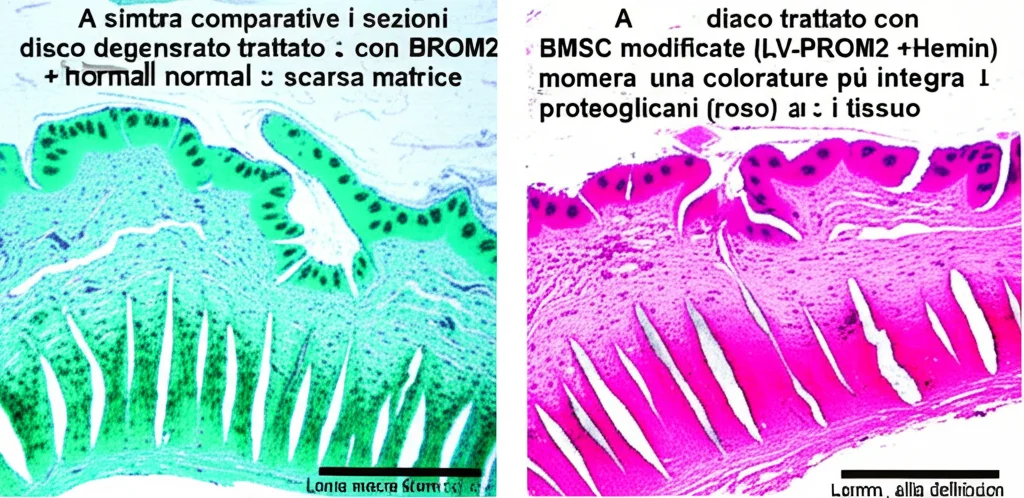
Abbiamo seguito i ratti per 8 settimane, monitorando la sopravvivenza delle cellule trapiantate (marcate con una proteina fluorescente, EGFP) e lo stato dei dischi intervertebrali tramite raggi X e analisi istologiche (colorazioni specifiche come HeE e Safranin O).
I risultati sono stati entusiasmanti! Le BMSC che sovraesprimevano Prominin-2 sopravvivevano meglio di quelle normali. Ma il gruppo migliore è stato quello che combinava la sovraespressione di Prominin-2 con l’inibizione di BACH1 (Hemin). In questi ratti, abbiamo visto:
- Una maggiore sopravvivenza delle BMSC trapiantate (più segnale EGFP).
- Un miglioramento significativo della degenerazione discale: i dischi mantenevano meglio la loro altezza (misurata con l’indice DHI) e la loro struttura istologica era più sana e integra.
- Livelli più bassi di enzimi associati alla degradazione della matrice del disco (MMP-9, ADAMTS5, MMP-13), segno di un ambiente meno degenerato.
Questo ci dice che bloccare la ferroptosi agendo sull’asse Prominin-2/BACH1 non solo aiuta le BMSC a sopravvivere di più nell’ambiente ostile del disco degenerato, ma migliora anche la loro efficacia terapeutica nel contrastare l’IVDD.
Cosa Ci Portiamo a Casa e Prossimi Passi
Quindi, cosa abbiamo imparato? Abbiamo svelato un meccanismo molecolare affascinante, la via HSF1/Prominin-2/BACH1/GLS, che le BMSC usano per difendersi dalla ferroptosi indotta da stress ossidativo. Abbiamo dimostrato che manipolando questa via, in particolare potenziando Prominin-2 e inibendo BACH1, possiamo rendere le BMSC più resistenti e migliorare la loro capacità di riparare i dischi intervertebrali degenerati, almeno nei modelli animali.
Certo, la ricerca non si ferma qui. Ci sono ancora aspetti da approfondire: studiare l’intera cascata in vivo, quantificare meglio l’ubiquitinazione, esplorare il legame con altri processi come l’infiammazione e la mitofagia (la “pulizia” dei mitocondri danneggiati), che sono anch’essi implicati nella ferroptosi e nell’IVDD.
Ma la strada intrapresa sembra promettente. Identificare bersagli terapeutici come la via Prominin-2/BACH1/GLS apre nuove prospettive per ottimizzare le terapie basate sulle cellule staminali. L’obiettivo finale è quello di sviluppare strategie più efficaci per aiutare le persone che soffrono di degenerazione discale a ritrovare una migliore qualità di vita. E io sono ottimista che, passo dopo passo, ci arriveremo!
Fonte: Springer