Titanio Stampato in 3D per Protesi d’Anca: Viaggio tra Microstrutture, Resistenza e Biocompatibilità
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel mondo delle protesi ortopediche, in particolare quelle d’anca, e di come una lega metallica straordinaria, il Ti-6Al-4V, stia rivoluzionando questo campo grazie alla magia della manifattura additiva, o come la chiamiamo più comunemente, stampa 3D.
Questa lega di titanio è una vera superstar: ha un rapporto resistenza/peso incredibile, resiste alla corrosione come poche altre e possiede proprietà meccaniche eccellenti. Non è un caso che venga usata in settori “tosti” come l’aerospaziale, l’automotive e il navale. Ma è nel campo medico che sta davvero facendo la differenza, specialmente per impianti chirurgici e protesi, grazie alla sua biocompatibilità e non tossicità. Pensate, un materiale così robusto e leggero che il nostro corpo accetta senza problemi!
La vera svolta, però, è arrivata con la manifattura additiva (AM), in particolare con tecniche come la Selective Laser Melting (SLM) e l’Electron Beam Melting (EBM). Queste tecnologie ci permettono di “stampare” strato su strato componenti complessi e personalizzati, partendo da polvere di Ti-6Al-4V. Immaginate protesi d’anca o ginocchio, placche cranio-maxillo-facciali, create su misura per il singolo paziente. Sembra fantascienza, vero? Eppure è realtà!
La Sfida: Ottimizzare il Processo
Attenzione però, non è tutto oro quello che luccica (anche se il titanio ha un bel colore!). Produrre pezzi in Ti-6Al-4V con la stampa 3D presenta delle sfide. Fattori come la velocità di raffreddamento o la dimensione del “bagno fuso” (la zona dove il laser o il fascio di elettroni fonde la polvere) influenzano tantissimo la microstruttura finale del pezzo e, di conseguenza, le sue proprietà meccaniche.
Spesso, i pezzi stampati in 3D mostrano una duttilità inferiore e più difetti rispetto a quelli prodotti con metodi tradizionali. Questo può portare a una minore resistenza alla fatica, un aspetto critico per un impianto che deve durare anni nel nostro corpo. Ecco perché sono fondamentali i trattamenti post-processo, come trattamenti termici specifici o la pressatura isostatica a caldo (HIP – Hot Isostatic Pressing), che migliorano le proprietà meccaniche e rendono l’impianto sicuro e affidabile.
Ma non basta. Per favorire l’integrazione dell’impianto con l’osso (la cosiddetta osteointegrazione), spesso si ricorre a trattamenti superficiali. Qui entra in gioco l’idrossiapatite (HA), un materiale bioceramico che è uno dei componenti principali del nostro osso. Rivestire l’impianto in titanio con HA aiuta a promuovere la crescita ossea sulla sua superficie, specialmente nelle prime fasi dopo l’intervento. Esistono vari metodi per applicare questi rivestimenti, ma uno dei più promettenti è l’elettrodeposizione: è relativamente semplice, veloce e permette di ottenere strati omogenei.

Il Nostro Studio: Mettere a Confronto Tecnologie e Trattamenti
Nel vasto mondo della ricerca sul Ti-6Al-4V stampato in 3D, a volte si trovano risultati contrastanti. Questo può dipendere dalle polveri usate, dalle macchine diverse, dai parametri di stampa o dai trattamenti post-processo applicati. Per fare un po’ di chiarezza, abbiamo deciso di condurre uno studio mirato.
Il nostro obiettivo? Capire l’influenza del processo di produzione (SLM vs EBM) e dei trattamenti post-processo (trattamento termico vs HIP) sulle proprietà finali del materiale. E per essere sicuri di confrontare “mele con mele”, abbiamo usato la stessa identica polvere metallica (Ti-6Al-4V grado 23) per tutti i campioni. Abbiamo prodotto campioni con diverse macchine SLM e una macchina EBM, ottimizzando i parametri per minimizzare i difetti.
Abbiamo analizzato campioni “as-built” (cioè come escono dalla stampante, dopo un trattamento di distensione), campioni trattati termicamente (riscaldati a 850°C per 4 ore) e un campione prodotto con EBM e poi sottoposto a HIP (920°C, 120 MPa per 2.5 ore). Come riferimento, abbiamo usato anche un campione di Ti-6Al-4V prodotto con metodo tradizionale (“wrought”). Infine, abbiamo applicato rivestimenti di idrossiapatite su alcuni campioni per valutarne la biocompatibilità. Abbiamo prelevato i campioni da una zona critica di una protesi d’anca simulata, analizzandoli sia parallelamente che perpendicolarmente alla direzione di stampa, per tenere conto della possibile anisotropia (differenze di proprietà a seconda della direzione).
Uno Sguardo al Microscopio: Microstrutture a Confronto
La prima cosa che abbiamo notato è stata la porosità. Tutti i campioni ne avevano una bassissima (inferiore allo 0.2%), ma il campione EBM trattato con HIP (chiamiamolo E-HIP) era il migliore, con una porosità quasi nulla (0.03%). L’HIP fa proprio questo: “schiaccia” i pori e rende il materiale più denso. Gli altri campioni mostravano piccole porosità gassose o, in un caso (S-HT-b), qualche discontinuità più grande dovuta a una fusione non perfetta.
Ma la vera differenza l’abbiamo vista nella microstruttura. Il campione SLM “as-built” (S-Ref) presentava una struttura dominata da martensite aciculare α’. Questa è una fase metastabile che si forma a causa del raffreddamento rapidissimo tipico dell’SLM. È una struttura molto fine, quasi aghiforme.
I campioni SLM trattati termicamente (S-HT-a, S-HT-b, S-HT-c), invece, mostravano una microstruttura lamellare α + β, più equilibrata. Il trattamento termico trasforma la martensite α’ in una miscela di fase α (esagonale compatta) e fase β (cubica a corpo centrato), organizzate in lamelle sottili, spesso in una configurazione detta “basket-weave” (a cesto intrecciato).
Il campione E-HIP, infine, aveva anch’esso una struttura α + β, ma molto più grossolana, nota come struttura di Widmanstätten, con lamelle α più larghe e una maggior quantità di fase β (circa 15% contro il 10% degli altri). Questa struttura più grossolana è tipica dell’EBM e ulteriormente accentuata dal trattamento HIP.
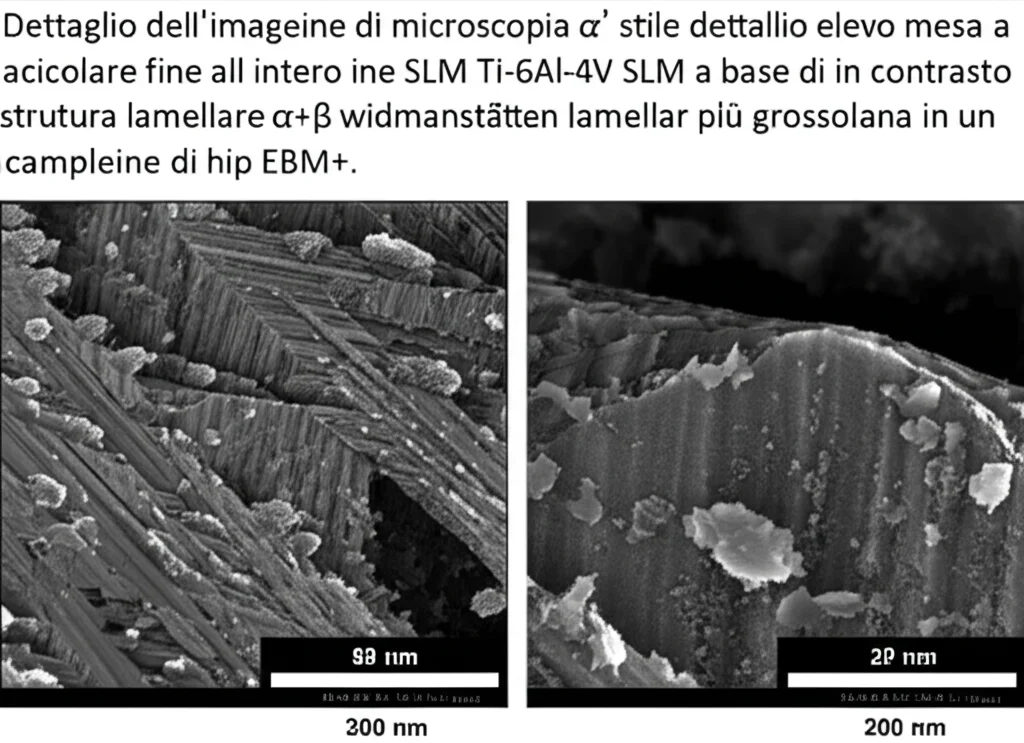
Analisi più approfondite (SEM/EDS e XRD) hanno confermato queste osservazioni, mostrando anche come gli elementi della lega (Alluminio e Vanadio) si distribuiscono nelle diverse fasi: l’Alluminio preferisce la fase α, mentre il Vanadio si concentra nella fase β (o nella martensite α’).
Durezza e Resistenza: Cosa Cambia?
E le proprietà meccaniche? Abbiamo misurato la microdurezza. Il campione S-Ref (as-built) è risultato il più duro (circa 400 HV), proprio grazie alla fine struttura martensitica α’. I campioni trattati termicamente e il campione E-HIP erano leggermente meno duri (circa 370 HV), valori comunque ottimi e paragonabili a quelli del materiale tradizionale lavorato. La struttura α + β lamellare, sebbene meno dura, è generalmente preferita per le applicazioni implantari per via di altre proprietà come la duttilità e la resistenza a fatica, che però non abbiamo testato in questo specifico studio.
Resistenza alla Corrosione: Un Fattore Cruciale
Un impianto nel corpo umano è immerso in un ambiente “aggressivo”, i fluidi corporei. È fondamentale che non si corroda. Il Ti-6Al-4V è noto per la sua eccellente resistenza alla corrosione, dovuta alla formazione spontanea di un sottile strato protettivo di ossido di titanio (TiO₂) sulla sua superficie. Ma come si comportano i nostri campioni stampati in 3D?
Abbiamo eseguito test elettrochimici in una soluzione che simula i fluidi corporei (PBS – Phosphate Buffered Saline) a 37°C.
- Potenziale a Circuito Aperto (OCP): Tutti i campioni hanno mostrato un potenziale che diventava più “nobile” (positivo) nel tempo, indicando la formazione e la crescita dello strato protettivo. Interessante notare che i campioni AM avevano potenziali leggermente più nobili del materiale tradizionale, forse per via della microstruttura più fine che favorisce una passivazione più rapida. Il campione as-built (S-Ref) aveva il potenziale più nobile di tutti, seguito dai trattati termicamente e infine dall’E-HIP con la sua struttura più grossolana.
- Polarizzazione Potentiodinamica (PP): Questo test ci dà informazioni sulla velocità di corrosione. Qui i risultati sono stati diversi: il campione as-built (S-Ref), pur avendo il potenziale più nobile, ha mostrato una densità di corrente di corrosione (icorr) e una velocità di corrosione significativamente più alte degli altri. Questo suggerisce che la struttura martensitica α’, sebbene termodinamicamente più stabile (potenziale nobile), sia cineticamente meno resistente alla corrosione. I campioni trattati termicamente (specialmente S-HT-a) e soprattutto il campione E-HIP hanno mostrato correnti di corrosione molto basse, simili o addirittura migliori del materiale tradizionale. Il trattamento termico e la presenza della struttura α + β sembrano quindi migliorare la resistenza alla corrosione.
- Spettroscopia di Impedenza Elettrochimica (EIS): Questo test conferma i risultati della PP. I grafici (Nyquist e Bode) mostrano che il materiale tradizionale e i campioni trattati termicamente (in particolare E-HIP e S-HT-a) formano strati passivi molto protettivi, con elevate resistenze di polarizzazione (Rpol). Il campione as-built (S-Ref) mostra una resistenza inferiore. L’analisi dei dati suggerisce che una struttura α + β più grossolana, come quella dell’E-HIP, con meno interfacce tra le fasi α e β (che possono agire come micro-celle galvaniche), e un maggior contenuto di fase β (arricchita in Vanadio, più resistente), offra la migliore combinazione per la resistenza alla corrosione in questo ambiente.

Quindi, sembra esserci un compromesso: la struttura martensitica α’ dà maggiore durezza ma minore resistenza alla corrosione, mentre la struttura α + β post-trattamento offre un miglior comportamento alla corrosione, specialmente se la struttura è più grossolana e ricca di fase β come nel campione E-HIP.
Il Tocco Finale: Rivestimenti di Idrossiapatite per la Biocompatibilità
Come accennato, il Ti-6Al-4V è biocompatibile, ma è considerato “bioinerte”, cioè non interagisce attivamente con l’osso. Per migliorare l’osteointegrazione, abbiamo rivestito alcuni campioni (in particolare l’S-Ref) con idrossiapatite (HA) usando l’elettrodeposizione.
Siamo riusciti ad ottenere rivestimenti continui e aderenti su tutti i campioni. Abbiamo notato che una preparazione superficiale tramite sabbiatura (“grit-blasting”) dava risultati migliori (rivestimento più spesso e omogeneo) rispetto all’elettrolucidatura. Le analisi SEM hanno mostrato la tipica struttura lamellare fine dell’HA, e l’analisi EDX ha confermato la presenza di Calcio (Ca) e Fosforo (P) con un rapporto Ca/P vicino a quello ideale (1.67) per l’HA pura e stabile, indicando un rivestimento bioattivo di buona qualità. L’analisi XRD ha confermato la presenza di fasi cristalline di HA sovrapposte a quelle del substrato di titanio.

Ma la prova del nove è la biocompatibilità. Abbiamo messo i campioni rivestiti (e quelli non rivestiti come controllo) a contatto diretto con cellule umane (fibroblasti HFF-1) per 1, 3 e 7 giorni. Abbiamo misurato la loro attività metabolica (test AlamarBlue) e la loro vitalità (test LIVE/DEAD). I risultati? Eccellenti! Le cellule sono cresciute bene su tutti i campioni. Non ci sono state differenze statisticamente significative tra i campioni rivestiti e i controlli dopo 7 giorni, ma i campioni con HA hanno mostrato una tendenza verso un’attività metabolica leggermente superiore, suggerendo una biocompatibilità eccellente, forse persino un pizzico migliore rispetto al Ti-6Al-4V nudo. Le immagini di microscopia a fluorescenza hanno confermato un’alta percentuale di cellule vive e sane su tutte le superfici.
Conclusioni: Un Futuro Stampato in 3D
Cosa ci dice tutto questo? Che la manifattura additiva, combinata con opportuni trattamenti post-processo (come il trattamento termico o l’HIP) e rivestimenti superficiali bioattivi come l’idrossiapatite, è uno strumento potentissimo per creare impianti ortopedici in Ti-6Al-4V di nuova generazione.
Siamo riusciti a ottenere pezzi con bassissima porosità e microstrutture controllate. Abbiamo visto che:
- La microstruttura martensitica α’ (as-built SLM) dà alta durezza ma minore resistenza alla corrosione.
- I trattamenti termici trasformano la struttura in α + β lamellare, migliorando la resistenza alla corrosione a scapito di un po’ di durezza.
- Il processo EBM seguito da HIP produce una struttura α + β di Widmanstätten più grossolana, con porosità minima e ottima resistenza alla corrosione.
- I rivestimenti di idrossiapatite elettrodeposti sono efficaci, aderenti e migliorano ulteriormente la già buona biocompatibilità del materiale.
Insomma, scegliendo la giusta combinazione di tecnologia AM, trattamento post-processo e trattamento superficiale, possiamo davvero ottimizzare le prestazioni degli impianti ortopedici, migliorando la resistenza meccanica, la resistenza alla corrosione e l’integrazione con l’osso. Un passo avanti incredibile per la salute e la qualità della vita di tantissimi pazienti!
Fonte: Springer







