Il Ballo dei Microbi: Come l’Agitazione Cambia le Regole del Gioco nel Biogas
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel cuore dei bioreattori per la produzione di biogas, un mondo microscopico dove batteri specializzati lavorano in squadra per trasformare i rifiuti organici in energia rinnovabile. Parleremo di un processo chiamato digestione anaerobica (AD), una vera meraviglia biotecnologica che ci aiuta nella transizione verso un futuro più sostenibile.
Al centro di questo processo ci sono loro, i microbi. Immaginate una catena di montaggio microscopica: prima alcuni microbi scompongono le molecole complesse (proteine, grassi, carboidrati), poi altri trasformano i prodotti intermedi in acidi grassi volatili (VFA), alcoli, ammoniaca, CO2 e idrogeno (H2). Infine, i metanogeni entrano in gioco per produrre il prezioso metano, il componente principale del biogas.
La Squadra Sintrofica: Un Lavoro di Fina Cooperazione
Ora, le cose si fanno interessanti, soprattutto quando trattiamo materiali ricchi di proteine, come scarti di macellazione o letame di pollo. Questi substrati producono molta ammoniaca, che può essere un problema. Alte concentrazioni di ammoniaca possono mettere KO alcuni attori chiave, come i metanogeni che convertono l’acetato (acetoclastici). Quando questi rallentano, l’acetato si accumula, e spesso anche altri acidi come il propionato. Un bel pasticcio che può compromettere l’intero processo!
Ma la natura è piena di risorse. In condizioni di alta ammoniaca, spesso emerge una squadra alternativa: i batteri sintrofici ossidanti l’acetato (SAOB) e i batteri sintrofici ossidanti il propionato (SPOB). Cosa fanno? Gli SAOB trasformano l’acetato in CO2 e H2, mentre gli SPOB fanno lo stesso con il propionato, producendo anche acetato (che poi verrà gestito dagli SAOB o dai metanogeni acetoclastici, se l’ammoniaca non è troppo alta).
La parola chiave qui è “sintrofico”. Queste reazioni di ossidazione degli acidi sono termodinamicamente difficili, quasi “in salita”. Funzionano solo grazie a una stretta collaborazione con i metanogeni idrogenotrofi. Questi ultimi consumano avidamente l’H2 (o il formiato, un’altra molecola “navetta” per gli elettroni) prodotto dagli ossidatori di acidi, mantenendo la concentrazione di questi prodotti bassissima e rendendo così la reazione favorevole. È un dare e avere fondamentale: gli ossidatori passano elettroni (sotto forma di H2 o formiato) ai metanogeni, che li usano per trasformare la CO2 in metano.
Perché questo scambio funzioni al meglio, la vicinanza fisica tra questi partner microbici è cruciale. Più sono vicini, più efficiente è il trasferimento di elettroni. Una strategia comune per avvicinarsi è formare aggregati, dei “grumi” di cellule chiamati fiocchi. È stato osservato che questi fiocchi si formano proprio nelle colture sintrofiche in condizioni di alta ammoniaca. Ma questi fiocchi servono solo per la sintrofia o anche per proteggersi dallo stress ambientale, come l’alta ammoniaca stessa?
Mescolare o Non Mescolare? Il Dilemma dell’Agitazione
Ed ecco che entra in gioco la tecnologia del processo. Nei bioreattori reali, il contenuto viene spesso mescolato per garantire una distribuzione uniforme di nutrienti e microbi. Ma cosa succede a queste delicate collaborazioni sintrofiche quando agitiamo il tutto? L’agitazione potrebbe rompere i fiocchi, allontanare i partner e compromettere il loro lavoro di squadra? Sorprendentemente, l’impatto specifico dell’agitazione sulle comunità sintrofiche ossidanti acidi non era stato esplorato a fondo.
È qui che entra in gioco la nostra curiosità. Ci siamo chiesti: un’agitazione “distruttiva” può davvero rompere i fiocchi, influenzare la degradazione degli acidi e magari costringere i microbi a cambiare strategia per scambiarsi elettroni? La nostra ipotesi era che rompendo i fiocchi, avremmo visto meno geni legati alla formazione di biofilm e forse un passaggio verso il formiato (più solubile dell’H2) come trasportatore di elettroni preferito.
Per scoprirlo, abbiamo preso delle colture di arricchimento mesofile (che lavorano a temperature moderate) specializzate nel degradare acetato o propionato in condizioni di alta ammoniaca. Le abbiamo sottoposte a tre condizioni:
- Controllo statico (nessuna agitazione)
- Agitazione orbitale (un movimento più dolce, tipo scuotimento)
- Agitazione magnetica (un mescolamento più vigoroso e potenzialmente “distruttivo”)
Abbiamo monitorato come degradavano gli acidi, come cambiava la comunità microbica (chi c’era) e cosa stavano facendo attivamente quei microbi (quali geni esprimevano). Abbiamo anche usato modelli computerizzati fluidodinamici (CFD) per capire esattamente che tipo di forze (shear rate, o forze di taglio) e movimenti del fluido generavano i diversi tipi di agitazione.
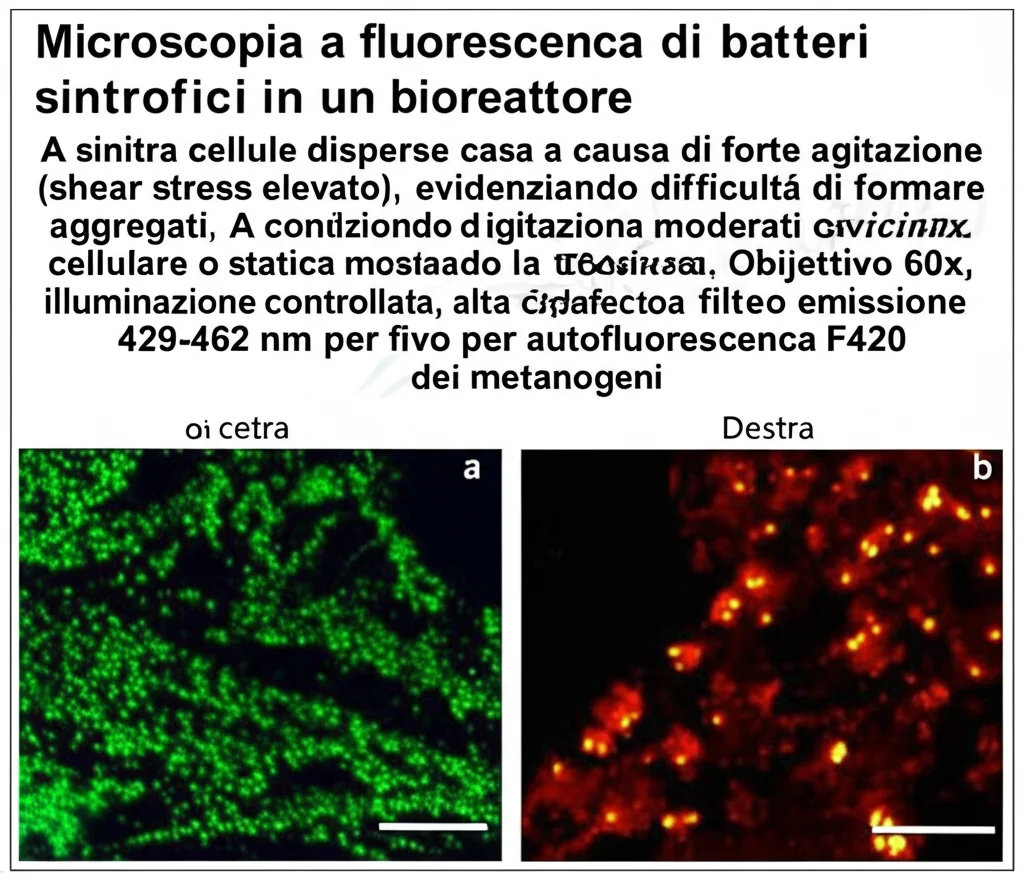
Cosa abbiamo visto subito? Effetti su degradazione e aggregati
I risultati sono stati illuminanti! Partiamo dall’acetato. Qui, l’agitazione magnetica ha causato un ritardo nell’inizio della degradazione (fase di lag più lunga), ma una volta partita, la velocità era simile in tutte le condizioni. Sembra che le comunità SAOB siano abbastanza robuste.
Ma per il propionato… apriti cielo! L’agitazione magnetica ha avuto un impatto devastante. In due repliche su tre, la degradazione del propionato è stata completamente inibita. Nella terza replica, è partita, ma con un ritardo enorme (oltre 50 giorni!) rispetto al controllo statico. Al contrario, l’agitazione orbitale (quella più dolce) ha addirittura ridotto il tempo di attesa rispetto al controllo statico in due repliche. Una volta avviata, però, la velocità di degradazione del propionato era simile tra le condizioni in cui avveniva. Questo suggerisce che il problema principale dell’agitazione intensa è proprio l’avvio del processo sintrofico per il propionato.
E i fiocchi? Le osservazioni visive e i modelli CFD hanno confermato le nostre idee. L’agitazione magnetica generava forze di taglio elevate (~20 s⁻¹) e distribuiva le cellule uniformemente, impedendo di fatto la formazione di fiocchi visibili. L’agitazione orbitale, invece, produceva forze di taglio molto più basse (~5 s⁻¹) e tendeva a far accumulare le cellule sul fondo, favorendo la formazione di fiocchi più grandi rispetto al controllo statico (che formava fiocchi più piccoli e un biofilm sul fondo). Sembra proprio che un po’ di movimento dolce aiuti le cellule a incontrarsi e aggregarsi, mentre un’agitazione troppo forte le tenga separate.
Sotto il cofano: cosa dicono i geni?
Ok, l’agitazione influisce sulla degradazione (soprattutto del propionato) e sulla formazione di aggregati. Ma a livello molecolare, cosa succede? Abbiamo analizzato la composizione della comunità microbica (con il sequenziamento del gene 16S rRNA) e l’espressione genica (con la metatranscrittomica, che guarda all’RNA messaggero, cioè ai geni attivamente utilizzati).
La composizione della comunità (chi c’era) non è cambiata drasticamente a causa dell’agitazione. I principali attori identificati erano i noti SAOB (Syntrophaceticus, Tepidanaerobacter), un candidato SPOB (‘Ca. Syntrophopropionicum’), il metanogeno idrogenotrofo (‘Ca. Methanoculleus ammoniitolerans’), e altri batteri come Acetomicrobium e Alkaliphilus. La differenza principale era tra le colture nutrite con acetato e quelle con propionato (queste ultime avevano lo SPOB, ovviamente).
Ma l’espressione genica… quella sì che ha raccontato una storia diversa! Qui l’agitazione ha lasciato il segno. Ecco i punti salienti:
- SPOB (Ossidatori di Propionato): Sotto agitazione magnetica, abbiamo visto una significativa sotto-regolazione (downregulation) di un gene che codifica per un antiporto ossalato-formiato. Questo sistema potrebbe essere legato alla produzione di energia (creando un gradiente protonico) e sembra dipendere dalla vicinanza cellulare, dato che era più espresso nelle condizioni statiche e con agitazione dolce (dove si formavano aggregati). Un indizio interessante su come questi batteri ricavano energia in condizioni difficili.
- SAOB (Ossidatori di Acetato) e Acetomicrobium: Entrambi i tipi di agitazione hanno causato una downregulation di geni legati alla motilità (come pili di tipo IV e flagelli) e alla percezione della superficie. Sembra che muoversi sia utile solo quando si è fermi (statici), magari per esplorare e formare biofilm sul fondo, ma non quando si viene sballottati dalle correnti. L’agitazione dolce, però, ha indotto negli SAOB l’espressione di geni per l’adesione stretta (proteine Tad), forse per aiutare a formare quei fiocchi più grandi che abbiamo osservato.
- Metanogeni: Qui abbiamo visto i cambiamenti più forti! L’agitazione (soprattutto quella magnetica) ha indotto una sovra-regolazione (upregulation) di molti geni chiave della metanogenesi idrogenotrofica. Sembra una strategia adattativa per massimizzare la conservazione dell’energia in condizioni difficili, forse accoppiando più strettamente il primo e l’ultimo passaggio del processo. Sono stati anche sotto-regolati geni per il trasporto del ferro ferroso e altri enzimi legati al trasferimento di elettroni.

La vicinanza è tutto (soprattutto per gli SPOB)
Perché l’agitazione intensa colpisce così duramente gli SPOB e meno gli SAOB? La nostra ipotesi è che gli SPOB dipendano ancora di più dalla stretta vicinanza con i loro partner metanogeni. Forse usano prevalentemente l’H2 come trasportatore di elettroni, e l’H2 diffonde poco e richiede distanze minime. Rompere i fiocchi aumenta la distanza, fa salire la pressione parziale di H2 attorno allo SPOB, rendendo la sua reazione termodinamicamente più difficile. Gli SAOB potrebbero essere più flessibili, magari usando anche il formiato (più solubile) o avendo meccanismi diversi. Oppure, i fiocchi potrebbero offrire agli SPOB una protezione maggiore dall’alta ammoniaca, protezione che viene meno con l’agitazione.
Un’altra chicca interessante emersa dall’analisi genica riguarda il possibile scambio di amminoacidi tra i microbi. Le analisi genomiche suggeriscono che molti di questi organismi non sanno produrre tutti gli amminoacidi di cui hanno bisogno (sono auxotrofi) e quindi devono scambiarseli. Abbiamo visto, ad esempio, che nelle colture a propionato, dove c’è lo SPOB, gli SAOB sembrano ridurre la produzione di alcuni amminoacidi a catena ramificata, forse perché li ricevono dallo SPOB. Questo sottolinea quanto sia complessa e interconnessa la vita in queste comunità.
Quindi, che lezione portiamo a casa?
Questo studio ci dice chiaramente una cosa: l’agitazione conta, eccome! Soprattutto quando si tratta di avviare la delicata collaborazione sintrofica per degradare il propionato in condizioni di alta ammoniaca. Un’agitazione troppo vigorosa, con elevate forze di taglio, può impedire ai batteri SPOB e ai metanogeni di “trovarsi” e iniziare a lavorare insieme. Gli SAOB sembrano più tolleranti.
Queste scoperte sono fondamentali per la gestione pratica dei digestori anaerobici. Bisogna trovare il giusto equilibrio nell’agitazione: abbastanza per mescolare bene, ma non così tanto da distruggere le interazioni sintrofiche essenziali, specialmente nei momenti critici in cui i livelli di propionato iniziano a salire e c’è bisogno che la comunità SPOB si attivi. Un’agitazione moderata, che magari favorisce la formazione di aggregati senza romperli, potrebbe essere la chiave per migliorare l’efficienza e la stabilità del processo, soprattutto in condizioni difficili come l’alta ammoniaca.
Capire come le forze idrodinamiche influenzano queste microscopiche squadre di lavoro ci aiuta a progettare e gestire meglio i bioreattori, massimizzando la produzione di energia rinnovabile e la stabilità dei processi. È un altro passo avanti nella comprensione e nell’ottimizzazione di questa affascinante biotecnologia!
Fonte: Springer







