Displasia Orale: E Se la Cura Fosse Già Dentro di Noi? Un’Arma Immunitaria Segreta
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi affascina tantissimo nel campo della ricerca medica: come possiamo “addestrare” il nostro sistema immunitario a combattere le malattie prima ancora che diventino un vero problema. Nello specifico, ci tufferemo nel mondo della displasia orale, una condizione che forse conoscete meglio come leucoplachia.
Cos’è la Leucoplachia e Perché Dovremmo Preoccuparcene?
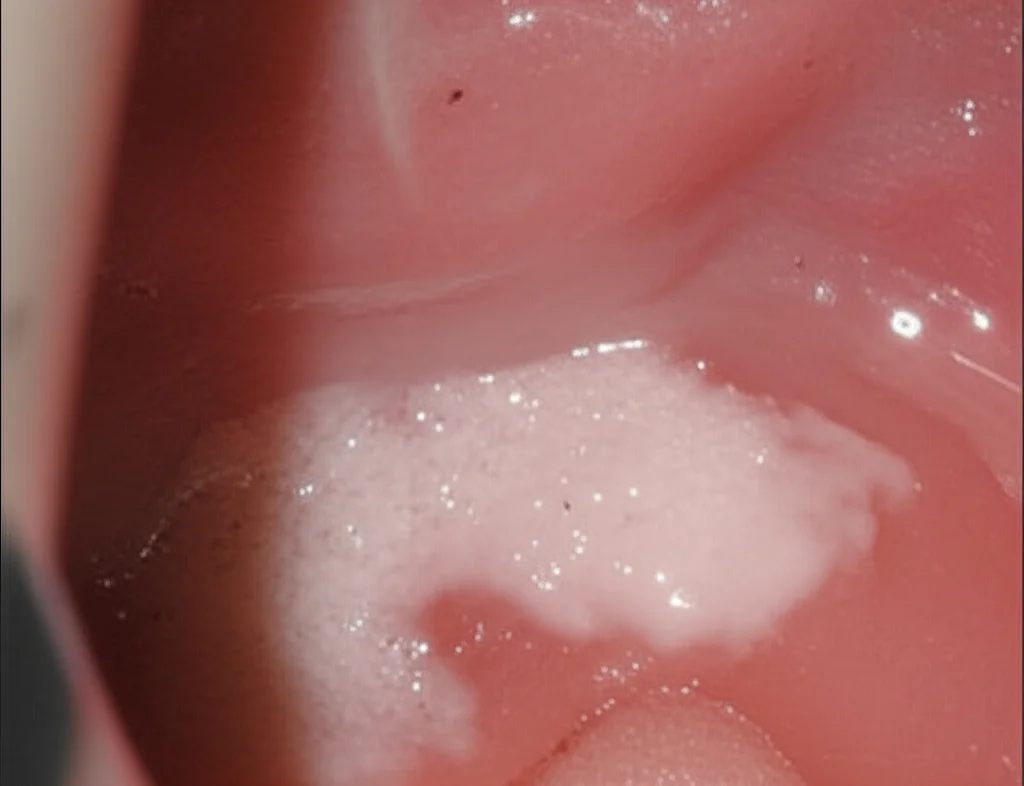
Immaginate di notare una macchia bianca un po’ strana all’interno della bocca, magari sulla guancia o sulla lingua. Ecco, quella potrebbe essere leucoplachia. Tecnicamente, è un tipo di displasia orale, la lesione precancerosa più comune nella nostra bocca. Si tratta di un ispessimento dello strato di cheratina dell’epitelio orale, qualcosa che normalmente non dovrebbe esserci.
Le cause non sono sempre chiarissime, ma spesso è legata a irritazioni croniche: fumo di tabacco, abuso di alcol, o persino masticare noci di betel in alcune culture. Sembra una cosa da poco, una macchietta bianca, ma il punto è che una percentuale non trascurabile di carcinomi orali a cellule squamose (OSCC) nasce proprio da qui.
Il problema? Nonostante sia così comune (si stima una prevalenza mondiale tra l’1.5% e il 2.6%), la displasia orale è ancora poco studiata. Diagnosticarla e trattarla efficacemente resta una sfida. La diagnosi si fa per esclusione (eliminando altre possibili cause di macchie bianche) e poi con una biopsia, dove i patologi cercano specifiche alterazioni cellulari e strutturali. Una volta diagnosticata, viene classificata in base alla gravità (lieve, moderata, severa secondo l’OMS, o a basso/alto rischio di trasformazione maligna secondo il sistema binario). Ma mancano biomarcatori specifici, quindi molto dipende dall’occhio esperto del patologo.
Trattamenti Attuali: Funzionano, Ma…
Cosa si fa oggi per la displasia orale? Le opzioni vanno dal “wait and see” (soprattutto per le forme lievi, che a volte regrediscono spontaneamente smettendo l’irritazione), a terapie farmacologiche conservative (derivati della vitamina A come i retinoidi), fino alla rimozione chirurgica.
Il “wait and see” però comporta il rischio che la lesione peggiori o diventi maligna. I farmaci hanno problemi di tossicità, efficacia limitata e alto tasso di recidive. La chirurgia, anche quella aggressiva per le forme severe, non è esente da rischi: le recidive possono arrivare fino al 35% e la trasformazione maligna fino al 18%! Insomma, c’è un disperato bisogno di capire meglio questa condizione e trovare terapie più efficaci per ridurre il rischio di recidiva e progressione verso il cancro.
L’Idea Rivoluzionaria: Sfruttare il Nostro Sistema Immunitario
Ed è qui che entra in gioco l’immunoterapia, una strategia che sta dando risultati incredibili in molti tipi di cancro, aiutando il sistema immunitario del paziente a riconoscere e attaccare le cellule tumorali. Da questo concetto nasce l’immunoprevenzione: stimolare le nostre difese immunitarie a colpire le cellule precancerose o i tumori in fase iniziale per bloccarne lo sviluppo.
La cosa interessante è che studi hanno mostrato come nelle displasie orali di grado elevato ci siano già più cellule immunitarie infiltranti (come i linfociti T CD8+ e CD4+) rispetto a quelle di basso grado. Questo suggerisce che terapie capaci di “risvegliare” ulteriormente queste cellule potrebbero avere effetti anti-tumorali proprio lì dove serve.
Un Interruttore per l’Immunità: I Recettori Toll-Like 9 (TLR9)
Il nostro sistema immunitario ha dei “sensori” chiamati Recettori Toll-Like (TLR) che riconoscono segnali di pericolo, come parti di patogeni (PAMPs) o molecole rilasciate da cellule danneggiate (DAMPs). Quando questi recettori, presenti su cellule sentinella come le cellule dendritiche, vengono attivati, scatenano la risposta immunitaria.
Uno di questi recettori, il TLR9, è particolarmente interessante per la lotta al cancro. Si trova principalmente nelle cellule dendritiche plasmacitoidi (pDC). Quando il TLR9 viene stimolato da un suo agonista (una molecola che lo attiva), le pDC si “accendono” e innescano una cascata di eventi: attivano le cellule Natural Killer (NK) e aumentano l’espansione dei linfociti T CD8+, i nostri “killer” specializzati contro le cellule anormali.
Gli agonisti del TLR9 sono spesso delle sequenze di DNA chiamate oligodeossinucleotidi CpG non metilati. In particolare, la classe CpG-A, come la sequenza G10 usata in alcuni studi, è molto efficace nell’attivare le pDC.
Vidutolimod: L’Agonista TLR9 “Corazzato”
C’è un piccolo intoppo: il G10 “nudo” è vulnerabile agli enzimi (DNasi) che lo degradano rapidamente nel corpo. La soluzione? Il vidutolimod. Immaginatelo come una capsula protettiva: è una particella simile a un virus (VLP) che racchiude il G10. Le VLP sono gusci proteici virali, ma senza materiale genetico virale, quindi non sono infettive. Questa struttura non solo protegge il G10 dalla degradazione, ma aiuta anche a consegnarlo efficacemente alle pDC e a stimolarle. È geniale, no?
Il vidutolimod ha già mostrato risultati promettenti in combinazione con un altro tipo di immunoterapia, il blocco dei checkpoint immunitari (ICB), contro il melanoma in studi clinici e contro il carcinoma a cellule squamose della testa e del collo in studi preclinici su modelli murini.
Perché Combinare Vidutolimod e Blocco dei Checkpoint (ICB)?
Spesso, l’efficacia di terapie come l’anti-PD1 (un tipo di ICB) da sole è limitata perché il microambiente del tumore o della lesione è “freddo”, cioè poco immunogenico, con poche cellule immunitarie attive. Il vidutolimod ha proprio la capacità di trasformare questo ambiente in uno “caldo”, infiammatorio, ricco di segnali di pericolo per il sistema immunitario. Questo potrebbe funzionare in sinergia con l’anti-PD1, che agisce togliendo i “freni” (come il checkpoint PD1/PDL1) che le cellule tumorali usano per sfuggire all’attacco immunitario.
È stato riportato che l’ICB (come l’anti-PD1) può indurre la regressione della displasia orale in pazienti con forme ad alto grado. Tuttavia, in uno studio clinico, solo il 36% dei pazienti ha mostrato una risposta significativa. L’idea è che aggiungendo vidutolimod, potremmo aumentare l’attività e il numero di cellule T CD8+ specifiche per la lesione, potenziando l’effetto dell’anti-PD1 e ottenendo risultati migliori.
Lo Studio: Mettiamo alla Prova la Combinazione!
Per testare questa ipotesi, abbiamo utilizzato un modello murino di displasia orale immunocompetente (cioè con un sistema immunitario funzionante, simile al nostro). Abbiamo indotto la displasia nei topi usando una sostanza cancerogena (4NQO) nell’acqua da bere per 16 settimane. Questo periodo è sufficiente per sviluppare lesioni che mimano la displasia umana di alto grado in circa il 50% degli animali.
Poi, abbiamo diviso i topi in gruppi e abbiamo iniziato i trattamenti, iniettando direttamente nelle lesioni sulla lingua:
- Soluzione salina (controllo)
- G10 da solo
- Vidutolimod da solo
- Anti-PD1 da solo (iniettato per via intraperitoneale)
- Vidutolimod + Anti-PD1 (la combinazione che ci interessava di più!)
Un dettaglio importante: due settimane prima di iniziare il trattamento intralesionale, tutti i topi hanno ricevuto un’iniezione sottocutanea di vidutolimod. Questo serve come “priming”, per indurre la produzione di anticorpi anti-Qβ (la proteina che forma il guscio VLP). Questi anticorpi aiutano poi le cellule presentanti l’antigene, come le pDC, a catturare più efficacemente il vidutolimod somministrato successivamente, potenziandone l’effetto. Abbiamo verificato con un test ELISA che i livelli di questi anticorpi aumentassero significativamente dopo il priming.
I Risultati: Cosa Abbiamo Scoperto?
Prima di tutto, abbiamo analizzato campioni di displasia orale umana. Usando una tecnica chiamata analisi biologica spaziale, abbiamo visto che, effettivamente, le lesioni ad alto rischio avevano un numero significativamente maggiore di cellule immunitarie (leucociti totali CD45+, linfociti T CD3+, CD4+, CD8+ e cellule dendritiche CD11c+) rispetto ai tessuti sani, soprattutto nel tessuto connettivo sotto l’epitelio. Anche i livelli di PD1 erano più alti nelle displasie gravi. Questo conferma che le lesioni ad alto rischio sono immunologicamente più “attive” e potenzialmente più sensibili all’immunoterapia.
Passando ai topi, i risultati sono stati davvero incoraggianti:
1. Effetti sulla Proliferazione Cellulare: Abbiamo analizzato le lesioni sulla lingua dei topi dopo i trattamenti, cercando un marcatore di proliferazione cellulare chiamato Ki-67. Ebbene, sia il trattamento con anti-PD1 da solo che, soprattutto, la combinazione vidutolimod + anti-PD1 hanno causato una riduzione significativa del numero di cellule epiteliali positive per Ki-67 rispetto ai topi di controllo. Questo suggerisce che questi trattamenti potrebbero rallentare la progressione della lesione. Curiosamente, non c’era una differenza significativa tra anti-PD1 da solo e la combinazione su questo specifico marcatore, mentre vidutolimod o G10 da soli non hanno avuto effetti significativi sulla proliferazione.
2. Attivazione Immunitaria Sistemica (Citochine nel Sangue): Abbiamo misurato i livelli di varie molecole segnale (citochine) nel siero dei topi 24 ore dopo la prima e la terza dose di trattamento. La combinazione vidutolimod + anti-PD1 ha causato un aumento significativo di citochine pro-infiammatorie e immunostimolanti come IFN-γ, TNF-α e IL-12 già dopo la prima dose! Queste citochine sono fondamentali per attivare e potenziare la risposta dei linfociti T CD8+. Il vidutolimod da solo ha aumentato significativamente IL-6 (un’altra citochina con ruoli complessi nell’infiammazione) e ha causato una riduzione sostenuta e significativa di TGF-β1, una citochina nota per le sue proprietà immunosoppressive. Ridurre TGF-β1 potrebbe creare un ambiente più favorevole all’attività immunitaria anti-tumorale.
3. Effetti sui Linfonodi Drenanti: Abbiamo analizzato le cellule immunitarie nei linfonodi mandibolari (quelli che drenano la lingua) alla fine del trattamento. La combinazione vidutolimod + anti-PD1 ha portato a un aumento significativo dei livelli di pDC (le cellule bersaglio primarie del vidutolimod) e anche di cellule dendritiche convenzionali (cDC). Entrambi i tipi di DC esprimono TLR9 nei topi. Inoltre, abbiamo visto un aumento significativo di linfociti T e B in proliferazione (Ki-67+) in tutti i gruppi trattati con vidutolimod o G10 (da soli o in combinazione) rispetto ai controlli. L’aumento delle popolazioni di DC suggerisce che questi trattamenti potenziano la capacità di presentare antigeni, fondamentale per attivare una risposta immunitaria specifica contro le cellule della lesione.
Cosa Significa Tutto Questo e Quali Sono i Prossimi Passi?
In sintesi, i nostri risultati suggeriscono che il trattamento locale con vidutolimod, specialmente in combinazione con l’anti-PD1, è in grado di “riscaldare” l’ambiente immunitario nella displasia orale. Aumenta le cellule chiave per l’attivazione immunitaria (pDC, cDC), stimola il rilascio di citochine pro-infiammatorie (IFN-γ, TNF-α, IL-12), incrementa la proliferazione dei linfociti T nei linfonodi e, cosa importante, sembra ridurre la proliferazione cellulare direttamente nella lesione pre-cancerosa.
Questo approccio combinato appare quindi molto promettente per gestire, e potenzialmente far regredire, le condizioni precancerose ad alto rischio come la displasia orale severa.
Certo, siamo ancora in una fase preclinica. Ci sono delle limitazioni: abbiamo osservato gli effetti a breve termine e la valutazione della progressione era basata su marcatori come Ki-67 e sull’istologia, che non sempre catturano cambiamenti funzionali immediati. Serviranno studi futuri per:
- Valutare la sicurezza a lungo termine della combinazione.
- Monitorare i topi per periodi più lunghi per vedere se le lesioni regrediscono effettivamente.
- Utilizzare marcatori di proliferazione più specifici (come BrdU).
- Definire meglio i meccanismi d’azione e ottimizzare dosaggi e tempistiche.
Ma la strada intrapresa sembra davvero eccitante! L’idea di poter intervenire con un’immunoterapia locale, potenziando le difese naturali del nostro corpo per bloccare lo sviluppo del cancro orale proprio nelle sue fasi iniziali, è qualcosa che dà grande speranza. Continueremo a lavorare in questa direzione, sperando un giorno di poter tradurre queste scoperte in terapie concrete per i pazienti.
Fonte: Springer