Cancro al Colon: IL-10 è Amico o Nemico? Sveliamo Nuovi Indizi e Speranze Terapeutiche!
Ciao a tutti, appassionati di scienza e curiosi! Oggi voglio portarvi con me in un viaggio affascinante nel complesso mondo del cancro al colon e del nostro sistema immunitario. Parleremo di una molecola intrigante, l’Interleuchina-10 (IL-10), e del suo ruolo, spesso ambiguo, in questa malattia. Tenetevi forte, perché le scoperte potrebbero aprire nuove strade per diagnosi e terapie!
Il Cancro al Colon e il Mistero dell’IL-10
Il cancro del colon-retto (CRC) è, purtroppo, uno dei “big killer” a livello mondiale. Sappiamo che tanti fattori contribuiscono al suo sviluppo, inclusa la posizione del tumore nel colon (quelli a destra, o RSC, sembrano avere una prognosi peggiore rispetto a quelli a sinistra, LSC) e, soprattutto, l’intricata danza tra le cellule tumorali e il nostro sistema immunitario.
Qui entra in gioco l’IL-10. È una citochina, una sorta di messaggero molecolare, che di solito ha un ruolo nel “calmare” le risposte immunitarie. Nel cancro, però, la sua funzione è un vero rompicapo. Alcuni studi suggeriscono che possa aiutare il tumore a sfuggire alle difese immunitarie, altri invece le attribuiscono effetti protettivi. Chi ha ragione? E la posizione del tumore c’entra qualcosa? Domande a cui abbiamo cercato di dare una risposta.
Cosa Abbiamo Fatto nel Nostro Studio?
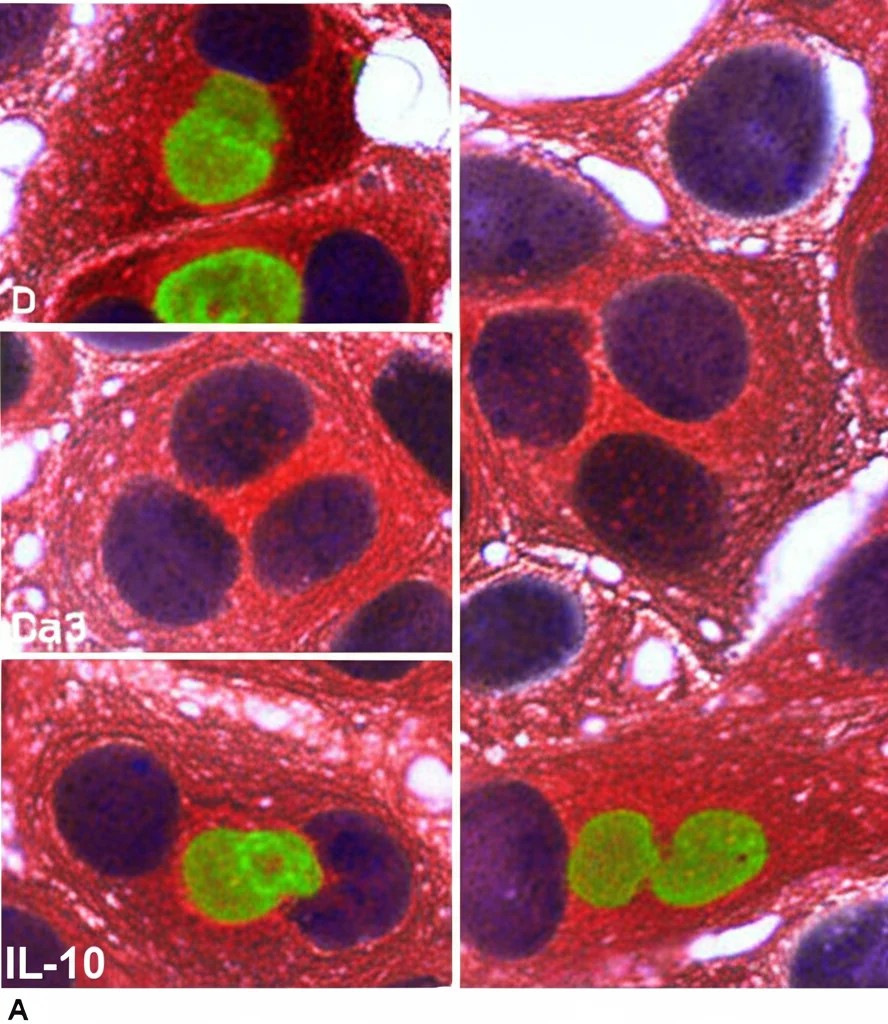
Per capirci qualcosa di più, abbiamo analizzato campioni di tessuto tumorale e tessuto sano prelevati dagli stessi pazienti con cancro al colon (ben 120!). Abbiamo usato una tecnica chiamata immunoistochimica per “vedere” e misurare la quantità di tre proteine chiave:
- L’IL-10 stessa.
- Il suo recettore principale sulla superficie delle cellule, l’IL-10Rα (la “serratura” a cui si lega l’IL-10).
- La molecola che trasmette il segnale all’interno della cellula una volta che l’IL-10 si è legata: STAT3.
Abbiamo poi suddiviso i dati in base allo stadio del cancro (precoce vs. avanzato) e alla sua localizzazione (destra vs. sinistra). Ma non ci siamo fermati qui! Siamo andati in laboratorio e abbiamo usato due linee cellulari di cancro al colon (HT29, da uno stadio più precoce, e SW620, da uno stadio avanzato) per vedere cosa succedeva quando le trattavamo direttamente con:
- IL-10 attiva.
- Un anticorpo che blocca il recettore IL-10Rα.
- Un inibitore specifico di STAT3.
Volevamo capire l’impatto diretto di questa via di segnalazione sulla crescita (ciclo cellulare) e sulla morte programmata (apoptosi) delle cellule tumorali.
Risultati Sorprendenti: IL-10 e Compagni Abbondano nel Tumore
La prima cosa che è saltata all’occhio è stata chiara: nei tessuti tumorali, l’espressione di IL-10, IL-10Rα e STAT3 era significativamente più alta rispetto ai tessuti sani degli stessi pazienti. Non solo: questa espressione aumentava progressivamente con l’avanzare dello stadio del cancro.
E la posizione? Conferma le nostre ipotesi: i tumori sul lato destro del colon (RSC), sia negli stadi precoci che avanzati, mostravano livelli nettamente superiori di queste tre proteine rispetto a quelli sul lato sinistro (LSC). I livelli più alti in assoluto li abbiamo trovati nei tumori RSC in stadio avanzato.
Ma c’è di più: livelli elevati di IL-10, IL-10Rα e STAT3 erano fortemente associati a caratteristiche prognostiche negative: tumori di alto grado, istologia mucinosa (un tipo più aggressivo), metastasi ai linfonodi e stadio avanzato della malattia. Insomma, sembra proprio che più queste molecole sono presenti, peggio stiano andando le cose. E c’era una forte correlazione tra i livelli delle tre proteine: dove c’era tanta IL-10, c’erano anche tanto IL-10Rα e STAT3 attivati. Un trio che sembra lavorare in concerto per favorire la progressione del tumore.
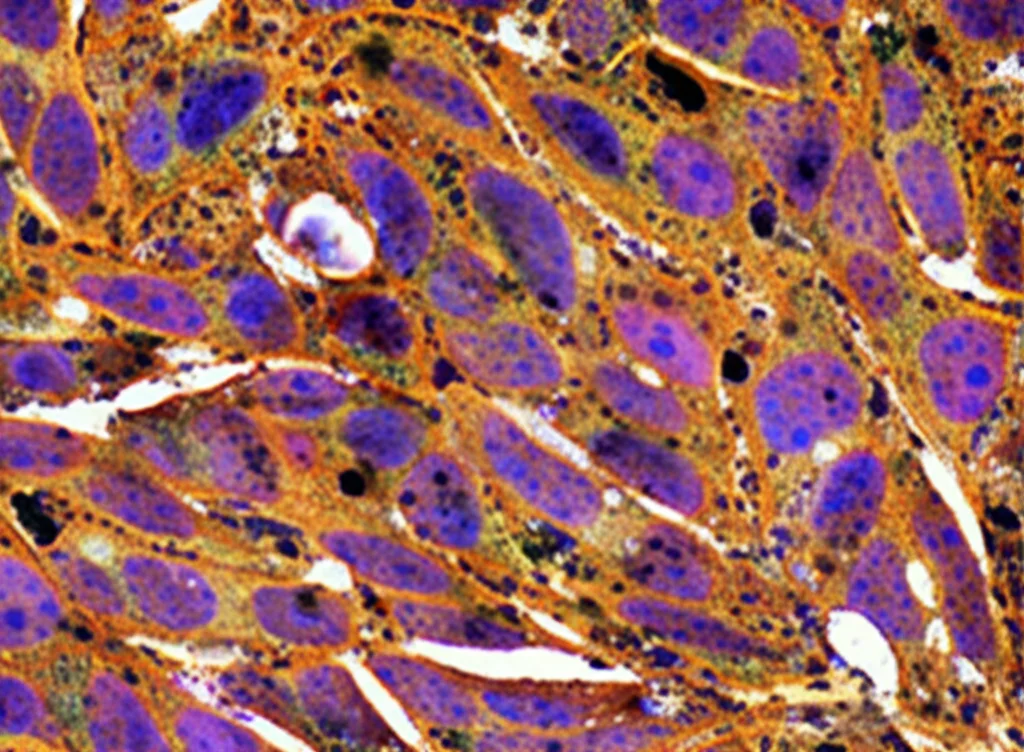
Esperimenti in Laboratorio: Bloccare il Segnale Fa Bene!
Passiamo ai test sulle cellule tumorali in coltura. Qui le cose si fanno ancora più interessanti. Trattare le cellule direttamente con IL-10 (a diverse concentrazioni) ha avuto effetti minimi, quasi nulli, sul loro ciclo vitale o sulla tendenza all’apoptosi. Sembra quasi che le cellule tumorali, già immerse in un ambiente ricco di IL-10 (come suggerito dai nostri dati sui tessuti), siano “assuefatte” o che l’IL-10 autoprodotta sia già sufficiente a saturare i recettori.
Ma la musica cambia radicalmente quando blocchiamo la via di segnalazione!
Quando abbiamo usato l’anticorpo anti-IL-10Rα (che impedisce all’IL-10 di legarsi alla sua “serratura”) o l’inibitore di STAT3 (che blocca il messaggero interno), abbiamo osservato effetti potenti:
- Arresto del ciclo cellulare: Le cellule smettevano di proliferare e si bloccavano in specifiche fasi del loro ciclo di crescita (fase S per HT29, fase G0/G1 per SW620). Questo era accompagnato da una diminuzione delle proteine che spingono la crescita (CCND1, CCND3) e un aumento di quelle che la frenano (p21, p27).
- Induzione dell’apoptosi: Le cellule tumorali iniziavano ad andare incontro a morte programmata. Abbiamo visto un calo dei marcatori di sopravvivenza (PCNA, survivina) e un aumento deciso della Caspasi-3, una proteina chiave nell’esecuzione dell’apoptosi.
L’effetto era dose-dipendente per l’anticorpo anti-IL-10Rα e particolarmente marcato con l’inibitore di STAT3. Questo suggerisce fortemente che la via di segnalazione IL-10 -> IL-10Rα -> STAT3 giochi un ruolo attivo nel sostenere la sopravvivenza e la proliferazione delle cellule di cancro al colon. Bloccarla sembra essere una strategia promettente per contrastarle.
Un Quadro Complesso: Il Doppio Volto dell’IL-10
Quindi, i nostri dati puntano verso un ruolo pro-tumorale dell’IL-10 e della sua via di segnalazione nel cancro al colon, specialmente nei tumori del lato destro e negli stadi avanzati. Questo la rende un potenziale marcatore prognostico (più ce n’è, peggio è) e un interessante bersaglio terapeutico.
Tuttavia, non possiamo ignorare gli studi che riportano risultati opposti, suggerendo effetti antitumorali, specialmente con trattamenti a base di IL-10 ricombinante (PEG-IL-10) che sembrano risvegliare la risposta immunitaria anti-cancro. Com’è possibile?
Una spiegazione potrebbe risiedere nell’estrema eterogeneità del cancro al colon. Esistono diversi “sottotipi molecolari” (i famosi CMS – Consensus Molecular Subtypes). Alcuni (come il CMS1, più comune a destra) sono ricchi di cellule immunitarie “buone” e rispondono meglio all’immunoterapia, mentre altri (come il CMS4, più comune a sinistra) sono “freddi”, con un microambiente che sopprime l’immunità e una prognosi peggiore. È possibile che l’IL-10 giochi ruoli diversi a seconda del contesto molecolare e immunitario specifico del tumore. Potrebbe essere “cattiva” in un sottotipo (magari il CMS4, aiutando a sopprimere l’immunità) e potenzialmente “buona” o irrilevante in un altro (magari nel CMS1, dove altri fattori immunitari dominano).
Cosa Ci Riserva il Futuro?
Il nostro studio aggiunge un tassello importante, ma la storia dell’IL-10 nel cancro al colon è ancora tutta da scrivere. Abbiamo dimostrato un chiaro legame tra alti livelli di IL-10/IL-10Rα/STAT3 e la progressione della malattia, soprattutto nei tumori del lato destro, e che bloccare questa via in laboratorio ha effetti antitumorali diretti sulle cellule cancerose.
Certo, ci sono limiti: abbiamo analizzato campioni archiviati da un solo centro, non avevamo dati sulla sopravvivenza a lungo termine e abbiamo usato solo due linee cellulari. Serviranno studi più ampi, multicentrici, che analizzino anche l’espressione genica, correlino i dati con i sottotipi CMS e il tipo di infiltrato immunitario nel tumore, e utilizzino modelli più complessi (come le co-colture di cellule tumorali e immunitarie o organoidi derivati dai pazienti).
La strada è ancora lunga, ma la possibilità di usare l’IL-10 come biomarcatore o di sviluppare terapie mirate contro la sua via di segnalazione è concreta e affascinante. Continueremo a indagare per svelare tutti i segreti di questa molecola a doppio taglio!
Fonte: Springer