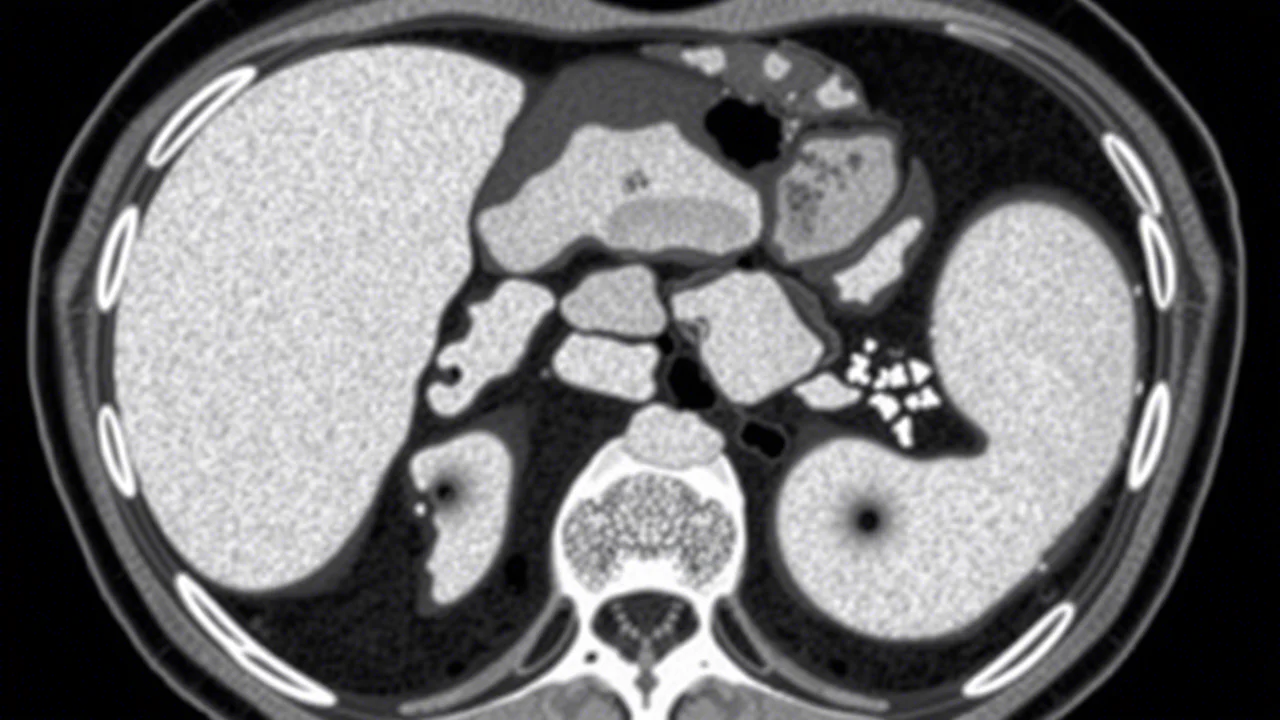
IKPLAS: Viaggio nel Cuore di un’Infezione Invasiva da Klebsiella Pneumoniae
Ciao a tutti, appassionati di scienza e misteri del corpo umano! Oggi voglio portarvi con me in un’esplorazione affascinante, anche se un po’ inquietante, nel mondo della microbiologia e delle malattie infettive. Parleremo di un nemico subdolo che sta emergendo a livello globale: la sindrome invasiva da ascesso epatico da Klebsiella pneumoniae, che per comodità chiameremo IKPLAS (dall’inglese Invasive Klebsiella pneumoniae Liver Abscess Syndrome).
Forse avete sentito parlare della Klebsiella pneumoniae, un batterio che di solito se ne sta buono buono nel nostro intestino, ma che a volte decide di fare il cattivo, causando infezioni anche gravi. Una di queste è l’ascesso epatico, una raccolta di pus nel fegato. Ma la storia si complica quando questo batterio, particolarmente “aggressivo” (ipervirulento, dicono gli esperti), non si accontenta del fegato e decide di andare in gita in altre parti del corpo. Ed ecco che nasce l’IKPLAS.
Ma cos’è esattamente l’IKPLAS?
Immaginatevi un ascesso epatico causato dalla Klebsiella pneumoniae (KPLA) che però, invece di rimanere localizzato, dà origine a infezioni metastatiche, cioè a distanza. È come se il batterio prendesse un “biglietto” attraverso il sangue e andasse a colonizzare altri organi. Quali? I più comuni sono:
- L’occhio (causando una brutta infezione chiamata endoftalmite, che può portare a cecità)
- I polmoni (con ascessi polmonari o embolie settiche)
- Il sistema nervoso centrale (meningiti, ascessi cerebrali)
- Ma anche ossa (spondilite piogenica), reni, milza, muscoli (ascesso dello psoas) e tessuti molli.
Questa sindrome ha spesso un esordio acuto, progredisce rapidamente e la prognosi, purtroppo, non è sempre delle migliori. Può causare disabilità permanenti e devastanti. Capite perché è importante parlarne e aumentare la consapevolezza?
Lo studio che fa luce sull’IKPLAS
Recentemente mi sono imbattuto in uno studio molto interessante, condotto presso l’Ospedale Tongji in Cina e pubblicato su una rivista scientifica (trovate il link alla fine!). I ricercatori hanno analizzato retrospettivamente i dati di 208 pazienti con ascesso epatico da Klebsiella pneumoniae (KPLA) tra il 2015 e il 2023. Di questi, 41 avevano sviluppato la forma invasiva, l’IKPLAS, mentre 167 avevano la forma non invasiva (NIKPLAS). L’obiettivo? Capire le differenze cliniche e microbiologiche tra i due gruppi, per poter riconoscere precocemente l’IKPLAS e scegliere la terapia antibiotica più adatta fin da subito.
Identikit del paziente a rischio IKPLAS
Cosa hanno scoperto i ricercatori? Quali sono i campanelli d’allarme che dovrebbero farci sospettare un’IKPLAS? L’analisi statistica (una cosa chiamata regressione logistica multivariata, per i più tecnici) ha individuato due fattori di rischio principali e statisticamente significativi:
- Sintomi in altri distretti corporei: Se un paziente con KPLA inizia a manifestare sintomi strani agli occhi (calo della vista, dolore), ai polmoni (tosse, difficoltà respiratorie) o a livello neurologico (mal di testa intenso, confusione, rigidità nucale), bisogna drizzare le antenne! Nello studio, l’85.4% dei pazienti con IKPLAS presentava questi sintomi “extra-epatici”, contro solo il 22.8% del gruppo NIKPLAS. Questo è un segnale fortissimo!
- Punteggio SOFA elevato: Il SOFA score (Sequential Organ Failure Assessment) è un punteggio che medici e infermieri usano per valutare la gravità della disfunzione d’organo, spesso in terapia intensiva. Un punteggio SOFA ≥ 4 nelle prime 48 ore dal ricovero è risultato essere un altro importante predittore di IKPLAS. Questo suggerisce che i pazienti che sviluppano IKPLAS tendono ad avere un quadro clinico generale più compromesso fin dall’inizio.
Un altro dato interessante riguarda il diabete mellito. Circa la metà dei pazienti con KPLA nello studio era diabetica, e la percentuale era ancora più alta nel gruppo IKPLAS (68.7% vs 46.1%). Anche se nell’analisi multivariata il diabete non è emerso come fattore di rischio *indipendente* (forse per via del numero limitato di pazienti IKPLAS nello studio), è noto da altre ricerche che il diabete, specialmente se mal controllato, può favorire lo sviluppo di questa sindrome invasiva. Sembra che l’iperglicemia possa sia compromettere la capacità dei nostri globuli bianchi di combattere certi ceppi di Klebsiella, sia rendere i batteri stessi più “cattivi”. Quindi, occhio alla glicemia nei pazienti con KPLA!

Le conseguenze dell’invasione: complicanze e prognosi
Purtroppo, come accennato, l’IKPLAS non è uno scherzo. Lo studio conferma che i pazienti con questa sindrome hanno un rischio significativamente maggiore di sviluppare complicanze gravi come la disfunzione multiorgano (MODS). Un valore elevato di procalcitonina (PCT ≥ 10 ng/mL), un marcatore di infiammazione batterica, è stato identificato come fattore di rischio indipendente per la MODS in questi pazienti.
Chi sviluppa IKPLAS ha anche maggiori probabilità di finire in terapia intensiva (ICU), di rimanerci più a lungo e, in generale, di avere una degenza ospedaliera più lunga rispetto a chi ha solo l’ascesso epatico localizzato. E le conseguenze a lungo termine? Nello studio, quasi la metà dei pazienti con IKPLAS (48.8%) non ha raggiunto il successo terapeutico completo, spesso a causa di disabilità permanenti causate dalle infezioni metastatiche. Pensate che tutti i 16 pazienti con endoftalmite hanno subito una perdita significativa della vista, e un paziente con ascesso cerebrale ha sviluppato un’emiplegia. Dati che fanno riflettere sulla gravità della situazione.
E il batterio? È diverso nei casi di IKPLAS?
Qui arriva una delle scoperte forse più sorprendenti dello studio. Ci si potrebbe aspettare che i batteri responsabili dell’IKPLAS siano particolarmente resistenti agli antibiotici. E invece no! Almeno in questo gruppo di pazienti, non sono state trovate differenze significative nelle caratteristiche microbiologiche, inclusa la sensibilità agli antibiotici, tra i ceppi di Klebsiella pneumoniae isolati dai pazienti con IKPLAS e quelli del gruppo NIKPLAS.
Anzi, la maggior parte dei ceppi isolati nello studio era sensibile a quasi tutti gli antibiotici testati (cefalosporine, chinoloni, carbapenemi, aminoglicosidi…). I tassi di resistenza erano bassi: solo 5 ceppi resistenti ai carbapenemi (CR, 2.6%) e 7 ceppi multiresistenti (MDR, 3.6%) sono stati rilevati in totale, e curiosamente… tutti provenivano dal gruppo NIKPLAS (quello senza infezioni metastatiche)!
Questo non significa che la resistenza agli antibiotici non sia un problema globale per la Klebsiella, anzi! Ma in *questo specifico contesto* (ascessi epatici in quell’ospedale e in quel periodo), i ceppi responsabili, anche quelli invasivi, sembravano essere ancora abbastanza sensibili. Un’eccezione? La tigeciclina, un antibiotico considerato “di riserva”, ha mostrato una sensibilità relativamente bassa (solo il 62% dei ceppi era sensibile).
Questo dato sulla sensibilità è fondamentale. Perché? Perché suggerisce che, almeno in questa popolazione, una terapia antibiotica empirica (cioè iniziata prima di avere i risultati dell’antibiogramma) basata su farmaci comuni come le combinazioni beta-lattamico/inibitore della beta-lattamasi o i carbapenemi (che infatti sono stati usati spesso nello studio, soprattutto nei casi IKPLAS) potrebbe essere efficace. Tuttavia, i ricercatori sottolineano giustamente l’importanza dell’antimicrobial stewardship, cioè l’uso oculato degli antibiotici, per evitare di selezionare ceppi resistenti in futuro. Non bisogna “sprecare” gli antibiotici più potenti se non sono strettamente necessari.
Trattamento: non solo antibiotici
Oltre alla terapia antibiotica sistemica, un altro pilastro del trattamento dell’ascesso epatico è il drenaggio della raccolta di pus, solitamente per via percutanea (con un ago o un piccolo catetere). Nello studio, il drenaggio è stato eseguito nella maggior parte dei pazienti, anche se meno frequentemente nel gruppo IKPLAS. Curiosamente, nei pazienti IKPLAS, il drenaggio non sembrava essere associato a un miglior esito terapeutico, nemmeno per gli ascessi più grandi. Questo potrebbe suggerire che nelle forme invasive, la battaglia si combatte più a livello sistemico con gli antibiotici che localmente con il drenaggio, ma sono necessarie ulteriori conferme.
Per l’endoftalmite, la complicanza oculare, oltre agli antibiotici (spesso iniettati direttamente nell’occhio), a volte si ricorre alla vitrectomia, un intervento chirurgico per rimuovere il materiale infetto dall’interno dell’occhio. Nello studio, 13 occhi su 18 affetti sono stati sottoposti a vitrectomia, con risultati visivi variabili. È una decisione complessa, ma può essere considerata se la terapia antibiotica non funziona rapidamente.

Cosa ci portiamo a casa?
Questo studio, pur con i suoi limiti (è retrospettivo, condotto in un solo centro e con un numero non enorme di pazienti IKPLAS), ci offre spunti preziosi:
- L’IKPLAS è una realtà clinica grave che richiede alta sospettosità.
- La comparsa di sintomi extra-epatici (oculari, polmonari, neurologici) in un paziente con ascesso epatico da Klebsiella è un forte segnale di allarme.
- Un punteggio SOFA ≥ 4 precocemente indica una maggiore gravità e rischio di IKPLAS.
- L’IKPLAS è associato a un maggior rischio di MODS, ricovero in ICU, degenze più lunghe e esiti sfavorevoli, incluse disabilità permanenti.
- In questo studio specifico, la resistenza agli antibiotici non sembrava essere il fattore discriminante tra KPLA e IKPLAS, e i ceppi erano generalmente sensibili a molti farmaci comuni. Questo dato è utile per guidare la terapia empirica *in contesti simili*, ma va sempre monitorata la situazione locale delle resistenze.
- La diagnosi precoce e un approccio multidisciplinare (infettivologi, chirurghi, radiologi, oculisti, neurologi…) sono fondamentali per tentare di migliorare la prognosi di questi pazienti.
Insomma, l’IKPLAS ci ricorda quanto possa essere complesso e imprevedibile il comportamento dei microbi e quanto sia importante la ricerca continua per capire meglio queste condizioni, identificarle presto e trattarle nel modo più efficace possibile, usando con saggezza le armi potentissime, ma delicate, che sono gli antibiotici.
Spero che questo viaggio nel mondo dell’IKPLAS vi sia stato utile e interessante. Continuate a seguirci per altre scoperte scientifiche!
Fonte: Springer







