Cheloidi Addio? Come l’Interferone Gamma Scatena la ‘Morte di Ferro’ nelle Cellule Cicatriziali
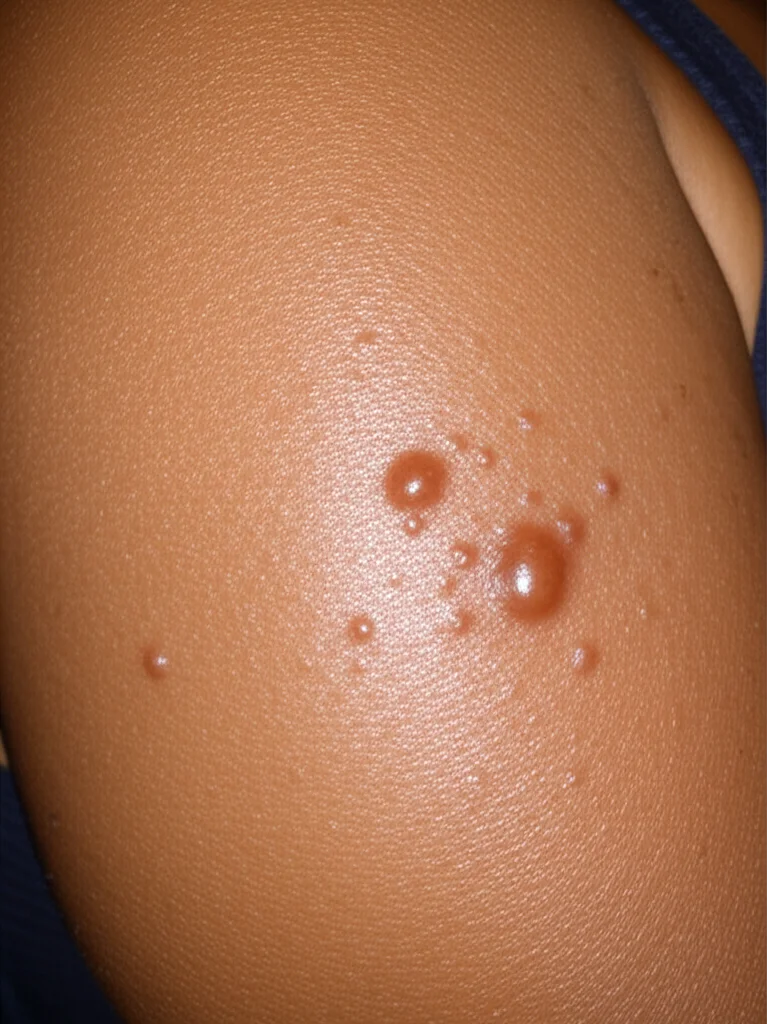
Ciao a tutti! Oggi voglio parlarvi di qualcosa che affligge molte persone, specialmente chi ha la pelle più scura: i cheloidi. Sapete, quelle cicatrici esuberanti, in rilievo, che si formano dopo un trauma o un’infiammazione? Non sono solo un problema estetico, possono causare prurito, dolore e persino limitare i movimenti se si trovano vicino alle articolazioni. Un bel fastidio, insomma, che impatta sulla qualità della vita.
Le terapie attuali? Beh, diciamo che hanno i loro limiti. Fogli di silicone, compressione, radioterapia, chirurgia… ognuna ha pro e contro, ma spesso l’efficacia è bassa, possono esserci effetti collaterali come l’iperpigmentazione e, soprattutto, il tasso di recidiva dopo la chirurgia è altissimo, parliamo del 45-100%! C’è bisogno di qualcosa di più, non trovate?
Una Molecola Promettente: l’Interferone Gamma (IFN-γ)
Qui entra in gioco una molecola di cui forse avete sentito parlare in altri contesti: l’Interferone Gamma (IFN-γ). È una citochina, una specie di messaggero del nostro sistema immunitario, con effetti antivirali, antiproliferativi e immunomodulatori. La cosa interessante è che l’IFN-γ ha mostrato effetti terapeutici significativi sui cheloidi, tanto da essere inserito nelle linee guida internazionali per la gestione delle cicatrici già nel lontano 2002!
Come agisce? Sembra che riduca la produzione di collagene (il “mattone” principale dei cheloidi), contrasti alcune molecole infiammatorie e inibisca la proliferazione delle cellule responsabili della cicatrice, i cosiddetti fibroblasti cheloidi (KF). Funziona bene anche in combinazione con altri trattamenti. Ma c’è sempre un “ma”: capiamo fino in fondo come fa tutto questo? La ricerca non si ferma mai, ed è proprio qui che le cose si fanno affascinanti.
La Scoperta Recente: IFN-γ e la Ferroptosi
Recentemente, è emerso un legame intrigante tra l’IFN-γ e un tipo particolare di morte cellulare programmata chiamata ferroptosi. Non è la solita apoptosi (il “suicidio cellulare” più conosciuto). La ferroptosi è scatenata da un eccesso di ferro, un aumento di specie reattive dell’ossigeno (ROS – i famosi radicali liberi) e uno squilibrio di alcuni grassi. Si è visto che modulare la ferroptosi può essere utile in diverse condizioni, da malattie fibrotiche a tumori resistenti ai farmaci.
Alcuni studi hanno mostrato che l’IFN-γ può indurre ferroptosi nelle cellule tumorali. E nei cheloidi? Sappiamo che nei tessuti cheloidi ci sono più cellule immunitarie (linfociti T CD8+) che producono IFN-γ rispetto alla pelle sana. Quindi, la domanda sorge spontanea: l’IFN-γ potrebbe combattere i cheloidi inducendo proprio la ferroptosi nei fibroblasti cheloidi? Fino ad ora, nessuno lo sapeva con certezza.
Svelare il Meccanismo: Entra in Scena Serpine2
Ed è qui che arriva il bello della ricerca che vi racconto oggi! Abbiamo voluto indagare proprio questo legame. I risultati? Sorprendenti! Abbiamo dimostrato che c’è una relazione causale diretta: l’IFN-γ induce effettivamente la ferroptosi nei fibroblasti cheloidi (KF).
Ma come? Per capirlo, abbiamo analizzato a tappeto cosa cambiava nelle cellule a livello di RNA e proteine dopo aver aumentato l’IFN-γ. E un gene è saltato subito all’occhio perché la sua espressione veniva drasticamente ridotta: serpine2.
Cos’è serpine2? Appartiene a una famiglia di inibitori di proteasi (enzimi che tagliano proteine) ed è già noto per avere un ruolo in altre malattie fibrotiche. La nostra ipotesi è stata quindi: e se serpine2 fosse il “bersaglio” a valle attraverso cui l’IFN-γ regola la ferroptosi nei KF?
Abbiamo fatto altri esperimenti e abbiamo visto che, al contrario dell’IFN-γ, aumentare serpine2 nei KF ne promuoveva la proliferazione, la migrazione e l’invasività, oltre ad aumentare la sintesi di collagene. Insomma, serpine2 sembra proprio “aiutare” il cheloide a crescere.
Serpine2: Il Freno della Ferroptosi
Ma il punto cruciale è il suo legame con la ferroptosi. Abbiamo scoperto che aumentare serpine2 faceva l’opposto dell’IFN-γ:
- Promuoveva l’espressione del sistema Xc-, un trasportatore fondamentale sulla membrana cellulare (composto dalle subunità SLC7A11 e SLC3A2).
- Questo trasportatore permette alla cellula di “importare” cistina, un amminoacido essenziale per produrre glutatione (GSH).
- Il GSH è un potentissimo antiossidante che, tramite l’enzima GPX4, neutralizza i perossidi lipidici, molecole dannose che innescano la ferroptosi.
- Di conseguenza, con più serpine2, c’era meno accumulo di ROS, meno perossidazione lipidica (e meno del suo prodotto, la malondialdeide o MDA) e, in definitiva, meno ferroptosi.
In pratica, serpine2 agisce come un freno per la ferroptosi nei fibroblasti cheloidi.
IFN-γ: Togliere il Freno per Indurre la Morte Cellulare
E l’IFN-γ? Fa esattamente il contrario! Inibendo l’espressione di serpine2, l’IFN-γ “toglie il freno”. Questo porta a una ridotta espressione del sistema Xc- (meno SLC7A11 e SLC3A2), meno importazione di cistina, meno sintesi di GSH, ridotta attività di GPX4, accumulo di ROS e perossidi lipidici… e voilà, la cellula va incontro a ferroptosi!
Abbiamo confermato tutto questo anche in modelli animali in vivo, utilizzando campioni di cheloidi umani impiantati in topi speciali. I risultati combaciavano perfettamente con quelli ottenuti in laboratorio sulle cellule.
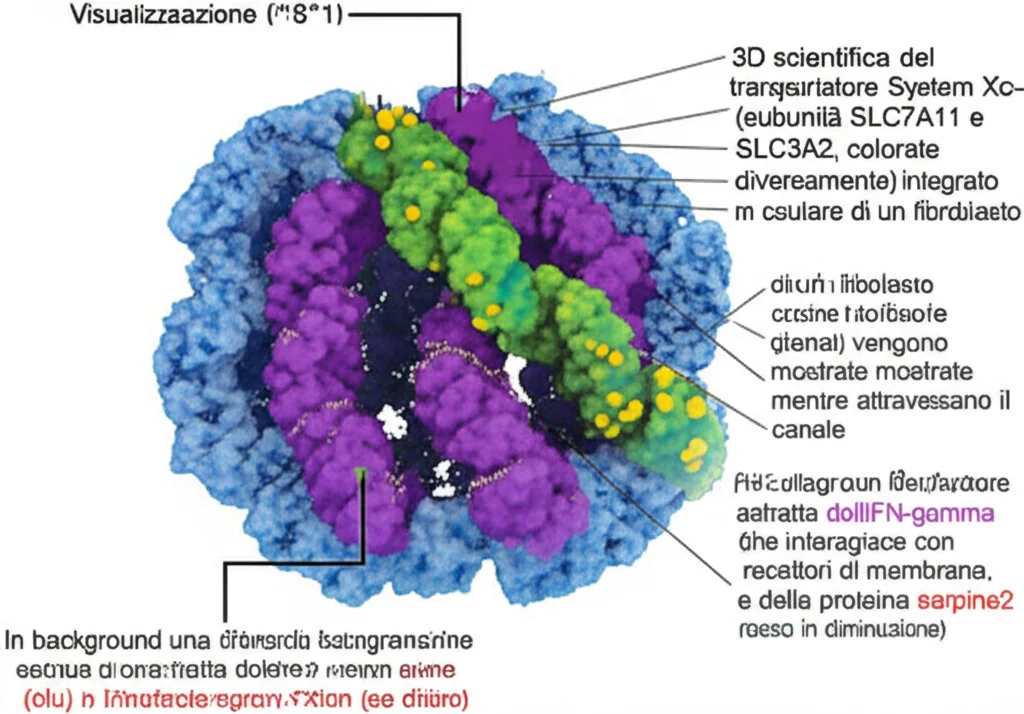
Quindi, l’IFN-γ non solo induce direttamente la ferroptosi nei KF, ma li rende anche più sensibili a questo tipo di morte cellulare proprio perché “spegne” il gene serpine2, bloccando così la catena di eventi protettivi legata al sistema Xc- e al GSH.
Implicazioni Terapeutiche: Una Nuova Strada Contro i Cheloidi?
Cosa significa tutto questo in soldoni? Che abbiamo identificato un meccanismo d’azione chiave dell’IFN-γ nel trattamento dei cheloidi e, cosa ancora più importante, abbiamo individuato un potenziale nuovo bersaglio terapeutico: l’asse serpine2-sistema Xc-.
Immaginate di poter sviluppare farmaci che mimino l’effetto dell’IFN-γ inibendo specificamente serpine2 o bloccando il sistema Xc- nei fibroblasti cheloidi. Potrebbe essere una strategia mirata per indurre la morte di queste cellule “ribelli” e ridurre o prevenire la formazione dei cheloidi, magari con meno effetti collaterali rispetto alle terapie attuali.
Certo, la strada è ancora lunga. Questi studi sono stati fatti su cellule primarie e modelli animali che, per quanto affidabili, non replicano perfettamente la complessità del cheloide umano. Serviranno ulteriori ricerche per sviluppare modelli più accurati e per esplorare terapie mirate (magari usando tecnologie avanzate come siRNA incapsulati in nanovettori per “silenziare” il gene serpine2).
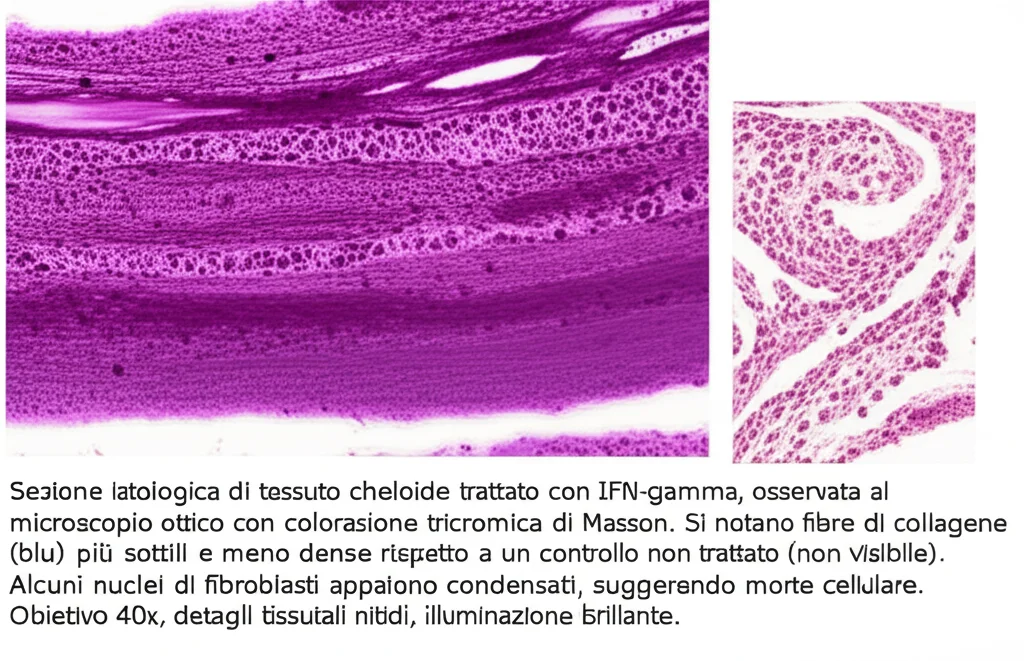
Ma la scoperta è entusiasmante! Aver capito che l’IFN-γ agisce (anche) inducendo ferroptosi tramite l’inibizione di serpine2 apre scenari davvero promettenti per la lotta contro queste fastidiose e talvolta invalidanti cicatrici. L’asse serpine2-sistema Xc- potrebbe davvero rappresentare la chiave per nuove terapie più efficaci. Staremo a vedere cosa ci riserverà il futuro della ricerca!
Fonte: Springer