Idrogel 3D Stampato con Esosomi: La Mia Scommessa per Riparare il Cervello Dopo un’Emorragia
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel mondo della ricerca, un campo dove stiamo cercando soluzioni innovative per problemi medici davvero complessi. Parleremo di emorragia intracerebrale (ICH), un evento devastante che purtroppo colpisce molte persone, lasciando spesso conseguenze pesanti come disabilità permanenti. Immaginate un’improvvisa “rottura” nei vasi sanguigni del cervello: il danno iniziale è causato dall’accumulo di sangue (l’ematoma), ma gran parte del problema viene dopo, con quella che chiamiamo “lesione secondaria”. È una cascata di eventi negativi: infiammazione (neuroinfiammazione), stress ossidativo, rottura della barriera che protegge il cervello… un vero disastro che porta alla morte dei neuroni e alla perdita di funzioni.
Nonostante i progressi, le terapie attuali non sono ancora sufficienti. Ed è qui che entriamo in gioco noi ricercatori, sempre alla ricerca di nuove strade. Una delle più promettenti negli ultimi anni riguarda le cellule staminali mesenchimali (MSC) e, ancora più nello specifico, delle minuscole vescicole che queste cellule rilasciano: gli esosomi. Pensate agli esosomi come a dei “messaggeri” super efficienti, grandi solo 30-150 nanometri, che trasportano molecole bioattive (proteine, microRNA) capaci di comunicare con altre cellule. Quelli derivati dalle cellule staminali del cordone ombelicale umano (li chiameremo hUCMSC-exos) si sono dimostrati particolarmente bravi a proteggere i neuroni, ridurre l’infiammazione e l’apoptosi (la morte cellulare programmata) nei modelli di ICH. Sembra fantastico, no?
La Sfida: Come Far Arrivare gli Esosomi Dove Servono?
C’è un “ma”, ovviamente. Questi preziosi esosomi, una volta iniettati liberamente, hanno vita breve nel corpo, vengono eliminati rapidamente (meno di 6 ore!) e degradati dagli enzimi. Immaginate di dover fare iniezioni intracraniche ripetute… non è proprio praticabile né sicuro. Inoltre, i “veicoli” tradizionali usati per trasportare farmaci (liposomi, polimeri sintetici) spesso non sono perfetti: possono essere tossici, poco biocompatibili o degradarsi troppo in fretta o troppo lentamente rispetto ai tempi di riparazione del tessuto nervoso.
Allora ci siamo chiesti: come possiamo proteggere questi esosomi e farli rilasciare gradualmente proprio lì dove c’è il danno, nel cervello? La risposta che abbiamo esplorato è arrivata dalla combinazione di due tecnologie super interessanti: i biomateriali derivati dalla matrice extracellulare decellularizzata (dECM) e la stampa 3D biologica.
La Nostra Soluzione: dECM@exo, lo Scaffold Intelligente
L’idea è stata quella di creare un’impalcatura (uno “scaffold”) tridimensionale che potesse fare da “casa” e da sistema di rilascio per i nostri hUCMSC-exos. Per farlo, abbiamo usato un mix speciale:
- dECM cerebrale: Abbiamo preso del tessuto cerebrale di ratto e, con un processo chiamato decellularizzazione, abbiamo rimosso tutte le cellule, lasciando intatta la matrice extracellulare. Questa matrice è fantastica perché conserva segnali biochimici specifici del tessuto cerebrale, aiutando la rigenerazione, ma senza causare rigetto immunitario.
- Gelatina metacriloile (GelMA) e Fibroina della Seta (SF): Questi sono idrogel fotoreticolabili, cioè diventano solidi quando esposti alla luce. Ci permettono di creare una struttura con proprietà meccaniche simili a quelle del cervello (molto morbido!) e di controllare il rilascio nel tempo.
- hUCMSC-exos: I nostri preziosi messaggeri terapeutici.
Abbiamo mescolato tutto questo per creare un “bio-inchiostro” e poi, usando una stampante 3D biologica, abbiamo letteralmente stampato dei piccoli scaffold cubici (2x2x1 mm) caricati con gli esosomi. Abbiamo chiamato questa meraviglia dECM@exo.
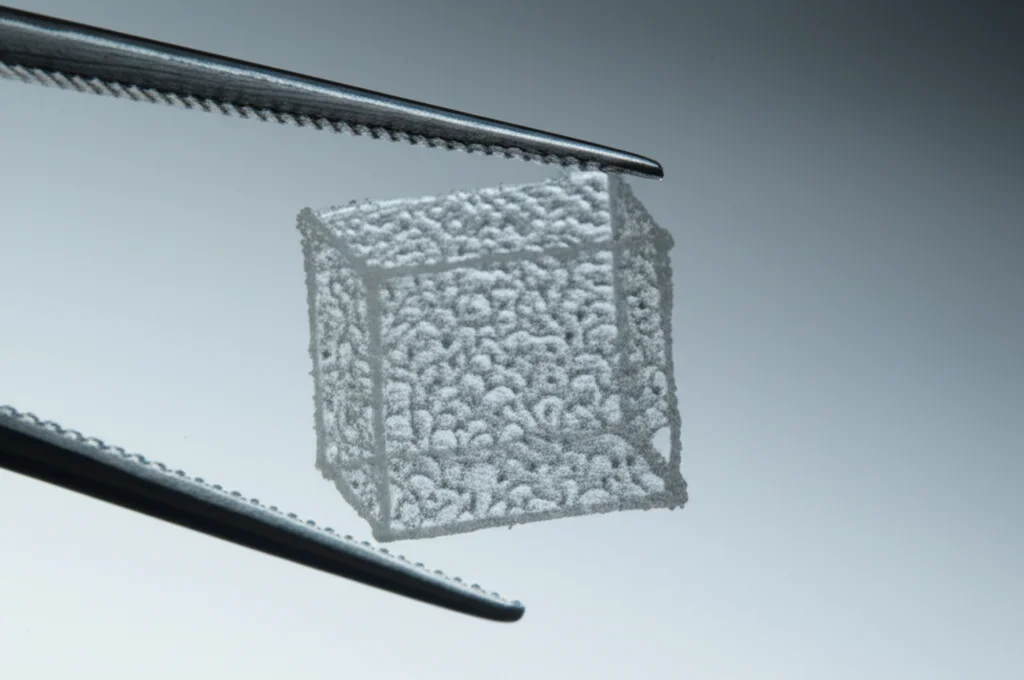
Cosa Abbiamo Scoperto: Funziona Davvero!
Una volta creato il nostro dECM@exo, dovevamo capire se funzionasse come speravamo.
Prima di tutto, abbiamo verificato in vitro (cioè in laboratorio, fuori da un organismo vivente):
- Rilascio Sostenuto: Abbiamo visto che lo scaffold rilasciava gli hUCMSC-exos gradualmente per almeno 14 giorni (addirittura fino a 28 giorni nei test di laboratorio!). Questo è fondamentale per un effetto terapeutico prolungato.
- Biocompatibilità: Le cellule (astrociti, cellule importanti del cervello) messe a contatto o addirittura incapsulate nello scaffold sopravvivevano benissimo, anzi, sembravano proliferare meglio nel dECM@exo. Gli esosomi venivano internalizzati dagli astrociti, segno che il messaggio arrivava a destinazione.
- Effetto Anti-infiammatorio e Anti-apoptotico: Abbiamo simulato le condizioni di ICH in coltura usando Emina (una componente del sangue) per stressare gli astrociti. Bene, il trattamento con dECM@exo ha ridotto significativamente il rilascio di molecole infiammatorie (come TNF-α e IL-1β) e aumentato quelle anti-infiammatorie (IL-10). Ha anche protetto le cellule dall’apoptosi (morte cellulare).
Poi siamo passati al test in vivo, usando un modello di ratto con ICH indotta. Abbiamo impiantato stereotassicamente (cioè con precisione millimetrica) il nostro scaffold dECM@exo vicino all’area danneggiata. I risultati sono stati davvero incoraggianti:
- Miglioramento Neurologico: I ratti trattati con dECM@exo hanno mostrato un recupero significativamente migliore nelle funzioni motorie e neurologiche (valutate con test specifici come il forelimb placement test, il corner turn test e le scale di Bederson e Longa) già dopo 24 ore e con miglioramenti costanti fino a 14 giorni.
- Riduzione del Danno Cerebrale: L’analisi dei tessuti cerebrali ha mostrato meno edema (gonfiore), meno danno alla barriera emato-encefalica (meno stravaso di colorante Evans blue), meno morte cellulare (colorazione TUNEL e Nissl) e una migliore preservazione delle strutture cellulari (come i mitocondri, visti al microscopio elettronico) nei ratti trattati con dECM@exo rispetto ai controlli (ICH senza trattamento o con scaffold senza esosomi).
- Controllo dell’Infiammazione: Anche nel modello animale, abbiamo visto una riduzione dei marcatori infiammatori (TNF-α, IL-1β) e un aumento di quelli anti-infiammatori (IL-10) nel siero dei ratti trattati. Inoltre, abbiamo osservato una minore attivazione della via infiammatoria TLR4/NF-κB.

Il Meccanismo: Come Agisce dECM@exo?
Sembra che il nostro scaffold agisca su più fronti. Da un lato, fornisce un ambiente fisico e biochimico favorevole alla sopravvivenza e alla rigenerazione cellulare grazie alla matrice dECM. Dall’altro, il rilascio prolungato di hUCMSC-exos fa il lavoro “sporco”: modula l’infiammazione agendo sulla via di segnalazione TLR4/NF-κB. Abbiamo visto che dECM@exo riduce l’espressione di TLR4 e l’attivazione di NF-κB (in particolare la sua forma fosforilata p-P65 e la sua traslocazione nel nucleo) sia negli astrociti in coltura che nel cervello dei ratti. In pratica, “spegne” un interruttore chiave della risposta infiammatoria dannosa. Inoltre, sembra regolare l’attività delle metalloproteinasi di matrice (MMP-2, MMP-9) e dei loro inibitori (TIMP-1, TIMP-2), contribuendo a ristabilire l’equilibrio della matrice extracellulare, che viene sconvolto dopo l’emorragia.
Cosa Significa Tutto Questo e Quali Sono i Prossimi Passi?
Questi risultati sono entusiasmanti! Dimostrano che il nostro scaffold dECM@exo stampato in 3D è una piattaforma efficace per veicolare esosomi terapeutici direttamente nel cervello danneggiato, mantenendo l’omeostasi del microambiente nelle fasi critiche dopo un’ICH e migliorando significativamente gli esiti neurologici. È un approccio che combina i vantaggi della medicina rigenerativa (usando componenti biologiche come dECM ed esosomi) con l’ingegneria tissutale (la stampa 3D e gli idrogel).
Certo, la strada verso l’applicazione clinica è ancora lunga. Dobbiamo ottimizzare ulteriormente lo scaffold, magari rendendolo sensibile a stimoli specifici dell’ambiente infiammato (come il pH o le specie reattive dell’ossigeno) per un rilascio ancora più mirato. Dobbiamo anche studiare meglio i meccanismi d’azione, magari usando tecniche avanzate come il sequenziamento dell’RNA a singola cellula. Un’altra sfida è ridurre le dimensioni dello scaffold per poterlo impiantare con tecniche ancora meno invasive, come l’endoscopia.
Tuttavia, siamo convinti che dECM@exo rappresenti una strategia davvero promettente. Offre una bassa immunogenicità (a differenza delle terapie cellulari dirette), una buona biocompatibilità e la capacità di agire localmente e in modo prolungato. È un passo avanti importante nello sviluppo di bioterapie innovative per trattare l’emorragia intracerebrale, una condizione per cui abbiamo disperatamente bisogno di nuove soluzioni.
Spero che questo sguardo nel nostro lavoro vi abbia appassionato almeno quanto appassiona noi! La ricerca è fatta di piccoli passi, ma ogni scoperta ci avvicina a migliorare la vita delle persone.
Fonte: Springer