IDO1: La Spia nel Sangue che Preannuncia il KO del BCG nel Tumore alla Vescica?
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona molto e che riguarda un nemico subdolo: il tumore alla vescica. In particolare, ci concentreremo su quella forma chiamata “non muscolo-invasiva” (NMIBC), che rappresenta la maggior parte dei casi, circa il 75%. Sembra meno spaventosa della forma muscolo-invasiva (MIBC), ma attenzione: un 10-15% di questi tumori NMIBC può evolvere nella forma più grave.
La Sfida del Trattamento: Il BCG
Quando ci troviamo di fronte a un tumore NMIBC ad alto rischio, dopo l’intervento chirurgico iniziale (la resezione transuretrale, o TURBT), la terapia standard d’oro è l’instillazione intravescicale del Bacillo di Calmette-Guérin, il famoso BCG. Sì, proprio lui, il batterio attenuato usato anche per il vaccino contro la tubercolosi. L’idea è stimolare il nostro sistema immunitario, sia quello innato che quello acquisito, a riconoscere e combattere le cellule tumorali. Sembra geniale, vero? E in effetti, molte meta-analisi confermano che il BCG riduce le recidive e ritarda la progressione della malattia.
Ma c’è un “ma”, e non è piccolo. Una fetta significativa di pazienti, purtroppo, non risponde come dovrebbe a questa terapia. Parliamo di circa il 40% che va incontro a recidiva o progressione entro pochi anni, e un 20% che deve interrompere per effetti collaterali. Questi pazienti vengono definiti “BCG-unresponsive”, cioè non responsivi al BCG. Per loro, spesso l’unica opzione rimasta è la cistectomia radicale, l’asportazione completa della vescica. Un intervento pesante, che molti pazienti, specie se anziani o con altre patologie, faticano ad affrontare o semplicemente non vogliono subire. E il tempo perso con cicli di BCG inefficaci può peggiorare la prognosi. Capite bene l’urgenza di trovare un modo per capire prima chi risponderà e chi no.
Alla Ricerca di Indizi: Perché il BCG Fallisce?
Qui entra in gioco la ricerca. Da anni si cercano fattori clinici o biomarcatori che possano predire la risposta al BCG. Si è visto che alcuni fattori come il sesso femminile, l’età avanzata (>70 anni), il sovrappeso, un alto rapporto neutrofili/linfociti prima dell’intervento, o essere forti fumatori possono aumentare il rischio di fallimento. Ma non basta.
Si è guardato anche al profilo molecolare del tumore: il carico mutazionale, le mutazioni nei geni di riparazione del DNA. Persino il microbioma della vescica, l’insieme dei batteri che la popolano, sembra giocare un ruolo, magari creando un ambiente che “spegne” il sistema immunitario. E poi c’è lo stato delle cellule immunitarie stesse: un fenotipo di “esaurimento” delle cellule T (i nostri soldati anti-cancro, i linfociti T CD8+ che esprimono PD-1) è stato correlato al fallimento del BCG. Questo ha spinto a provare farmaci immunoterapici (inibitori dei checkpoint immunitari), ma con risultati finora limitati nel contesto NMIBC post-BCG. C’è ancora tanto da capire sui meccanismi immunitari coinvolti.
La Scoperta Chiave: L’Enzima IDO1
Nonostante tutti questi sforzi, ci manca ancora uno strumento affidabile, sensibile e specifico per predire la risposta al BCG. Ed è qui che il nostro studio ha cercato di fare la differenza. Abbiamo usato un approccio “multiomico”, analizzando a fondo i profili molecolari di pazienti che avevano risposto al BCG e di quelli che non avevano risposto, partendo da dati pubblici (un dataset chiamato GSE154261).
Analizzando le differenze nell’espressione genica tra questi due gruppi, è emerso un protagonista inaspettato: un enzima chiamato Indoleamina 2,3-diossigenasi, o più semplicemente IDO1. Questo enzima è risultato significativamente più espresso nei pazienti che non rispondevano al BCG.
IDO1: Un “Freno” per il Sistema Immunitario
Ma cos’è questo IDO1 e perché è così importante? Immaginate il sistema immunitario come un’orchestra che deve suonare la sinfonia giusta per attaccare il tumore. IDO1 agisce come un direttore d’orchestra che, invece di incitare, mette i freni. È un enzima immunosoppressivo. Cosa fa in pratica? Degrada un amminoacido essenziale, il triptofano, producendo una molecola chiamata chinurenina. Questa chinurenina ha effetti negativi sui nostri linfociti T “killer”, inibendone la proliferazione, e favorisce invece lo sviluppo di altre cellule T, le T regolatorie (Treg), che hanno il compito di spegnere la risposta immunitaria. In pratica, IDO1 crea un ambiente ostile all’attacco immunitario contro il cancro.
Abbiamo visto che alti livelli di IDO1 non solo si trovano nei non-responder al BCG, ma sono anche associati a:
- Tumori della vescica in stadi più avanzati (stadio 2, 3 e 4).
- Sottotipi molecolari di tumore alla vescica (basale squamoso e luminale infiltrato) che spesso esprimono alti livelli di altri “freni” immunitari come PD-L1 e CTLA4.
- Pazienti in sovrappeso o obesi, categorie già associate a prognosi peggiori nel tumore alla vescica.
- Una ridotta sopravvivenza libera da malattia nei pazienti trattati con BCG (analizzando dati da altri tre studi con follow-up a lungo termine).
Inoltre, l’espressione di IDO1 è risultata fortemente correlata a quella di noti checkpoint immunitari come PD-1 (PDCD1), PD-L1 (CD274), PD-L2 (PDCD1LG2), LAG3 e CTLA4, oltre che all’interferone gamma (IFN-γ), una molecola chiave nella risposta immunitaria ma che può anche indurre IDO1 come meccanismo di feedback negativo. Tutto ciò suggerisce che IDO1 sia un attore centrale nel processo di “disfunzione” delle cellule T che osserviamo nei pazienti che non rispondono alla terapia.
Analizzando più a fondo il microambiente immunitario, abbiamo visto che i pazienti responder al BCG avevano una maggiore abbondanza di cellule immunitarie “buone” come cellule B attivate, linfociti T CD4 e CD8 “memoria” e cellule dendritiche (che presentano l’antigene ai linfociti T), mentre i non-responder mostravano la presenza di cellule T regolatorie immunosoppressive.
Validazione sul Campo: Dalla Teoria alla Pratica
Bello scoprire queste cose analizzando dati, ma funzionerà anche nella “vita reale”? Per verificarlo, abbiamo preso campioni di tessuto tumorale (fissati in formalina e inclusi in paraffina, FFPE) prelevati prima del trattamento BCG da una nostra coorte retrospettiva di 75 pazienti (28 responder e 47 non-responder) seguiti presso l’Ospedale Universitario P. Giaccone di Palermo.
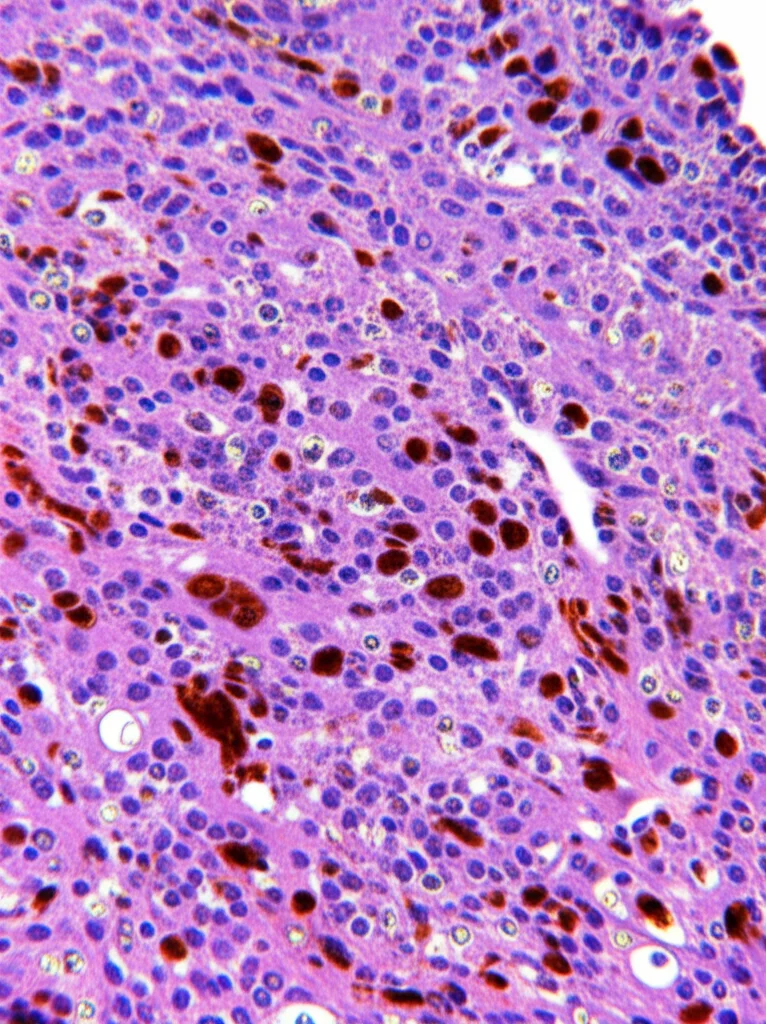
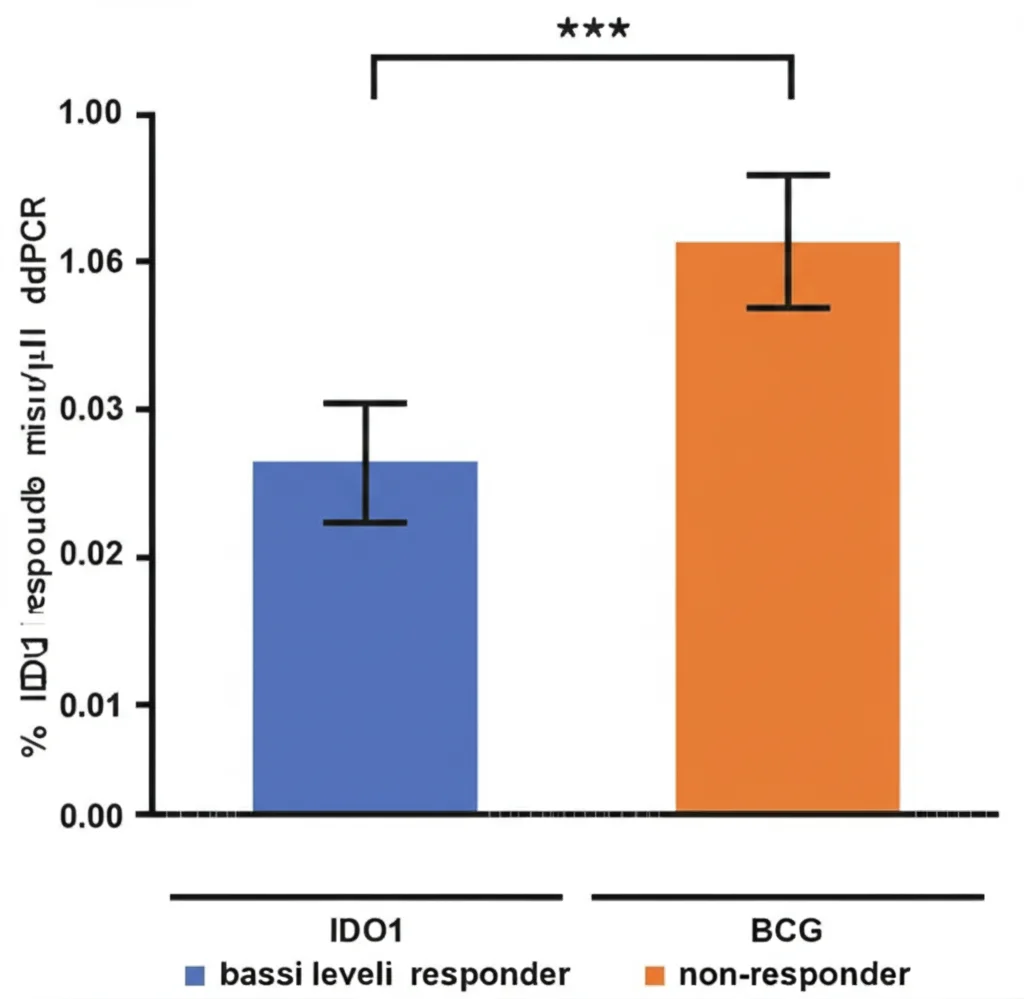
Estrarre RNA da questi campioni FFPE è complicato perché è spesso frammentato. Perciò abbiamo usato una tecnica super sensibile, la PCR digitale a goccia (ddPCR), per misurare l’espressione di IDO1. E i risultati hanno confermato i dati precedenti: i livelli di mRNA di IDO1 erano significativamente più alti nei pazienti che poi non avrebbero risposto al BCG rispetto a quelli che avrebbero risposto. Questa differenza è stata confermata anche a livello proteico con l’immunoistochimica (IHC).
Non solo: abbiamo anche visto che nei tumori dei non-responder c’era una maggiore espressione dei checkpoint immunitari (PD-1, PD-L1, ecc.) e, cosa fondamentale, una netta scarsità di linfociti T CD8+ positivi per la Granzima B (un marcatore di attività citotossica, cioè della capacità di uccidere le cellule tumorali). Quei pochi presenti erano spesso confinati nello stroma, la parte di supporto del tumore, e non a diretto contatto con le cellule cancerose. Al contrario, i responder mostravano una buona infiltrazione di questi linfociti T “killer” attivi. Questo rafforza l’idea che l’alto livello di IDO1 nei non-responder contribuisca a creare un deserto immunitario, impedendo al BCG di funzionare.
Cosa Significa Tutto Questo per i Pazienti?
Questa scoperta potrebbe essere davvero importante. Avere un biomarcatore come IDO1, misurabile sul tessuto tumorale prima di iniziare la terapia, potrebbe permetterci di identificare precocemente i pazienti ad alto rischio di fallimento del BCG. Immaginate: potremmo evitare cicli di terapia inutili e potenzialmente dannosi (perché ritardano interventi più efficaci) a chi sappiamo già avere poche chance di rispondere. Per questi pazienti, si potrebbe discutere da subito l’opzione della cistectomia radicale precoce o valutare terapie alternative, magari sperimentali.
Inoltre, IDO1 stesso diventa un potenziale bersaglio terapeutico. Se riusciamo a bloccare la sua attività immunosoppressiva con farmaci specifici (inibitori di IDO1), potremmo “risvegliare” la risposta immunitaria e magari rendere il BCG (o altre immunoterapie) più efficace anche in chi altrimenti non risponderebbe. Già esistono studi clinici che testano inibitori di IDO1, spesso in combinazione con inibitori dei checkpoint immunitari, e i risultati preliminari sembrano promettenti in termini di sinergia.
Uno Sguardo al Futuro
La strada è ancora lunga, ovviamente. Servono studi più ampi per confermare il valore prognostico di IDO1 e per definire soglie precise. Bisogna capire meglio come integrarlo con i fattori clinici e altri possibili biomarcatori. Ma aver identificato un meccanismo chiave di resistenza al BCG e un potenziale modo per prevederlo e contrastarlo è un passo avanti significativo.
Il nostro obiettivo finale è sempre lo stesso: migliorare la gestione del tumore alla vescica, personalizzare le cure e offrire a ogni paziente la strategia terapeutica più efficace fin dall’inizio, migliorando così le possibilità di guarigione e la qualità della vita. E la ricerca su IDO1 sembra indicarci una direzione molto promettente.
Fonte: Springer