IA Rivoluziona la Diagnosi del Cancro al Seno: Addio Grado di Nottingham Soggettivo?
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona molto e che sta cambiando il volto della medicina: l’intelligenza artificiale applicata alla diagnosi del cancro, in particolare quello al seno.
Il cancro al seno, purtroppo, è una realtà molto diffusa, anzi, è il tumore più diagnosticato a livello globale. Capire quanto sia aggressivo è fondamentale per scegliere la cura giusta e prevedere come andranno le cose per la paziente. Uno degli strumenti chiave che usiamo noi medici, o meglio, i patologi, è il cosiddetto Grado di Nottingham (noto anche come sistema di Elston-Ellis). In pratica, si guarda il tessuto tumorale al microscopio e si valuta quanto le cellule tumorali assomiglino a quelle normali, quanto velocemente si dividono e come si organizzano. Più il grado è alto (da 1 a 3), più il tumore è aggressivo.
La Sfida del Grado di Nottingham Tradizionale
Sembra semplice, vero? Beh, non proprio. Questo sistema, pur essendo lo standard raccomandato da organizzazioni mondiali come l’OMS, ha i suoi limiti. Richiede un occhio esperto, tanto tempo e, diciamocelo, anche i migliori patologi possono avere pareri leggermente diversi guardando lo stesso vetrino. Questa variabilità tra osservatori diversi, o anche dello stesso osservatore in momenti diversi, può fare la differenza. C’era bisogno di un approccio più oggettivo e automatizzato.
L’Intelligenza Artificiale Entra in Scena
Ed è qui che entra in gioco l’IA! Negli ultimi anni, l’analisi delle immagini digitali in patologia ha fatto passi da gigante grazie all’apprendimento profondo (deep learning). Immaginate di poter “scannerizzare” i vetrini istologici (quelli colorati con Ematossilina ed Eosina, HeE) e ottenere immagini digitali ad altissima risoluzione, le cosiddette whole-slide images (WSI). Bene, ora immaginate un’IA super addestrata che analizza queste immagini.
Nel nostro studio, abbiamo voluto fare proprio questo: sviluppare un modello di IA capace di prevedere il Grado di Nottingham direttamente dalle WSI. Non un’IA qualsiasi, ma una basata su un “modello fondazionale” (in gergo tecnico, un foundation model chiamato UNI), che è come dare al nostro sistema una base di conoscenza vastissima sulla patologia, appresa in modo auto-supervisionato (cioè imparando da sola dai dati, senza etichette specifiche per ogni dettaglio).
Come Abbiamo “Insegnato” all’IA a Valutare i Tumori
Abbiamo preso un bel po’ di immagini WSI dal database TCGA (The Cancer Genome Atlas), precisamente 521 vetrini di pazienti con cancro al seno di cui conoscevamo già il Grado di Nottingham. Abbiamo usato queste immagini per “addestrare” e validare il nostro modello.
La tecnica chiave che abbiamo usato si chiama Apprendimento a Istanze Multiple (MIL). In pratica, l’immagine intera del vetrino è vista come un “sacco” (bag) contenente tante piccole “tessere” (patches o istanze). L’IA impara a dare un’etichetta all’intero sacco (il grado del tumore) basandosi sulle caratteristiche delle singole tessere, prestando più “attenzione” a quelle più significative. Abbiamo confrontato ben 14 diversi algoritmi MIL!
Il modello che si è distinto, chiamato ACMIL, è particolarmente furbo: usa tecniche come l’apprendimento multi-ramo e il mascheramento stocastico delle istanze top-K per evitare di concentrarsi troppo su poche aree e per imparare in modo più robusto. Abbiamo estratto le caratteristiche importanti da ogni tessera usando il modello fondazionale UNI e le abbiamo date in pasto all’ACMIL.
Per essere sicuri che funzionasse davvero, abbiamo poi testato il modello su un altro set di dati completamente indipendente (il dataset BRACS) con 128 immagini WSI, valutate per l’occasione da un patologo esperto.
I Risultati: L’IA Mantiene le Promesse?
Ebbene sì! I risultati sono stati davvero incoraggianti. Il nostro modello migliore (ACMIL + UNI) ha raggiunto un punteggio F1 di 0.731 e un’AUC media multiclasse di 0.835 sul set di test interno (TCGA). Cosa significa in parole povere? Che il modello è stato piuttosto bravo a classificare correttamente i tre gradi di Nottingham.
Ecco alcuni punti salienti:
- Distinzione tra i gradi: A differenza di studi precedenti che faticavano a distinguere bene tra grado 1 e 2, il nostro modello ha mostrato una buona capacità nel separare tutti e tre i gradi, con AUC specifiche di 0.83 per il grado 1, 0.77 per il grado 2 e un ottimo 0.90 per il grado 3 nel test TCGA.
- Validazione esterna: Anche sul set di dati BRACS, il modello ha mantenuto buone prestazioni (AUC di 0.89 per grado 1, 0.70 per grado 2, 0.83 per grado 3), dimostrando di saper generalizzare. Certo, il grado 2 resta un po’ più ostico, ma è una sfida nota anche per i patologi!
- Rilevanza clinica: Le previsioni del grado fatte dall’IA si sono dimostrate significativamente associate alla sopravvivenza complessiva a 5 anni dei pazienti (p<0.05). I pazienti classificati come grado 1 dall'IA avevano tassi di sopravvivenza più alti, seguiti dal grado 2 e poi dal grado 3, proprio come ci si aspetta clinicamente.
- Connessione biologica: Abbiamo fatto un passo in più. Analizzando i dati genetici (RNA-seq) dei pazienti, abbiamo visto che i geni più correlati alle previsioni di grado 3 fatte dal modello erano fortemente coinvolti in processi come la divisione cellulare e la segregazione cromosomica. Questo conferma che l’IA non sta solo guardando delle immagini, ma sta cogliendo aspetti biologici fondamentali legati all’aggressività del tumore.
- Interpretabilità: Grazie alle “mappe di calore” (heatmap) generate dal modello, possiamo vedere su quali aree del vetrino l’IA si concentra di più per fare la sua previsione. Un patologo esperto ha confermato che queste aree corrispondevano a caratteristiche istologiche rilevanti per la gradazione.
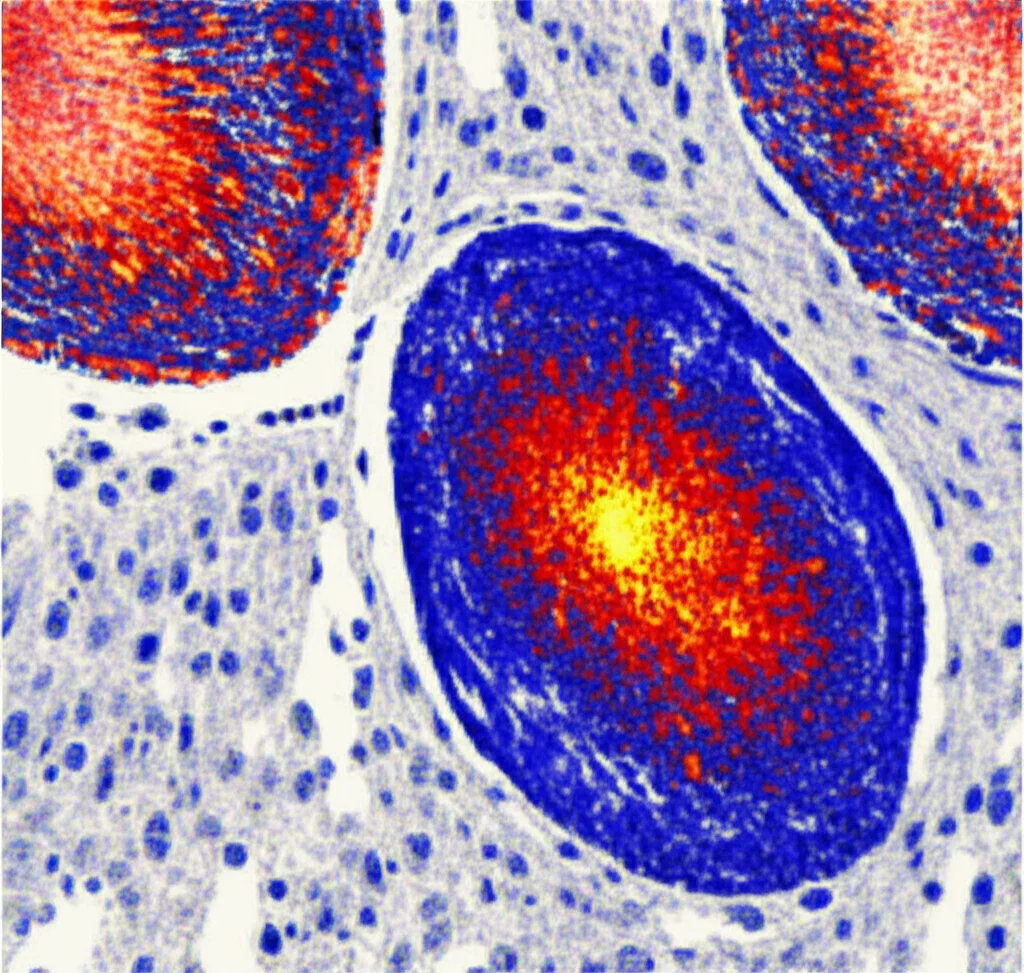
Non è Tutto Oro Quello che Luccica: Le Sfide Aperte
Siamo entusiasti, ma restiamo con i piedi per terra. Ci sono delle limitazioni da considerare:
- Dati pubblici: Abbiamo usato dati pubblici (TCGA), che sono preziosi ma a volte mancano di informazioni dettagliate su follow-up, trattamenti specifici o sottotipi tumorali.
- Sbilanciamento dei dati: C’erano meno casi di grado 1 rispetto ai gradi 2 e 3, il che potrebbe influenzare l’analisi, specialmente quella sulla sopravvivenza.
- Confusione tra gradi: Come accennato, distinguere perfettamente tra gradi adiacenti (soprattutto 1 e 2) resta difficile, sia per l’IA che per gli umani, a causa delle somiglianze morfologiche.
- Dipendenza da modelli esistenti: Abbiamo costruito sulle spalle di giganti, usando modelli e metodologie in parte già sviluppate.
- Significatività statistica: Anche se le tendenze erano chiare, in alcune analisi statistiche più complesse (multivariate), il grado predetto dall’IA non manteneva una significatività statistica indipendente fortissima, probabilmente a causa dell’influenza di altri fattori clinici.
Verso un Futuro Digitale e Oggettivo per la Patologia
Nonostante le sfide, credo fermamente che siamo sulla strada giusta. Abbiamo dimostrato che un modello IA può predire accuratamente il Grado di Nottingham, un compito complesso che richiede grande esperienza. Questo apre le porte a una valutazione più rapida, consistente e oggettiva.
Immaginate l’impatto: ridurre la variabilità tra patologi, accelerare i tempi di diagnosi, fornire uno strumento di supporto decisionale potente. Integrata nei flussi di lavoro clinici, questa tecnologia potrebbe davvero contribuire a migliorare le strategie terapeutiche e, in ultima analisi, gli esiti per le pazienti con cancro al seno.
E non finisce qui. Il potenziale di questi modelli va oltre il cancro al seno e il Grado di Nottingham. Potremmo vederli applicati ad altri tipi di tumore e ad altre valutazioni patologiche, spingendo sempre più verso un’analisi automatizzata e oggettiva in medicina.
Insomma, l’IA sta bussando forte alle porte dei laboratori di patologia, non per sostituire i medici, ma per affiancarli con strumenti potentissimi. Il futuro della diagnosi è sempre più digitale, e io non vedo l’ora di vedere cosa ci riserverà!
Fonte: Springer