Distacco di Retina: Macula Coinvolta o No? Le Conseguenze a Lungo Termine che Forse Non Ti Aspetti!
Amici appassionati di scienza e medicina, oggi voglio parlarvi di un argomento che mi sta particolarmente a cuore e che, sono sicuro, incuriosirà molti di voi: il distacco regmatogeno di retina (RRD). Immaginate la retina, quel sottile strato di tessuto sensibile alla luce in fondo al nostro occhio, come la pellicola di una macchina fotografica. Se questa “pellicola” si stacca dalla sua parete posteriore, beh, la visione ne risente parecchio!
Cos’è il Distacco Regmatogeno di Retina e Chi Rischia di Più?
Il distacco regmatogeno di retina si verifica quando del liquido vitreale (quella sostanza gelatinosa che riempie l’occhio) s’infila sotto la retina attraverso una o più rotture, sollevandola. È un po’ come se l’acqua si infiltrasse sotto la carta da parati, facendola scollare. Questo problema, purtroppo, non è rarissimo. Colpisce più gli uomini che le donne e si manifesta più comunemente tra i 20 e i 60 anni, anche se nessuno è completamente al sicuro.
Ci sono diversi fattori che possono aumentare il rischio, tra cui:
- La miopia elevata (chi ci vede male da lontano, per intenderci)
- La degenerazione a palizzata della retina
- Infiammazioni oculari
- Traumi all’occhio
- Dermatite atopica
- Il distacco posteriore del vitreo (un evento comune con l’invecchiamento)
Quando succede, l’intervento chirurgico è spesso l’unica via d’uscita. Si può ricorrere al cerchiaggio sclerale, alla vitrectomia (la rimozione del vitreo), o a una combinazione delle due, a seconda del caso. L’obiettivo? Richiudere le rotture e far riaderire la retina. E devo dire che, nella maggior parte dei casi, l’intervento ha successo nel riattaccare la retina. Ma la domanda che sorge spontanea è: “E dopo? La vista torna come prima?”
Il Ruolo Cruciale della Macula
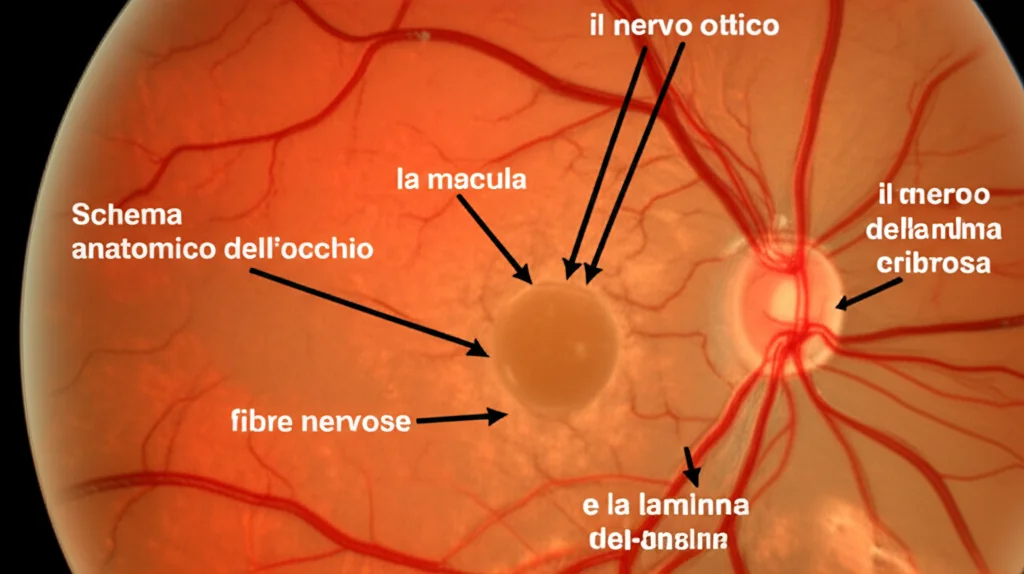
Qui entra in gioco un fattore determinante: lo stato della macula prima dell’intervento. La macula è la parte centrale della retina, responsabile della visione nitida e dettagliata, quella che ci permette di leggere o riconoscere i volti. Se il distacco coinvolge la macula (parliamo allora di distacco macula-off), la prognosi visiva tende ad essere meno brillante rispetto a quando la macula rimane adesa (macula-on).
Anche dopo un intervento riuscito, la retina può subire dei cambiamenti microstrutturali, specialmente a livello maculare, che influenzano il recupero visivo. Ma c’è un altro aspetto, forse meno discusso ma altrettanto importante, che abbiamo voluto indagare: cosa succede allo spessore delle fibre nervose retiniche peripapillari (pRNFL) a lungo termine? Queste fibre sono, in pratica, i “cavi” che trasportano le informazioni visive dalla retina al cervello. Un loro assottigliamento non è mai una buona notizia.
L’ipotesi da cui siamo partiti era che un distacco macula-off, essendo generalmente più esteso nella zona posteriore dell’occhio, potesse causare un danno progressivo maggiore a queste fibre nervose. Ebbene, fino ad ora, nessuno studio aveva specificamente valutato questo aspetto nel dettaglio e a lungo termine.
Il Nostro Studio: Cosa Abbiamo Fatto e Scoperto
Così, ci siamo messi al lavoro! Abbiamo condotto uno studio retrospettivo, longitudinale e osservazionale, seguendo tutti i principi della Dichiarazione di Helsinki (il nostro faro etico nella ricerca). Abbiamo analizzato pazienti con RRD che avevano subito una singola vitrectomia senza complicazioni e che erano stati seguiti per almeno 3 anni dopo l’operazione.
I pazienti sono stati divisi in due gruppi:
- Gruppo 1: distacco macula-on (macula adesa prima dell’intervento)
- Gruppo 2: distacco macula-off (macula sollevata prima dell’intervento)
Abbiamo stabilito un valore basale dello spessore del pRNFL dopo la completa scomparsa del gas iniettato nell’occhio durante la vitrectomia (una procedura standard per tenere la retina in posizione). Poi, abbiamo ripetuto le misurazioni a intervalli di un anno per tre anni. In totale, abbiamo analizzato 62 occhi: 30 nel Gruppo 1 e 32 nel Gruppo 2.
I risultati sono stati illuminanti!
Nel Gruppo 1 (macula-on), lo spessore globale del pRNFL è passato da una media di 100.0 µm al basale a 97.0 µm dopo 3 anni. Una riduzione statisticamente significativa (P=0.001).
Nel Gruppo 2 (macula-off), i valori sono scesi da 99.6 µm a 94.1 µm nello stesso periodo. Anche qui, una riduzione significativa (P<0.001), ma, come vedete, più marcata.
Analizzando i vari settori della retina, abbiamo notato che nel Gruppo 2 (macula-off) c’erano cambiamenti statisticamente significativi nei settori inferotemporale (P<0.001) e inferonasale (P=0.003).
Ma il dato forse più eclatante è il tasso di riduzione dello spessore globale del pRNFL:
- Gruppo 1 (macula-on): -0.89 µm all’anno
- Gruppo 2 (macula-off): -1.81 µm all’anno
Questa differenza nei tassi di riduzione tra i due gruppi è risultata statisticamente significativa (P=0.026). In parole povere, nei pazienti con distacco macula-off, le fibre nervose retiniche si assottigliano a una velocità quasi doppia rispetto a quelli con macula-on! E, cosa molto interessante, abbiamo osservato una diminuzione sostanziale dello spessore del pRNFL nella parte inferiore della retina nei pazienti macula-off.
Perché Questa Differenza? Spiegazioni Possibili
Vi chiederete: perché questa differenza così netta? E perché proprio i settori inferiori?
Una prima considerazione è che entrambi i gruppi hanno mostrato una riduzione dello spessore del pRNFL nel tempo. Questo potrebbe essere in parte legato alla lunghezza assiale elevata (occhi più “lunghi”, spesso miopi) presente in molti pazienti del nostro studio. È noto che gli occhi molto miopi tendono a subire un assottigliamento progressivo della retina a causa dell’allungamento del bulbo oculare. Il tasso di riduzione nel nostro Gruppo 1 (-0.89 µm/anno) sembra comunque leggermente inferiore a quello riportato in studi su pazienti altamente miopi, suggerendo che l’impatto del RRD in sé sulle modifiche del pRNFL sia minore in questo gruppo.
Il fatto che la riduzione sia significativamente maggiore nel Gruppo 2 (macula-off) suggerisce che il coinvolgimento maculare giochi un ruolo diretto. Si pensa che la degenerazione dei fotorecettori (le cellule sensibili alla luce) nella retina distaccata possa portare a una perdita di assoni delle cellule ganglionari e alla degenerazione di queste stesse cellule negli strati interni della retina. Questo fenomeno, chiamato degenerazione anterograda, potrebbe spiegare l’assottigliamento del pRNFL. Poiché il Gruppo 2 ha un’area di distacco retinico attorno al polo posteriore relativamente più ampia, è logico aspettarsi un tasso di riduzione del pRNFL più rapido.
Inoltre, la significativa riduzione di spessore osservata nel Gruppo 2 durante il primo anno potrebbe essere correlata alla risoluzione dell’edema postoperatorio e alla diminuzione della proliferazione delle cellule di Müller, che tipicamente aumentano subito dopo l’intervento.
E per quanto riguarda i settori inferiori? Anche se nel nostro studio c’erano meno pazienti con distacco nella regione inferiore rispetto a quella superiore, è proprio il settore inferiore a mostrare la riduzione di spessore più marcata. Questo potrebbe dipendere dalla struttura anatomica della lamina cribrosa, la struttura attraverso cui passano le fibre nervose per uscire dall’occhio e formare il nervo ottico. Le porzioni inferiori della lamina cribrosa hanno pori più grandi e forniscono meno supporto connettivale agli assoni delle cellule ganglionari. Questa maggiore richiesta metabolica rende il settore inferiore più suscettibile a vari tipi di danno. Sembra quindi che la struttura anatomica della lamina cribrosa giochi un ruolo più centrale nella riduzione settoriale dello spessore del pRNFL rispetto alla localizzazione del distacco retinico stesso. Fascinante, vero?
Il Fattore “Lunghezza Assiale”
Un altro dato emerso con forza è l’associazione significativa tra le variazioni dello spessore del pRNFL e la lunghezza assiale dell’occhio. Più l’occhio è lungo, più tende ad allungarsi nel tempo, e questo “stiramento” può portare a un ulteriore assottigliamento del pRNFL. È interessante notare che, nell’analisi per sottogruppi, la lunghezza assiale non era significativamente associata alle variazioni del pRNFL nel Gruppo 1 (macula-on), mentre lo era nel Gruppo 2 (macula-off). Sembra che le variazioni dello spessore del pRNFL nei pazienti con distacco macula-off siano più sensibili alla lunghezza assiale. Questo potrebbe essere dovuto alla maggiore area di distacco retinico al polo posteriore in questi pazienti, che rende il pRNFL più vulnerabile ai danni da stiramento.
Certo, altri studi hanno riportato risultati diversi dai nostri, ma spesso le differenze si spiegano con criteri di inclusione differenti, come momenti diversi per la misurazione basale o l’inclusione di pazienti trattati con olio di silicone (che noi abbiamo escluso). Ad esempio, uno studio precedente non aveva trovato assottigliamenti del pRNFL a 3 anni, ma la misurazione basale era stata fatta prima dell’intervento. Se si considera solo il periodo postoperatorio, il trend di assottigliamento appare simile al nostro.
Limiti e Punti di Forza
Come ogni ricerca scientifica, anche la nostra ha dei limiti. Il disegno retrospettivo può introdurre bias di selezione, il numero di pazienti era limitato a causa di criteri di inclusione ed esclusione molto stringenti. Inoltre, non abbiamo potuto escludere completamente la possibilità di aver incluso pazienti con glaucoma preperimetrico al basale. La presenza di pazienti con miopia elevata, sebbene rifletta la realtà clinica, rende difficile isolare gli effetti del solo RRD.
Tuttavia, il punto di forza del nostro studio risiede nella sua analisi comparativa longitudinale delle modifiche dello spessore del pRNFL tra casi macula-on e macula-off, un argomento che, come dicevo, non era stato precedentemente approfondito in questo modo.
Cosa Portiamo a Casa?
In conclusione, quello che abbiamo imparato è che i pazienti con distacco regmatogeno di retina che subiscono una vitrectomia e non hanno ulteriori complicazioni mostrano una graduale diminuzione dello spessore del pRNFL nel tempo. Questa riduzione è però più pronunciata in coloro che avevano un distacco macula-off.
Sorprendentemente, anche se i distacchi erano più frequenti nell’area superiore, la maggiore riduzione dello spessore dell’RNFL inferiore è stata osservata nei pazienti macula-off, probabilmente a causa della struttura anatomica della lamina cribrosa. Infine, le variazioni dello spessore del pRNFL hanno dimostrato un’associazione significativa con la lunghezza assiale, e questa associazione era più forte nei pazienti macula-off.
Quindi, noi medici dobbiamo tenere bene a mente queste dinamiche quando valutiamo patologie oftalmiche in cui le misurazioni del pRNFL sono importanti (come il glaucoma, ad esempio) in pazienti che hanno subito un intervento per RRD. È un altro tassello che ci aiuta a comprendere meglio le conseguenze a lungo termine di questa patologia e a gestire al meglio i nostri pazienti. Spero che questo piccolo viaggio nel mondo della ricerca oftalmologica vi sia piaciuto!
Fonte: Springer
]] G]>
La Sfida della Disartria nella SLA
La SLA, per chi non la conoscesse a fondo, è una malattia terribile che colpisce i motoneuroni, portando progressivamente alla paralisi. Uno dei sintomi più comuni e invalidanti è la disartria, ovvero la difficoltà nell’articolare le parole. Pensate che oltre l’80% delle persone con SLA sviluppa problemi di linguaggio! E per chi ha un esordio “bulbare” (cioè con sintomi che iniziano da parola, salivazione o deglutizione), il declino è spesso più rapido.
Fino ad oggi, la valutazione di questi problemi si è basata principalmente sulla scala ALSFRS-R, uno strumento utile ma, diciamocelo, un po’ grossolano. Offre solo cinque opzioni di risposta per valutare il deterioramento del linguaggio, il che significa che non riesce a cogliere le variazioni più sottili e tempestive. È come cercare di misurare la febbre con un termometro che segna solo “freddo”, “tiepido” o “caldo”. Serve qualcosa di più!
L’Ascolto Attento: Il “Listener Effort”
Per superare questi limiti, si è iniziato a esplorare il concetto di “listener effort” (LE), cioè lo sforzo che l’ascoltatore deve compiere per capire chi parla. È una misura clinicamente significativa, più sfumata, che ci dà un’idea più precisa degli aspetti motori della produzione verbale. Certo, ha avuto le sue critiche: variabilità tra ascoltatori diversi, difficoltà di standardizzazione… Ma quando la valutazione viene fatta da logopedisti esperti (SLP), l’affidabilità aumenta parecchio. E studi recenti hanno confermato che il LE è addirittura più accurato di altri parametri nel distinguere i livelli di gravità della disartria.
L’Intelligenza Artificiale Entra in Scena: Il Nostro Approccio Innovativo
Ed è qui che entriamo in gioco noi, o meglio, la nostra ricerca. Ci siamo chiesti: e se potessimo insegnare a un’IA a valutare questo “listener effort” direttamente dalle registrazioni audio, magari raccolte da remoto, comodamente da casa del paziente? E se questa IA non solo fosse precisa, ma ci dicesse anche *quali* suoni o parole sono più critici?
Abbiamo sviluppato un modello di IA basato sul deep learning e sui meccanismi di “attenzione” (sì, proprio come quelli che permettono a ChatGPT di capire il contesto di una frase lunga!). Abbiamo utilizzato 2.102 registrazioni vocali di 125 partecipanti, valutate da tre logopedisti esperti su una scala da 0 a 100 per lo sforzo di ascolto. L’obiettivo? Addestrare i nostri modelli a fare la stessa cosa, partendo direttamente dall’audio.
I risultati? Beh, lasciatemi dire che sono stati entusiasmanti! Il nostro modello migliore ha raggiunto un R² di 0.92 e un RMSE (una misura dell’errore) di soli 6.78 punti su 100. Tradotto: un’accuratezza pazzesca nel cogliere anche i cambiamenti più lievi nel modo di parlare.

Cosa “Ascolta” l’IA? L’Importanza dei Fonemi
Ma la cosa forse più affascinante è l’interpretabilità del modello. Grazie ai meccanismi di attenzione, siamo riusciti a capire su quali elementi del discorso l’IA si concentra maggiormente per dare il suo giudizio. E qui le scoperte sono state illuminanti!
Abbiamo visto che certi fonemi sono cruciali. Ad esempio, i suoni vocalici influenzati dalla ‘r’ (pensate a parole inglesi come “car” o “more”) sono risultati particolarmente indicativi. Non solo: anche i suoni di inspirazione isolati, quei piccoli respiri che una persona fa mentre cerca le parole o fatica a parlare, sono emersi come marcatori del deterioramento del linguaggio, specialmente nelle fasi iniziali.
Analizzando più a fondo, abbiamo notato una grande variabilità nel “listener effort” associato a fonemi corrispondenti a suoni vocalici e a consonanti come k, l, m, n, r, s, t. Per i bigrammi (coppie di fonemi), abbiamo osservato una notevole variabilità per sequenze come AA1-R (in parole come “garden”) e AO1-R (in “north”). Anche per i trigrammi, pur con meno variabilità, casi come F-AO1-R (in “fortunately”) sono rimasti rilevanti.
In pratica, l’IA ha imparato a riconoscere quegli “inciampi” fonetici che per un orecchio umano non allenato potrebbero passare inosservati, ma che per un logopedista esperto (e ora anche per la nostra IA!) sono campanelli d’allarme. Parole che contengono fricative dentali sonore all’inizio, come l’inglese “the” e “that”, sono state anch’esse identificate come “attenzionate” dal modello. Pronunciare questi fonemi richiede un controllo motorio fine di lingua, denti e corde vocali, tutte strutture tipicamente colpite nella SLA.
Perché Tutto Questo è Importante?
Vi chiederete: “Ok, bello, ma a cosa serve?”. Serve tantissimo!
Abbiamo anche confrontato il nostro approccio con modelli basati su caratteristiche acustiche “fatte a mano” (handcrafted features). Ebbene, i modelli di deep learning basati su architetture potenti come Whisper (sì, quello famoso per la trascrizione automatica!) si sono dimostrati statisticamente superiori. Questo perché i modelli pre-allenati su enormi quantità di dati audio (parliamo di centinaia di migliaia di ore!) riescono a cogliere sfumature che sfuggono ad approcci più tradizionali.

Sguardo al Futuro: Sfide e Prospettive
Certo, la strada è ancora lunga e ci sono sfide da affrontare. Una riguarda la diversità linguistica. Il nostro studio si è concentrato principalmente su parlanti inglesi, e abbiamo notato che per i non madrelingua l’errore del modello era leggermente più alto. Sarà fondamentale raccogliere dati in più lingue per rendere questi strumenti veramente globali.
Un altro aspetto è la necessità di informazioni più dettagliate sulla “fenotipizzazione” della SLA e altre caratteristiche della malattia, che possono influenzare significativamente i disturbi del linguaggio. Il nostro campione, sebbene riflettesse la prevalenza dell’esordio bulbare, era composto prevalentemente da individui con tassi di progressione lenti.
Inoltre, sarebbe utile includere nel gruppo di controllo persone con altre malattie neurodegenerative, per capire meglio la specificità del modello. E, naturalmente, più dati longitudinali (cioè raccolti nel tempo sullo stesso paziente) e una gamma più ampia di background linguistici non potranno che migliorare la robustezza dei modelli.
Un Passo Avanti per Pazienti e Ricerca
In sintesi, amici, quello che abbiamo sviluppato è più di un semplice algoritmo. È una metodologia che offre una base solida per rilevare sottili alterazioni del linguaggio legate alla disartria, sfruttando la potenza dell’IA per selezionare sistematicamente parole foneticamente informative per un monitoraggio personalizzato della progressione della malattia.
Fornendo valutazioni precise e interpretabili da dati raccolti da remoto, questo approccio basato sull’IA offre ai pazienti un accesso più facile alla valutazione, mantenendo al contempo il rigore clinico. E la bellezza è che questa “pipeline” può essere applicata direttamente ad altre condizioni neurodegenerative che colpiscono il linguaggio, come il Parkinson o la malattia di Huntington, ampliandone l’impatto e l’utilità.
È un esempio lampante di come la tecnologia, quando guidata da solide basi scientifiche e da un reale desiderio di migliorare la vita delle persone, possa davvero fare la differenza. E io non potrei essere più entusiasta di far parte di questa rivoluzione silenziosa, ma potentissima!
Fonte: Springer







