Helicobacter pylori: Come Inganna il Tuo Sistema Immunitario (Svelato Cellula per Cellula!)
Avete mai pensato a come fa un batterio così comune come l’Helicobacter pylori (H. pylori) a sopravvivere nel nostro stomaco per anni, a volte per tutta la vita, nonostante il nostro sistema immunitario gli dia costantemente la caccia? È una domanda che ha affascinato scienziati come me per molto tempo. Questo piccolo intruso colonizza lo stomaco di quasi metà della popolazione mondiale e, anche se spesso non dà sintomi immediati, è un fattore di rischio serio per gastrite cronica, ulcere e persino cancro allo stomaco. L’Organizzazione Mondiale della Sanità lo ha messo nella lista dei patogeni “ad alta priorità”, e le linee guida raccomandano di eliminarlo ogni volta che viene trovato.
Il nostro corpo, ovviamente, non sta a guardare. L’infezione da H. pylori scatena una risposta immunitaria robusta: un vero e proprio esercito di cellule immunitarie (linfociti T e B, monociti, macrofagi, neutrofili, mastociti, cellule dendritiche) si riversa nella mucosa gastrica. Sappiamo che si attivano cellule T specifiche contro il batterio, con una risposta orientata principalmente verso il tipo Th1 e Th17, che a loro volta richiamano altre cellule infiammatorie. Recentemente, si è visto che anche le cellule T CD8+ giocano un ruolo nel controllo iniziale del batterio.
Eppure, nonostante tutto questo spiegamento di forze, H. pylori riesce quasi sempre a stabilire un’infezione cronica. Come ci riesce? Beh, sembra essere un vero maestro della manipolazione immunitaria.
Spiare le Cellule una per Una: La Rivoluzione del Single-Cell RNA Sequencing
Per capire meglio questi meccanismi di “fuga” immunitaria, abbiamo usato una tecnologia incredibilmente potente: il sequenziamento dell’RNA a singola cellula (scRNA-seq). Immaginatela come la capacità di ascoltare cosa sta “dicendo” (cioè quali geni sta esprimendo) ogni singola cellula immunitaria presente nello stomaco, una per una. Abbiamo analizzato ben 187.192 cellule provenienti da biopsie gastriche e campioni di sangue di 12 persone con gastrite cronica associata a H. pylori e 11 persone senza l’infezione (usate come controllo).
Questo approccio ci ha permesso di creare una mappa dettagliatissima dell’ecosistema immunitario gastrico e di vedere come viene “riprogrammato” dall’infezione. E quello che abbiamo scoperto è affascinante e un po’ inquietante: H. pylori sembra creare attivamente un microambiente immunosoppressivo per garantirsi la sopravvivenza.
I Guardiani Indeboliti: Monociti, Macrofagi e Cellule Dendritiche
Le prime linee di difesa, le cellule mieloidi (monociti, macrofagi, cellule dendritiche – APC), sono cruciali per “presentare” pezzi del batterio (antigeni) alle cellule T, attivando così la risposta immunitaria specifica. Ecco, una delle scoperte chiave è stata proprio questa: in presenza di H. pylori, queste cellule mostrano una ridotta capacità di presentare gli antigeni. Abbiamo misurato i livelli delle molecole MHC di classe II (essenziali per questo processo) e abbiamo visto un calo significativo sia nei monociti che nelle cellule dendritiche, sia nel sangue periferico che direttamente nel tessuto gastrico dei pazienti infetti. È come se H. pylori dicesse a queste sentinelle: “Ehi, abbassate la voce, non fate vedere troppo in giro chi sono!”.
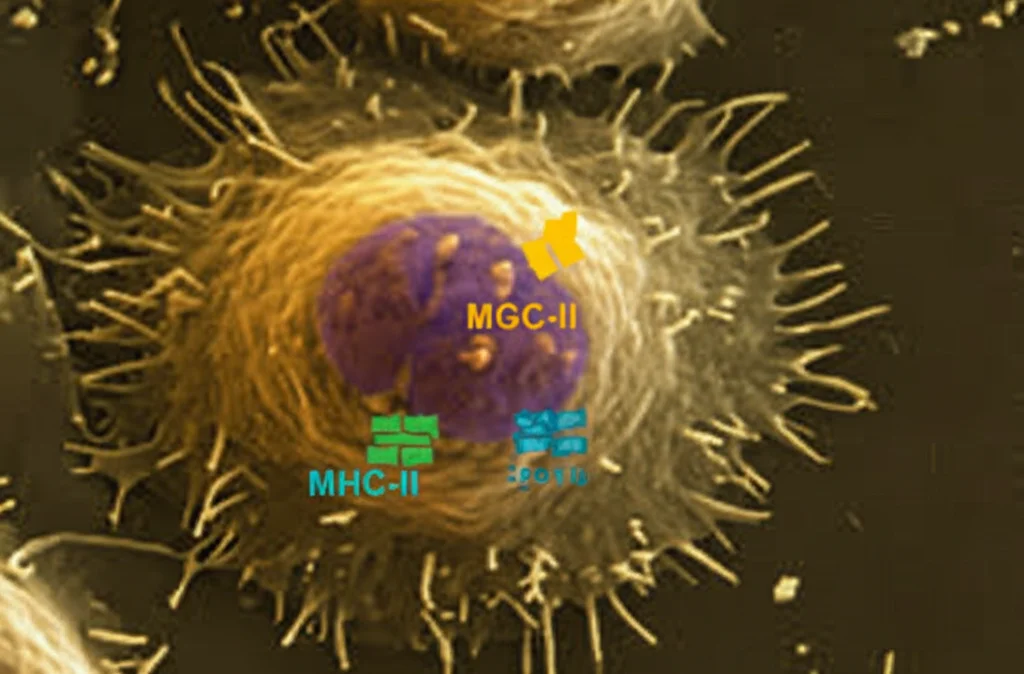
Non solo. Abbiamo identificato un percorso specifico di differenziazione: un particolare tipo di monociti (chiamati Cluster 7 nel nostro studio), che sembrano essere attivati dall’infezione, si trasformano progressivamente in un tipo specifico di macrofagi residenti nel tessuto (Macro-C1QC+). Questi macrofagi, pur essendo presenti, mostrano anch’essi una ridotta capacità di presentare antigeni e, cosa interessante, una ridotta capacità fagocitica. In pratica, non solo “parlano” meno con le cellule T, ma sembrano anche meno “affamati” nel mangiare i batteri. Abbiamo confermato questi dati sia con esperimenti in vitro su cellule umane e murine, sia analizzando direttamente le cellule immunitarie da biopsie gastriche umane.
Abbiamo anche notato un aumento delle mast cellule nel tessuto gastrico infetto. Queste cellule sono note per il loro doppio ruolo: possono contribuire all’infiammazione e al danno, ma anche alla difesa antimicrobica. Resta da capire se H. pylori riesca a sfruttare anche loro per i propri scopi.
Le Forze Speciali Rallentate: Le Cellule T
E le cellule T, i soldati specializzati del sistema immunitario? Anche qui, H. pylori sembra mettere i bastoni tra le ruote. Analizzando sia le cellule T CD4+ (gli “aiutanti”) che le CD8+ (i “killer”), abbiamo osservato una generale iporesponsività e, soprattutto, una capacità di espansione clonale limitata. Cosa significa? Quando il sistema immunitario riconosce un nemico, le cellule T specifiche per quel nemico dovrebbero moltiplicarsi rapidamente (espansione clonale) per creare un esercito efficace. Ecco, nello stomaco infetto da H. pylori, questo processo sembra frenato. Immaginate un esercito che, invece di reclutare velocemente nuove truppe, rimane sotto organico e meno reattivo.

Un Sottotipo di Cellule T Molto Particolare
Scavando più a fondo nei dati delle cellule T, abbiamo identificato due popolazioni cellulari particolarmente interessanti, una CD8+ (CD8-12-HLA-DR) e una CD4+ (CD4-5-HLA-DR), che erano significativamente più abbondanti negli stomaci infetti. La cosa strana? Queste cellule esprimevano alti livelli sia di molecole MHC di classe II (HLA-DR, solitamente più tipiche delle cellule presentanti l’antigene) sia di molecole inibitorie, in particolare CTLA4. CTLA4 è un noto “freno” del sistema immunitario: quando si lega al suo partner (CD86) sulle cellule presentanti l’antigene, spegne l’attivazione delle cellule T.
Abbiamo visto che queste cellule T HLA-DR+ CTLA4+ sembrano essere in uno stato “disfunzionale” o di “esaurimento plastico”, con ridotta capacità citotossica (nel caso delle CD8+) e un fenotipo più inibitorio. E non è tutto. Analizzando le possibili interazioni cellula-cellula, abbiamo scoperto che proprio queste cellule T sembrano “dialogare” intensamente con i macrofagi attraverso l’asse CTLA4/CD86. Immaginate la scena: il macrofago cerca di attivare una cellula T mostrando l’antigene e usando il segnale “vai” (CD86), ma la cellula T HLA-DR+ CTLA4+ si lega a CD86 con il suo segnale “stop” (CTLA4), che ha un’affinità maggiore, impedendo di fatto l’attivazione efficace. Abbiamo persino confermato con tecniche di imaging (immunofluorescenza multiplex) che queste cellule si trovano fisicamente vicine nello stomaco infetto. Un meccanismo di evasione immunitaria davvero sofisticato!

Cosa Significa Tutto Questo?
Insomma, il nostro viaggio cellula per cellula nell’ecosistema gastrico infettato da H. pylori ci ha rivelato un quadro complesso ma chiaro: questo batterio è un abile stratega che orchestra un ambiente immunosoppressivo per sfuggire alle difese dell’ospite. Lo fa indebolendo la capacità delle cellule APC di presentare antigeni e fagocitare, e frenando la risposta delle cellule T, limitandone l’espansione e promuovendo sottotipi cellulari con funzioni inibitorie che interagiscono attivamente per smorzare ulteriormente la risposta immunitaria.
Capire questi “trucchi” è fondamentale. Non solo ci aiuta a comprendere perché H. pylori sia così difficile da eradicare spontaneamente, ma apre anche nuove strade per lo sviluppo di terapie innovative. Magari potremmo trovare modi per “risvegliare” le cellule immunitarie dormienti, bloccare i segnali inibitori come CTLA4 in questo contesto specifico, o potenziare la capacità di presentazione dell’antigene. La battaglia contro H. pylori è ancora lunga, ma avere una mappa così dettagliata del campo di battaglia ci dà sicuramente un vantaggio in più.
Fonte: Springer