HDAC10: Il Regista Nascosto che Dirige la Morte nelle Cellule Leucemiche Linfoidi
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo nel campo della ricerca sul cancro, in particolare sulle leucemie e i linfomi. Immaginate delle minuscole macchine molecolari all’interno delle nostre cellule che accendono e spengono geni come interruttori della luce. Queste macchine esistono davvero e si chiamano enzimi epigenetici. Tra questi, c’è una famiglia chiamata istone deacetilasi (HDAC), composta da 18 membri. Per molto tempo, le funzioni specifiche di uno di questi, l’HDAC10, nelle cellule leucemiche sono rimaste un po’ un mistero. Ma noi, spinti dalla curiosità, abbiamo deciso di vederci più chiaro.
Un Interruttore Molecolare per la Sopravvivenza
Quello che abbiamo scoperto è sorprendente: le cellule tumorali derivate da leucemie acute linfoidi (sia a cellule B che T) e da linfomi, sia quelle cresciute in laboratorio che quelle prelevate direttamente dai pazienti, sembrano dipendere criticamente dall’attività dell’HDAC10 per la loro sopravvivenza. È come se HDAC10 fosse un interruttore vitale che deve rimanere acceso perché queste cellule maligne continuino a proliferare.
Per mettere alla prova questa idea, abbiamo utilizzato uno strumento farmacologico specifico, un inibitore chiamato PZ48, che è stato progettato proprio per bloccare l’attività di HDAC10. E i risultati sono stati netti: quando abbiamo trattato queste cellule tumorali linfoidi con PZ48, abbiamo innescato un processo di autodistruzione programmata, noto come apoptosi, mediato da specifiche proteine chiamate caspasi. In pratica, spegnendo HDAC10, abbiamo spinto le cellule tumorali verso il suicidio.
Le cellule più sensibili nel nostro studio sono state le RS4-11 (una linea di leucemia acuta linfoide a precursori B), ma abbiamo visto effetti significativi anche nelle cellule MOLT-4 (linfoblasti T) e Ramos (linfoma di Burkitt). Curiosamente, altre forme di leucemia, come la leucemia mieloide acuta (AML), e cellule normali non tumorali, sembravano non risentire particolarmente del trattamento con PZ48. Questo ci ha suggerito che la dipendenza da HDAC10, che potremmo chiamare “HDAC10ness”, è una caratteristica specifica di alcuni tumori linfoidi.
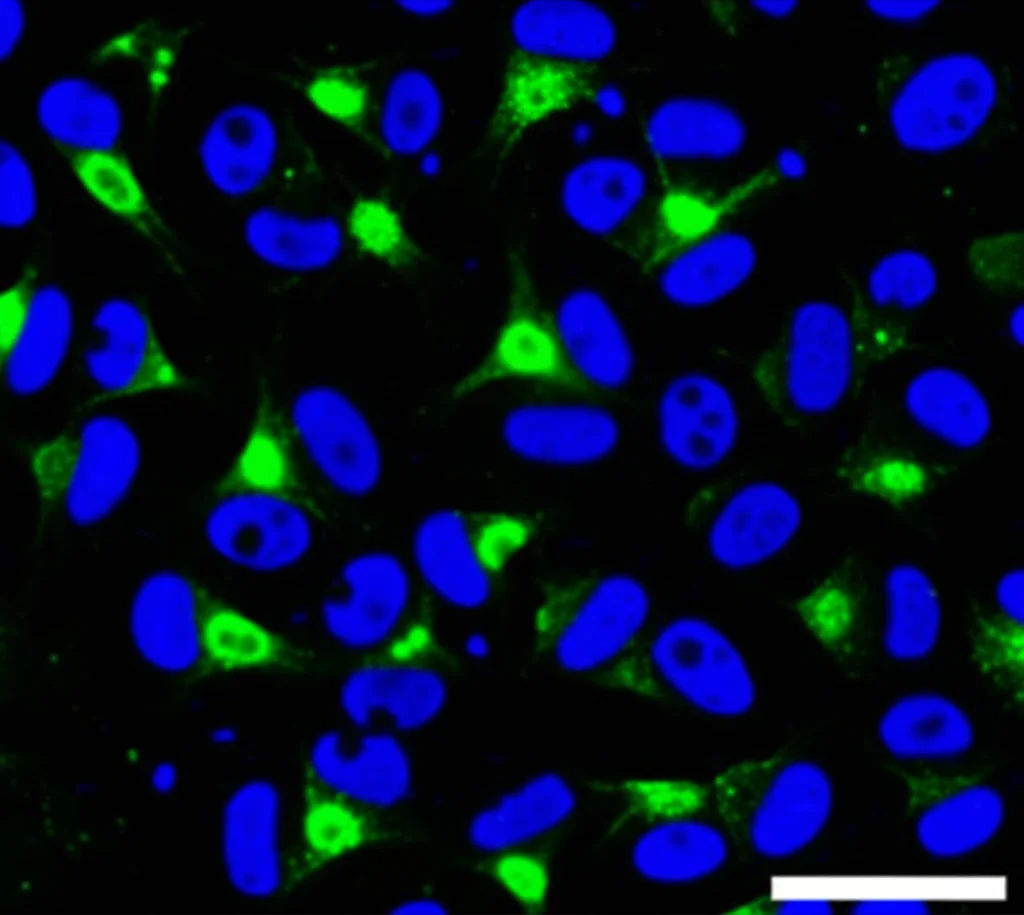
Il Cuore del Meccanismo: L’Asse MYC-POLD1
Ma come fa esattamente HDAC10 a tenere in vita queste cellule? Scavando più a fondo, abbiamo scoperto un meccanismo molecolare intrigante. Sembra che HDAC10 controlli l’espressione di un’altra proteina fondamentale per la replicazione del DNA, la subunità catalitica della DNA polimerasi delta, chiamata POLD1. Questa regolazione avviene attraverso un intermediario molto noto nel mondo dei tumori: il fattore di trascrizione MYC.
In pratica, HDAC10 sembra mantenere attiva una via di segnalazione che coinvolge MYC, il quale a sua volta promuove la produzione di POLD1. La POLD1 è essenziale perché è una delle “operaie” principali che costruiscono nuove copie del DNA quando la cellula si prepara a dividersi. Senza abbastanza POLD1, il processo di replicazione del DNA va in crisi.
E infatti, quando abbiamo inibito HDAC10 con PZ48 nelle cellule sensibili (come le RS4-11), abbiamo osservato una rapida diminuzione sia dei livelli di MYC che di POLD1. Questa riduzione non avveniva, o avveniva in misura molto minore, nelle cellule resistenti (come quelle di AML). Abbiamo anche verificato che non si trattava di un effetto diretto di PZ48 su altre HDAC (come quelle di classe I, IIa o HDAC6/8) né di un’alterazione generale dell’autofagia (un processo di “pulizia” cellulare che HDAC10 può influenzare). Era proprio l’asse HDAC10-MYC-POLD1 ad essere colpito.
Quando il DNA Va in Tilt: Stress e Danno
Cosa succede quando manca POLD1 e la replicazione del DNA si inceppa? Succede quello che chiamiamo stress replicativo. La cellula cerca di copiare il suo DNA ma non ci riesce correttamente, accumulando tratti di DNA a singolo filamento (evidenziati dall’accumulo di foci della proteina p-RPA) e vere e proprie rotture nel DNA.
Abbiamo visto chiaramente questi segni di danno nelle cellule trattate con PZ48:
- Aumento dei foci di p-RPA nel nucleo.
- Accumulo di catene di poli-ADP-ribosio (PAR), un segnale di attivazione massiccia dell’enzima PARP1, spesso legato al danno al DNA e a una forma di morte cellulare chiamata parthanatos.
- Evidenza diretta di lesioni al DNA tramite il “comet assay” (un test che fa assomigliare i nuclei danneggiati a comete).
- Aumento della fosforilazione dell’istone H2AX (ɣH2AX), un altro marcatore classico di danno al DNA, soprattutto nelle fasi G1/S del ciclo cellulare.
Questo accumulo di danno attiva i sistemi di controllo della cellula, le cosiddette “checkpoint kinases” come CHK1 e CHK2, che cercano di fermare il ciclo cellulare per dare tempo alla riparazione. Ma nel caso delle cellule trattate con PZ48, il danno è evidentemente troppo grave, e la cellula viene spinta verso l’apoptosi.
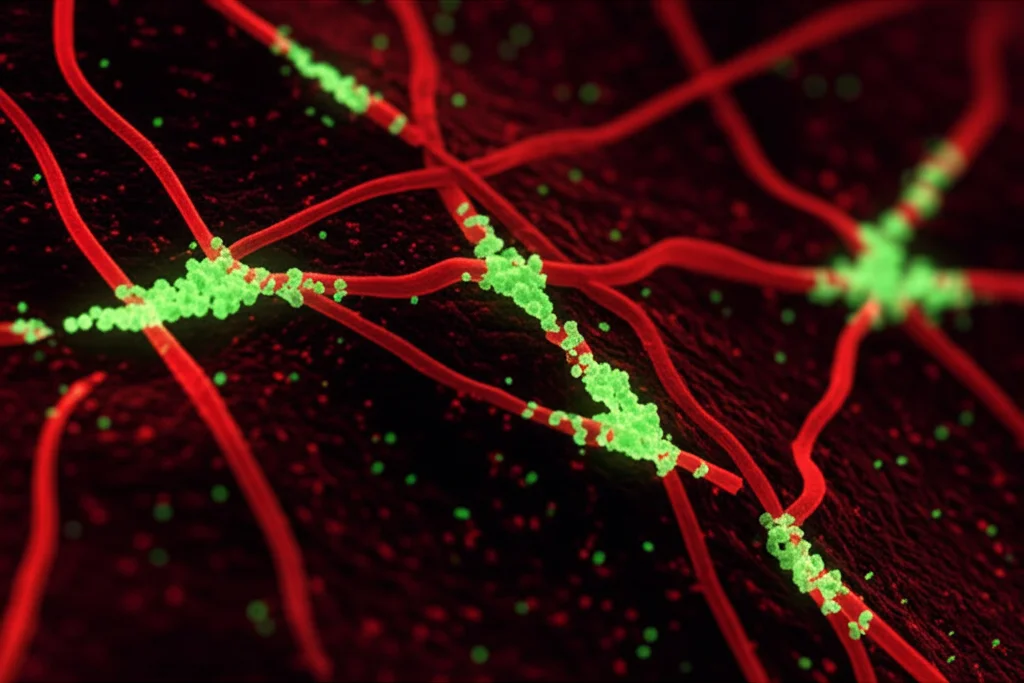
Un aspetto interessante è che questo stress replicativo indotto da PZ48 crea una vulnerabilità specifica. Abbiamo scoperto che combinando PZ48 con un inibitore di CHK1 (prexasertib), l’effetto tossico sulle cellule leucemiche veniva potenziato. Questo suggerisce potenziali strategie terapeutiche combinate.
Buone Notizie: Le Cellule Sane Sono Risparmiate
Ora, la domanda cruciale: questo approccio è sicuro? Se blocchiamo un processo così fondamentale come la replicazione del DNA, non rischiamo di danneggiare anche le cellule sane? Qui arriva la parte più incoraggiante dei nostri risultati.
Abbiamo testato PZ48 su cellule mononucleate del sangue periferico (PBMC) prelevate da donatori sani. Analizzando le diverse popolazioni (linfociti B, linfociti T, cellule NK, monociti, ecc.), non abbiamo osservato un aumento significativo dell’apoptosi, anche a dosi che erano letali per le cellule leucemiche.
Non solo, abbiamo anche stimolato la proliferazione di linfociti B e T sani (simulando una risposta immunitaria) e li abbiamo trattati con PZ48. Anche in questo caso, la loro vitalità non è stata compromessa. Persino le cellule staminali e progenitrici ematopoietiche (le “mamme” di tutte le cellule del sangue), pur mostrando una lieve riduzione nella capacità di formare colonie in vitro, sono state molto meno colpite rispetto alle cellule leucemiche RS4-11.
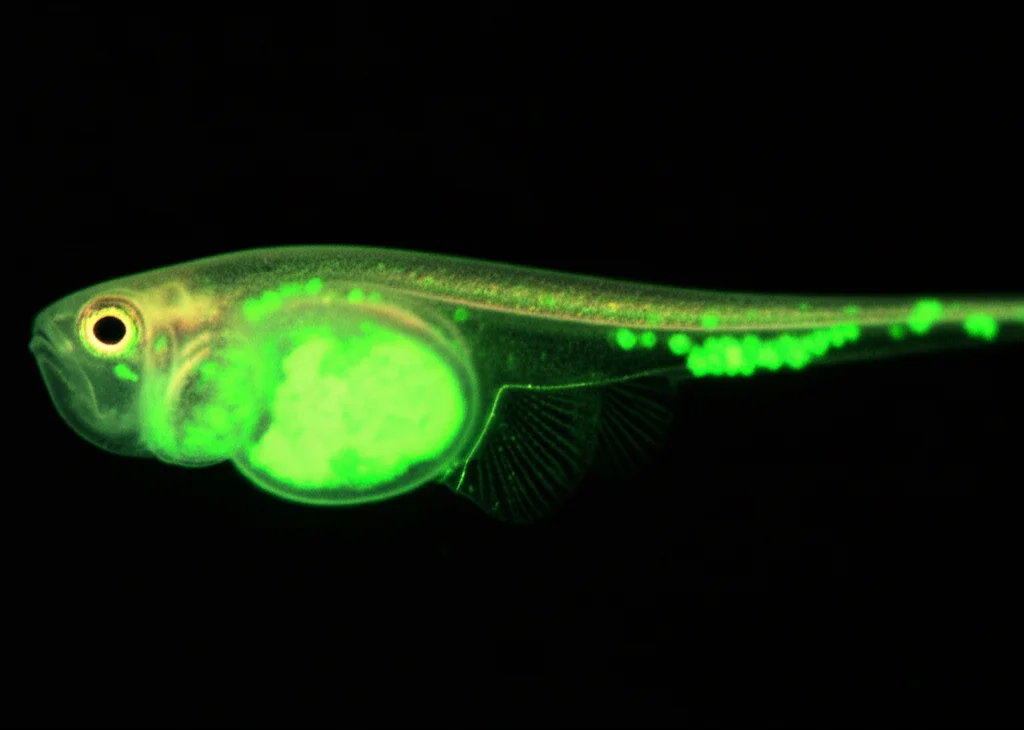
Infine, siamo passati a un modello animale, il piccolo pesce zebra (Danio rerio). Abbiamo iniettato cellule RS4-11 nelle larve trasparenti, creando dei piccoli “tumori”, e poi le abbiamo trattate con PZ48. Abbiamo osservato una chiara attività antitumorale: la crescita delle masse leucemiche è stata rallentata o bloccata in una percentuale significativa di larve trattate con PZ48 rispetto a quelle trattate con il solo solvente, e questo senza segni evidenti di tossicità per le larve stesse.
Verso Nuove Terapie? Implicazioni e Prospettive Future
Cosa significa tutto questo? I nostri dati rivelano una funzione nucleare inaspettata per HDAC10: agisce come un controllore cruciale dell’asse MYC-POLD1, garantendo così la corretta processività della replicazione del DNA e l’integrità del genoma nelle cellule maligne di origine linfoide. Questa dipendenza specifica, questa “HDAC10ness”, potrebbe rappresentare un tallone d’Achille da sfruttare terapeuticamente.
L’idea di usare inibitori di HDAC nel trattamento dei tumori del sangue non è nuova. Farmaci come vorinostat, romidepsin e chidamide sono già approvati per alcuni tipi di linfoma o mieloma. Tuttavia, spesso questi farmaci colpiscono più HDAC contemporaneamente (sono pan-inibitori o inibitori di classe) e possono causare effetti collaterali significativi. La speranza è che inibitori più selettivi, come potrebbe essere PZ48 o suoi derivati futuri mirati specificamente a HDAC10, possano offrire un’efficacia mirata con una minore tossicità per le cellule sane, come suggerito dai nostri dati preclinici.
Abbiamo anche identificato dei potenziali biomarcatori per monitorare l’efficacia di questi inibitori: la diminuzione di MYC e POLD1 e l’aumento dei segnali di stress replicativo (come ɣH2AX o PAR) potrebbero indicare che il farmaco sta colpendo il bersaglio nelle cellule tumorali.
Certo, la strada verso la clinica è ancora lunga. Bisognerà capire meglio perché alcune cellule leucemiche (come quelle AML) sono resistenti, forse a causa di altre vie di segnalazione iperattive che bypassano la necessità di HDAC10. Sarà importante valutare la sicurezza a lungo termine e l’efficacia in modelli preclinici più complessi e, infine, negli studi clinici sull’uomo.
Ma quello che abbiamo scoperto apre una finestra affascinante sulla biologia di HDAC10 e suggerisce che colpire questo enzima potrebbe essere una strategia promettente per trattare leucemie e linfomi linfoidi aggressivi, malattie per le quali, soprattutto negli adulti o nei casi di recidiva, c’è ancora un disperato bisogno di nuove opzioni terapeutiche più efficaci e meno tossiche. È un esempio perfetto di come la ricerca di base, cercando di capire i meccanismi molecolari più intimi delle cellule, possa portare a intuizioni con un potenziale impatto clinico reale. E noi continueremo a indagare!
Fonte: Springer







