Decifrare la Guarigione: Un’Avventura tra Lipidi Spaziali e Proteine Temporali
Ciao a tutti! Avete mai pensato a quanto sia incredibile il processo di guarigione di una ferita? La nostra pelle, l’organo più esteso che abbiamo, è una barriera formidabile contro minacce esterne come batteri e stimoli vari. Quando questa barriera viene danneggiata, il corpo mette in moto un meccanismo complesso e affascinante per ripararla il più velocemente possibile. Questo processo, chiamato guarigione delle ferite, coinvolge un’orchestra di cellule diverse, come neutrofili e macrofagi, e si svolge in tre fasi principali che si sovrappongono: infiammazione, proliferazione e rimodellamento.
Sembra tutto molto ordinato, vero? Peccato che a volte qualcosa vada storto. Se questo delicato balletto molecolare si interrompe, possiamo ritrovarci con ferite croniche, ulcere o cicatrici eccessive. Pensate che le ferite croniche affliggono milioni di persone, specialmente con l’aumento del diabete e l’invecchiamento della popolazione, e i costi per trattarle superano i 25 miliardi di dollari all’anno solo negli Stati Uniti! È chiaro che capire a fondo cosa succede a livello molecolare è fondamentale per sviluppare terapie più efficaci.
Negli ultimi anni abbiamo fatto passi da gigante, ma una comprensione molecolare completa ci sfugge ancora. Sappiamo molto sulle proteine coinvolte, grazie a tante ricerche, ma l’interazione tra queste proteine e altri attori cruciali, come i lipidi, è ancora in gran parte un mistero.
Entra in Scena la Spettrometria di Massa
Qui entra in gioco la mia passione: la spettrometria di massa, e in particolare una sua evoluzione chiamata Mass Spectrometry Imaging (MSI). Questa tecnica è pazzesca perché ci permette di “vedere” dove si trovano diverse molecole direttamente nel tessuto, senza bisogno di etichette o marcatori. È come avere una mappa molecolare! Tuttavia, la MSI tradizionale ha un limite: di solito analizza sezioni 2D del tessuto, ma i processi biologici, come la guarigione, avvengono in 3D! È come cercare di capire un intero edificio guardando solo una planimetria.
Per superare questo limite, stiamo esplorando la MSI tridimensionale (3D MSI). Le tecniche tradizionali per il 3D spesso richiedono di tagliare il campione in fettine sottili (sezionamento seriale), un processo che può far perdere informazioni preziose e rendere difficile ricostruire un’immagine 3D accurata.
La Nostra Arma Segreta: IR-MALDESI
Nel nostro laboratorio, abbiamo adottato un approccio diverso e, lasciatemelo dire, piuttosto elegante: l’IR-MALDESI (Infrared Matrix-Assisted Laser Desorption Electrospray Ionization). È una tecnica di ionizzazione ambientale ibrida che usa un laser infrarosso per “scavare” delicatamente nel campione, strato dopo strato. Ad ogni passaggio del laser, analizziamo le molecole presenti su quella superficie, permettendoci di ricostruire un’immagine 3D precisa senza dover affettare fisicamente il tessuto. Abbiamo già dimostrato che funziona bene sia su campioni “duri” come farmaci da banco, sia su tessuti biologici “morbidi”, senza bisogno di preparazioni complesse.
Un Approccio Multi-Omico: Lipidi e Proteine Insieme
Capire la guarigione delle ferite richiede un approccio olistico, quello che chiamiamo multi-omico. Non basta guardare solo le proteine o solo i lipidi; dobbiamo vedere come interagiscono. I lipidi, nonostante siano fondamentali per la funzione della pelle (pensate ai fosfolipidi e agli sfingolipidi nelle membrane cellulari o agli eicosanoidi come le prostaglandine nell’infiammazione), sono stati un po’ trascurati negli studi spaziali sulla guarigione. Allo stesso tempo, la proteomica (lo studio su larga scala delle proteine) ci ha dato informazioni preziose su potenziali bersagli terapeutici e marcatori di guarigione, come elastasi, fattori di crescita e metalloproteasi (MMP-2, MMP-9).
Il problema è che studi che integrano lipidomica e proteomica, specialmente con una dimensione spaziale, sono ancora rari. Recenti progressi negli approcci multi-omici, però, stanno iniziando a colmare questa lacuna, rivelando come metabolismo e lipidomica varino a seconda del tipo di cellula e della localizzazione nel tessuto, sia in condizioni normali che patologiche.
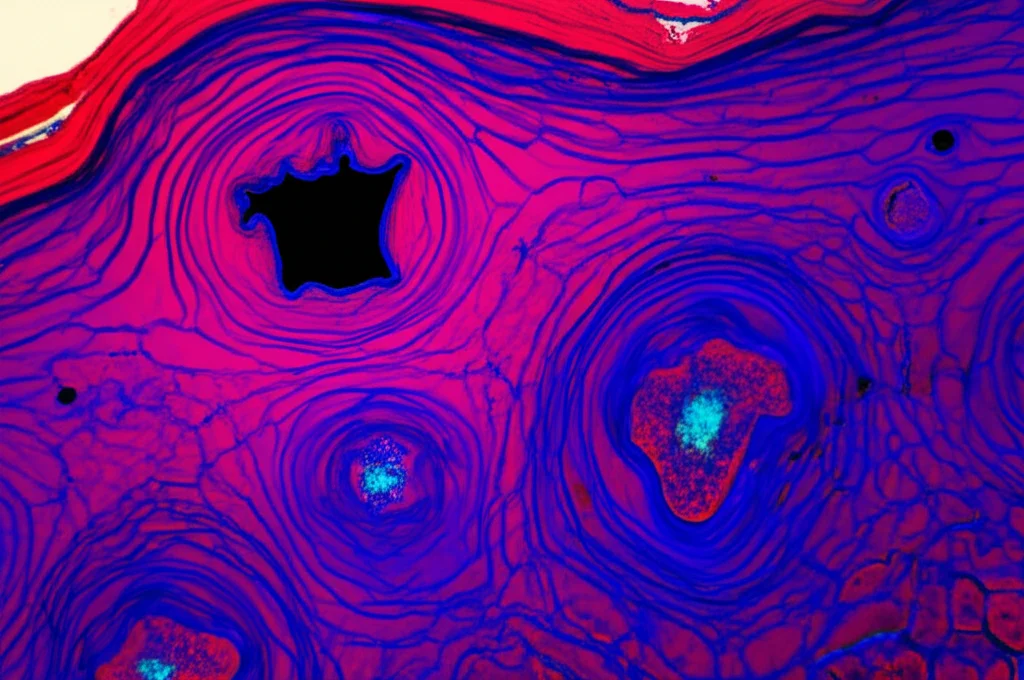
Il Nostro Studio: Un Modello Murino Sotto la Lente
Nel nostro studio, abbiamo deciso di applicare questo approccio integrato per studiare la guarigione delle ferite in un modello murino (topi SKH-1). Abbiamo creato delle piccole ferite sulla schiena dei topi e abbiamo raccolto campioni in tre momenti chiave:
- Giorno 4: Fase di infiammazione
- Giorno 14: Fase di proliferazione
- Giorno 21: Fase di rimodellamento
Abbiamo anche raccolto campioni di pelle sana come controllo.
Per ogni campione, abbiamo prelevato una piccola biopsia dal centro della ferita per l’analisi proteomica (usando la tecnica LC-MS bottom-up dopo un’accurata preparazione del campione con il metodo FASP). La parte rimanente del campione è stata analizzata con la nostra 3D IR-MALDESI MSI per mappare la distribuzione dei lipidi nello spazio. L’idea era combinare queste due “mappe” – quella spaziale dei lipidi e quella temporale delle proteine – per ottenere una visione più profonda delle complessità molecolari della rigenerazione tissutale.
Mettere a Fuoco il 3D: La Risoluzione Z
Una delle sfide tecniche della 3D IR-MALDESI è mantenere il laser a fuoco mentre “scava” nel campione. Il fascio laser ha un profilo gaussiano e tende a perdere la focalizzazione man mano che si rimuove materiale. Perciò, prima di tutto, dovevamo determinare la nostra “risoluzione Z”, cioè quanto in profondità scava il laser ad ogni passaggio. Abbiamo fatto degli esperimenti preliminari su biopsie di pelle sana, misurando la profondità dei “crateri” creati dal laser dopo un certo numero di strati usando un microscopio confocale. Abbiamo scoperto che, con l’energia laser che usavamo (tra 0.4 e 0.5 mJ), la risoluzione Z era di circa 9 µm per strato. Questa informazione è stata cruciale per poter regolare automaticamente l’altezza del campione durante l’imaging 3D e mantenere il laser sempre a fuoco.
Per verificare la riproducibilità della nostra tecnica, abbiamo poi eseguito un esperimento di imaging dettagliato su 40 strati su biopsie provenienti da tre topi sani diversi. Abbiamo usato il colesterolo come molecola di riferimento. Le mappe di calore 3D hanno mostrato una distribuzione del colesterolo molto consistente tra i campioni, con un’abbondanza che diminuiva dall’epidermide (lo strato più esterno) all’ipoderma (lo strato più profondo), nonostante piccole variazioni dovute alla naturale irregolarità della pelle dei topi. Questo ci ha confermato che il nostro sistema IR-MALDESI era affidabile per studi biologici.
Cosa ci Dicono i Lipidi: Uno Sguardo all’Infiammazione
Confrontando gli spettri dei campioni di ferita al giorno 4 (infiammazione) con quelli della pelle sana, abbiamo notato subito delle differenze interessanti, specialmente nell’epidermide. C’era un aumento notevole di ceramidi (Cer), fosfatidilcoline (PC) e fosfatidiletanolamine (PE) nella pelle ferita. Le ceramidi sono fondamentali per la barriera cutanea (strato corneo); un loro aumento potrebbe indicare un’intensa attività di riparazione della barriera e una modulazione della risposta infiammatoria. Abbiamo anche osservato un leggero aumento di ceramide-1-fosfato (C1P), una molecola nota per il suo ruolo nella mobilità dei fibroblasti e nella mediazione dell’infiammazione.
Nello strato più profondo, il derma, ricco di ghiandole sebacee, abbiamo visto un aumento di digliceridi (DG) e trigliceridi (TG) nella pelle ferita. I DG sono intermedi nel metabolismo lipidico e potrebbero influenzare segnali cellulari legati all’infiammazione e alla riparazione. I TG sono importanti per l’energia (possono essere convertiti in ATP per alimentare il processo di riparazione) e forse anche per l’immunità adattativa, anche se il loro ruolo specifico nella guarigione è ancora poco esplorato.
Analizzando i lipidi unici di ogni strato e usando strumenti bioinformatici (LipidMaps e LIPEA), abbiamo visto che le vie metaboliche più significativamente alterate si trovavano prevalentemente nell’epidermide. Questo suggerisce che, sebbene i cambiamenti lipidici avvengano in tutto l’ambiente della ferita, l’epidermide è il vero “centro metabolico” durante la guarigione, probabilmente per il suo ruolo attivo nella rigenerazione cellulare e nel ripristino della barriera.

E le Proteine? La Dimensione Temporale
Passiamo ora alla proteomica. Questa analisi ci ha permesso di vedere come cambia il panorama proteico nel tempo, durante le diverse fasi della guarigione. Usando una tecnica chiamata Analisi delle Componenti Principali (PCA), abbiamo visto che ogni fase della guarigione (infiammazione, proliferazione, rimodellamento) ha una “firma” proteomica distinta e si raggruppa separatamente, un po’ come già osservato in studi su campioni umani. La fase di infiammazione (giorno 4) spiccava in modo particolare, con un profilo unico caratterizzato da mediatori pro-infiammatori, marcatori di cellule immunitarie ed enzimi legati allo stress ossidativo. Questa fase è chiaramente un momento critico, un crocevia metabolico che imposta il tono per tutto il processo successivo.
Interessante notare che, nonostante queste differenze, un diagramma di Venn ha mostrato che la stragrande maggioranza delle proteine identificate (oltre l’88%) era presente in tutte le fasi e anche nella pelle sana. Questo ci dice una cosa importante: non è tanto la presenza o assenza di singole proteine a guidare le fasi della guarigione, quanto piuttosto la loro abbondanza relativa e i cambiamenti dinamici all’interno della rete proteica.
Durante la fase infiammatoria, abbiamo identificato 27 proteine espresse in modo unico. Tra queste, diversi membri della famiglia SPRR (Small Proline-Rich Protein), noti per il mantenimento dell’omeostasi epidermica, e membri della famiglia Rho GTPase Activating Protein, coinvolti nel rimodellamento del citoscheletro durante la riparazione cellulare e l’attivazione immunitaria. Curiosamente, due proteine uniche dell’infiammazione erano legate al metabolismo lipidico: Pla2g4e (una fosfolipasi che rilascia acido arachidonico, precursore di mediatori infiammatori) e ApoM (un’apolipoproteina che regola la sfingosina-1-fosfato, S1P, cruciale nel signaling infiammatorio). Questo suggerisce un ruolo potenziale del metabolismo lipidico nel coordinare la risposta infiammatoria, un punto che merita ulteriori indagini.
Analizzando le proteine sovra o sotto-regolate in ogni fase rispetto alla pelle sana (usando i Volcano plots), abbiamo confermato che l’infiammazione è la fase con i cambiamenti più drastici (oltre 1300 proteine sotto-regolate e quasi 700 sovra-regolate!). L’analisi funzionale (Gene Ontology) ha mostrato che durante l’infiammazione erano arricchiti termini legati alla risposta immunitaria e alla coagulazione; durante la proliferazione, termini legati alla respirazione cellulare e produzione di ATP (coerente con l’intensa attività cellulare); e durante il rimodellamento, termini legati alla risposta immunitaria adattativa e all’attivazione dei linfociti T, importanti per la rigenerazione tissutale finale.
Mettere Tutto Insieme: La Magia dell’Integrazione e il Percorso dell’Acido Arachidonico
Ed eccoci al punto cruciale: integrare i dati di lipidomica e proteomica. Visto che la proteomica indicava l’infiammazione come fase chiave, ci siamo concentrati sulle proteine sovra-regolate in quel momento. Usando un database specifico (LMPD), abbiamo identificato tra queste le proteine legate ai lipidi. Abbiamo trovato proteine coinvolte nella biosintesi di membrane (PC, SP), nel trasporto di lipidi (FABP) e nel signaling lipidico, in particolare nella via della PI3K, spesso associata all’attività di neutrofili e macrofagi.
Ma la scoperta più interessante è stata un gruppo di proteine (segnate in corsivo nella Tabella 2 del lavoro originale) che appartengono tutte alla via metabolica dell’acido arachidonico. Questo percorso è fondamentale nell’infiammazione ed è stato già ampiamente studiato nella guarigione delle ferite. L’acido arachidonico, rilasciato dalle membrane cellulari da enzimi come la fosfolipasi A2 (che abbiamo visto essere unica nell’infiammazione!), può prendere due strade principali:
- Una porta alla formazione di prostaglandine e trombossani (spesso con ruoli anti-infiammatori o di regolazione), grazie all’enzima PGH2 sintasi.
- L’altra, grazie all’enzima Alox5 (5-lipossigenasi), porta alla formazione di leucotrieni, come il leucotriene A4 (LTA4) e il leucotriene B4 (LTB4), potenti mediatori pro-infiammatori.
La nostra analisi proteomica ha mostrato un aumento degli enzimi chiave di entrambe le vie durante l’infiammazione, in particolare Alox5 e LTA4h (l’enzima che converte LTA4 in LTB4). Questo si sposava perfettamente con i dati della lipidomica 3D: abbiamo osservato livelli più alti di acido arachidonico e, soprattutto, di leucotriene A4 nei campioni di ferita rispetto alla pelle sana. L’aumento degli enzimi Alox5 e LTA4h (proteomica) spiegava l’aumento del LTA4 (lipidomica) nell’ambiente pro-infiammatorio della ferita. Questo esempio dimostra magnificamente come l’integrazione multi-omica ci permetta di connettere i puntini tra i cambiamenti proteici e quelli lipidici, offrendo una visione molto più completa e dinamica del processo.
Conclusioni e Prospettive Future
Questo lavoro, combinando la lipidomica spaziale 3D con la proteomica temporale, ci ha offerto una nuova lente per osservare la complessità molecolare della guarigione delle ferite. Abbiamo sottolineato il ruolo cruciale dell’infiammazione e l’intensa attività metabolica dell’epidermide, dettagli che un approccio non spaziale avrebbe potuto mancare. L’analisi integrata della via dell’acido arachidonico ha validato ulteriormente il potere di questo approccio multi-omico.
Certo, ci sono limitazioni. Abbiamo analizzato un numero limitato di campioni e ci siamo concentrati principalmente sulle proteine legate ai lipidi, tralasciando potenzialmente altri attori importanti. Inoltre, la delocalizzazione verticale degli analiti in 3D MSI rimane una potenziale preoccupazione da affrontare in studi futuri. Tuttavia, crediamo che questa metodologia abbia un grande potenziale non solo per la guarigione delle ferite, ma per studiare molti altri fenomeni biologici complessi. Il futuro è sicuramente nell’integrazione di ancora più livelli “omici” (genomica, trascrittomica, metabolomica) per dipingere un quadro molecolare sempre più completo e dettagliato. La strada è ancora lunga, ma ogni passo ci avvicina a comprendere – e un giorno, forse, a controllare meglio – processi vitali come la guarigione.
Fonte: Springer







