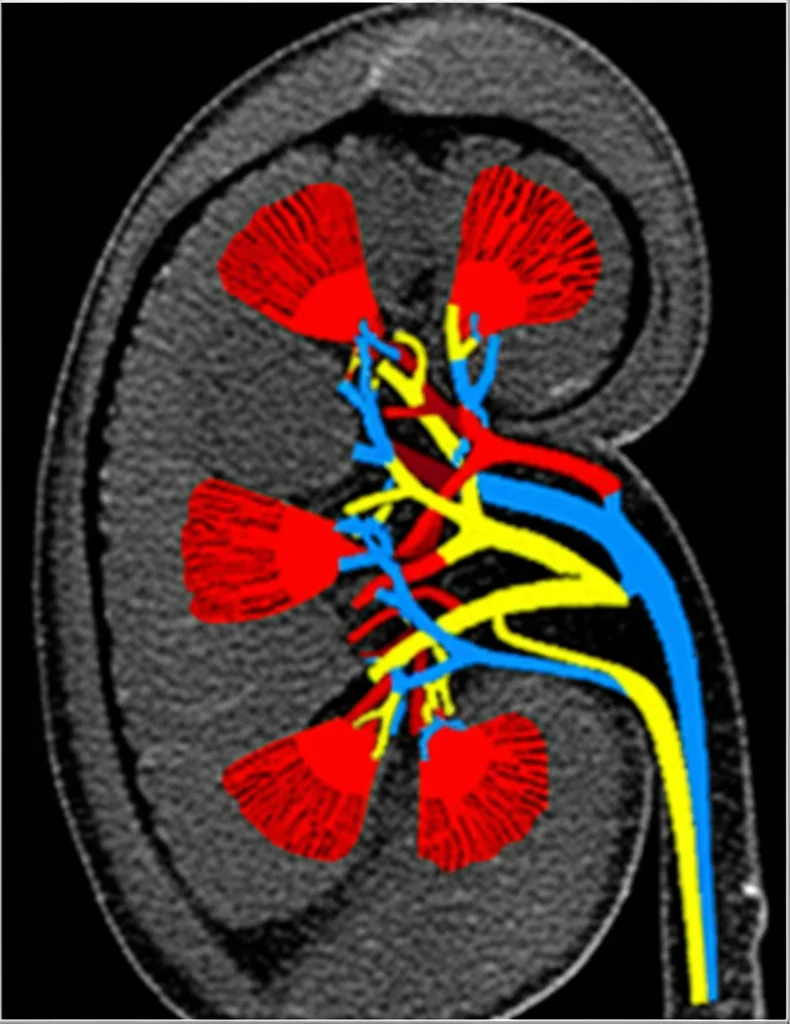
Grasso nei Reni e Diabete Tipo 2: Cosa ci Svela la Risonanza Magnetica?
Ciao a tutti! Oggi voglio parlarvi di qualcosa di affascinante e, purtroppo, molto comune: il diabete di tipo 2 (T2DM) e una delle sue complicanze più temute, la malattia renale diabetica (DKD). Sapete, questa condizione colpisce una fetta enorme di pazienti diabetici, tra il 20% e il 40%, ed è una delle cause principali di malattia renale allo stadio terminale. Un vero problema di salute pubblica!
Ma cosa succede esattamente ai nostri reni quando il diabete entra in gioco? Una delle cose che si alterano è la capacità dei reni di regolare il proprio flusso sanguigno. Già nelle fasi iniziali della DKD si notano cambiamenti nell’emodinamica renale, cioè nel modo in cui il sangue circola all’interno di questi organi vitali. Capire perché il flusso sanguigno renale (RBF) si riduce e cosa lo influenza è fondamentale.
Il Grasso “Fuori Posto”: Un Nuovo Sospettato
Recentemente, abbiamo iniziato a guardare con sospetto a un fattore chiamato “malattia del rene grasso” (FKD). No, non sto scherzando! Si tratta proprio dell’accumulo di tessuto adiposo all’interno e intorno ai reni: nel seno renale, nell’ilo (il punto dove entrano vasi e nervi) e persino nel parenchima, il tessuto funzionale del rene.
Nei pazienti con diabete di tipo 2, sembra che questo grasso “ectopico” (cioè fuori posto) giochi un ruolo chiave nel ridurre la perfusione renale. Come? Immaginate questo grasso che si accumula intorno all’ilo e al seno renale: può letteralmente comprimere le arterie, riducendo l’afflusso di sangue. Non solo, il grasso intorno al rene (perirenale) e negli spazi vicini (pararenale) può schiacciare il rene stesso e i suoi vasi, aumentando la pressione interna e ostacolando ulteriormente il flusso.
Ma non finisce qui. Il grasso può accumularsi anche sotto forma di goccioline lipidiche direttamente nelle strutture filtranti del rene (i glomeruli), nel tessuto interstiziale e nei tubuli. Questo accumulo è stato collegato a danni morfologici e funzionali. Il grasso nel parenchima non solo comprime meccanicamente, ma ha anche effetti “lipotossici” e produce sostanze (adipochine) che promuovono infiammazione e vasocostrizione. Tutto questo porta a disfunzione delle cellule chiave del rene (podociti) e a sclerosi dei glomeruli, alterando l’emodinamica. Le biopsie renali hanno confermato questa deposizione di grasso ectopico, ma i meccanismi precisi e la relazione con la perfusione renale non sono ancora del tutto chiari. Ecco perché c’è un bisogno urgente di indagare!
La Risonanza Magnetica Quantitativa: Uno Sguardo Dentro il Rene
Come possiamo studiare questi fenomeni senza dover ricorrere a metodi invasivi come la biopsia? Qui entra in gioco la risonanza magnetica (MRI) quantitativa! Negli ultimi anni, le tecniche di MRI renale hanno fatto passi da gigante, permettendoci di “vedere” e misurare cose incredibili.
Due tecniche in particolare si sono rivelate preziose per il nostro scopo:
- Arterial Spin Labeling (ASL): Questa tecnica usa le molecole d’acqua del nostro stesso sangue come tracciante naturale. Marcando magneticamente l’acqua nel sangue arterioso prima che raggiunga il rene, possiamo misurare quanto sangue sta effettivamente arrivando e perfondendo il tessuto renale. Ci dà un valore quantitativo del flusso sanguigno renale (RBF), espresso in mL/100g/min, senza bisogno di mezzi di contrasto! È una tecnica non invasiva, riproducibile e già validata per lo studio dei reni.
- IDEAL-IQ (Iterative Decomposition of Water and Fat with Echo Asymmetry and Least-squares Estimation-Iron Quantification): Un nome complicato, lo so! Ma questa sequenza MRI è fantastica per misurare la frazione di grasso presente nel parenchima renale (Proton Density Fat Fraction – PDFF). È veloce, affidabile e non viene confusa dalla presenza di ferro, dandoci una misura precisa del grasso ectopico.
Armati di queste potenti tecniche, abbiamo deciso di usarle per valutare come progredisce il danno emodinamico nei pazienti con T2DM e per capire l’impatto del grasso ectopico renale sul flusso sanguigno.
Il Nostro Studio: Cosa Abbiamo Fatto e Scoperto
Abbiamo reclutato un gruppo di volontari sani e pazienti con T2DM, questi ultimi suddivisi in base allo stadio della loro funzione renale (valutata tramite l’eGFR – velocità di filtrazione glomerulare stimata): T2DM senza DKD significativa, DKD stadio I-II e DKD stadio III-IV. Tutti i partecipanti sono stati sottoposti a MRI quantitativa per misurare RBF e PDFF nella corteccia e nella midollare del rene (le due parti principali del parenchima), oltre allo spessore del grasso perirenale.
I risultati sono stati illuminanti!
- Differenze Chiare tra i Gruppi: Abbiamo osservato una progressione chiara: i volontari sani avevano il flusso sanguigno (RBF) più alto e la quantità di grasso (PDFF e spessore perirenale) più bassa. Man mano che si passava dai pazienti T2DM senza DKD agli stadi più avanzati di DKD, l’RBF diminuiva costantemente, mentre il grasso (sia nel parenchima che intorno al rene) aumentava significativamente. In pratica: più avanzata la malattia renale, meno sangue arriva ai reni e più grasso si accumula.
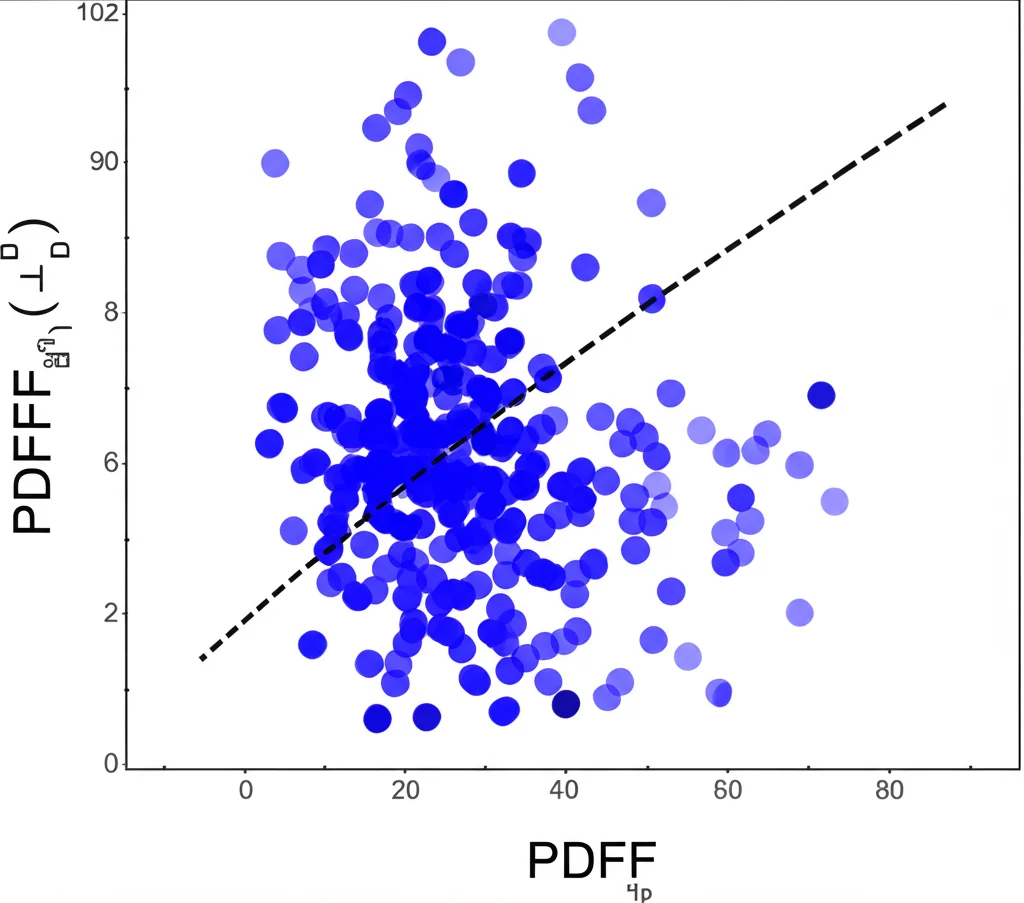
- Il Legame Cruciale: Grasso vs Flusso: La scoperta forse più importante è stata la forte correlazione negativa tra la quantità di grasso nel parenchima renale (PDFF) e il flusso sanguigno renale (RBF). Più grasso c’era, meno sangue circolava. Questo vale sia per la corteccia che per la midollare.
- Conferma con i Parametri Clinici: Le nostre misure MRI si correlavano bene con i parametri di laboratorio standard della funzione renale. Ad esempio, un PDFF più alto e un RBF più basso erano associati a un eGFR inferiore (peggior funzione renale) e a livelli più alti di creatinina sierica (Scr) e microalbuminuria (segni di danno renale).
- Potere Diagnostico dell’MRI: Le misure MRI si sono dimostrate molto efficaci nel distinguere i diversi gruppi. Ad esempio, l’RBF della midollare era eccellente per distinguere i pazienti T2DM con DKD da quelli senza, mentre il PDFF corticale era il migliore per separare gli stadi precoci (I-II) da quelli più avanzati (III-IV) di DKD.
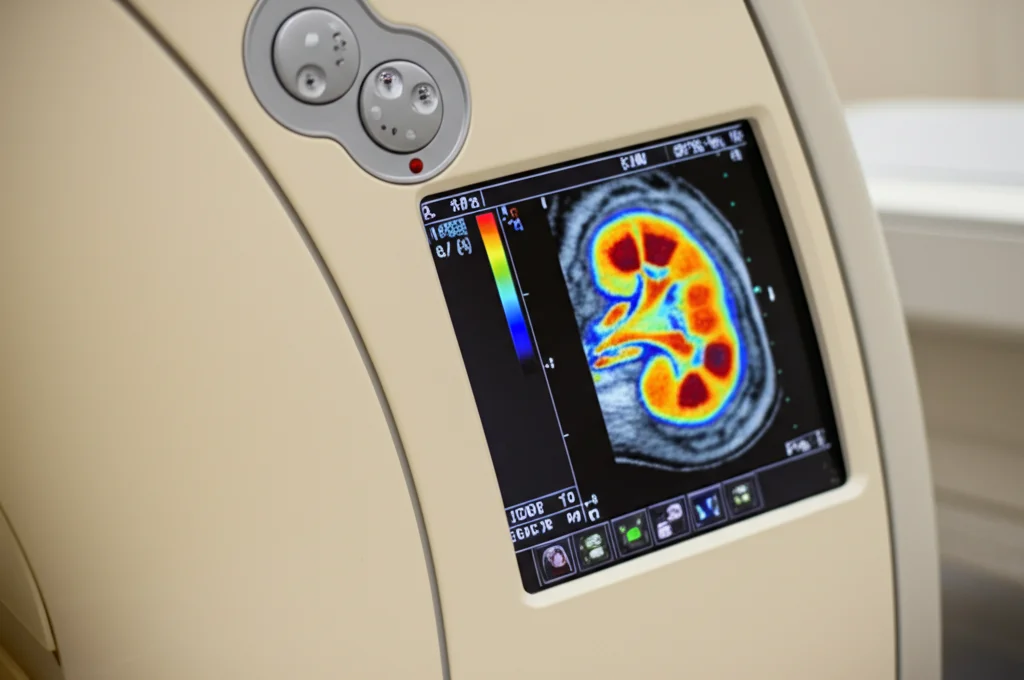
Perché Tutto Questo è Importante?
Questi risultati suggeriscono fortemente che l’accumulo di grasso ectopico nei reni non è un semplice spettatore passivo, ma un attore protagonista nel danno renale associato al diabete. Sembra essere un fattore di rischio importante per il danno emodinamico, contribuendo alla riduzione del flusso sanguigno che, a sua volta, peggiora la funzione renale.
La bellezza della risonanza magnetica quantitativa (ASL + IDEAL-IQ) è che ci permette di vedere e misurare questi cambiamenti precocemente e in modo non invasivo. Potrebbe diventare uno strumento potentissimo per:
- Diagnosi Precoce: Identificare i pazienti a rischio di sviluppare o peggiorare la DKD prima che i test standard mostrino alterazioni significative.
- Monitoraggio della Malattia: Seguire l’evoluzione della malattia e la risposta alle terapie.
- Sviluppo di Nuovi Farmaci: Fornire biomarcatori utili per testare nuove terapie mirate a ridurre il grasso renale o a migliorare la perfusione.
- Stratificazione del Rischio: Capire meglio quali pazienti sono a maggior rischio di progressione rapida.
Pensateci: poter “fotografare” il flusso sanguigno e il grasso nei reni senza radiazioni o contrasto è un enorme passo avanti! Ci dà informazioni fisiologiche dettagliate che prima erano difficili da ottenere.
Uno Sguardo al Futuro
Certo, come ogni studio, anche il nostro ha delle limitazioni. Abbiamo usato un disegno trasversale (una “fotografia” in un dato momento) e misurato i parametri su una singola sezione del rene. Serviranno studi longitudinali (che seguono i pazienti nel tempo) e su coorti più ampie per confermare il valore prognostico di questi marcatori e il loro potenziale per guidare le terapie.
In Conclusione
Il nostro lavoro dimostra che la risonanza magnetica quantitativa, combinando ASL per il flusso sanguigno e IDEAL-IQ per il grasso, è uno strumento clinico utilissimo per valutare il danno renale e la progressione della malattia nei pazienti con diabete di tipo 2. Abbiamo trovato una correlazione significativa tra ridotta perfusione renale, aumentato accumulo di grasso ectopico e peggioramento della DKD. Questo suggerisce che questi fattori lavorano insieme nel danneggiare i reni e che il grasso ectopico è un fattore di rischio indipendente per il danno emodinamico.
Insomma, questa storia del grasso “sbagliato” nei reni è più seria di quanto potessimo pensare, ma grazie a tecnologie come l’MRI quantitativa, abbiamo nuovi modi per vederla, capirla e, speriamo, combatterla meglio in futuro!
Fonte: Springer