PD-L1 e i suoi “zuccheri”: il segreto per un’immunoterapia più efficace contro il cancro?
Ciao a tutti! Oggi voglio parlarvi di una cosa super affascinante che sta venendo fuori nel mondo della ricerca sul cancro, qualcosa che potrebbe davvero cambiare le carte in tavola per l’immunoterapia. Parliamo di una proteina birichina chiamata PD-L1 e di come i suoi “vestiti” di zucchero, un processo chiamato N-glicosilazione, possano influenzare l’efficacia delle terapie che mirano a risvegliare il nostro sistema immunitario contro i tumori.
Come forse saprete, il pathway PD-L1/PD-1 è una specie di “freno di sicurezza” per il nostro sistema immunitario. PD-L1, spesso presente sulle cellule tumorali, si lega a PD-1 sulle nostre cellule T (i soldati del sistema immunitario), dicendo loro: “Ehi, calmi tutti, sono uno di voi, non attaccate!”. Questo è un meccanismo che i tumori sfruttano abilmente per sfuggire alla distruzione. L’immunoterapia, in particolare i bloccanti del checkpoint immunitario (ICB), cerca di tagliare questo filo di comunicazione, permettendo alle cellule T di fare il loro lavoro.
Il problema? Non tutti i pazienti rispondono a queste terapie, e anche quando lo fanno, la risposta può variare tantissimo. Capire perché è la sfida del momento. Ed è qui che entra in gioco la N-glicosilazione.
Ma cos’è questa N-glicosilazione di PD-L1?
Immaginate PD-L1 come una proteina che può indossare diversi “cappotti” fatti di molecole di zucchero. Questi cappotti vengono attaccati in punti specifici della proteina, chiamati siti di N-glicosilazione. Nel caso di PD-L1 umano, ce ne sono quattro principali: N35, N192, N200 e N219. Sembra un dettaglio, vero? E invece, come abbiamo scoperto, questi “cappotti” influenzano tantissimo come PD-L1 si comporta, come interagisce con PD-1 e, soprattutto, come risponde agli anticorpi terapeutici.
Nel nostro studio, ci siamo messi a giocare un po’ con questi siti di glicosilazione. Abbiamo creato delle versioni “mutanti” di PD-L1: alcune con un solo sito di glicosilazione modificato (ad esempio, N35A, dove la ‘A’ sta per alanina, un amminoacido che impedisce l’attacco dello zucchero) e una versione completamente “nuda”, senza nessuno zucchero attaccato (l’abbiamo chiamata Nx4).
Cosa abbiamo scoperto? Preparatevi, perché è interessante!
Abbiamo usato un sistema fighissimo chiamato IcAR-PD1, che in pratica ci dice quanto forte è l’interazione tra PD-L1 e PD-1. E poi abbiamo testato l’efficacia di anticorpi anti-PD-L1 (come Atezolizumab, Durvalumab, Avelumab) e anti-PD-1 (Pembrolizumab, Nivolumab, Cemiplimab) su diverse linee cellulari tumorali umane (cellule di cancro al seno, melanoma e carcinoma polmonare) che esprimevano queste varianti di PD-L1.
Ecco i punti salienti:
- Il mutante PD-L1N35A (quello senza zucchero sul sito N35) si è rivelato un osso duro. Gli anticorpi, sia anti-PD-L1 che anti-PD-1, facevano molta più fatica a bloccare il suo legame con PD-1. Era come se questo specifico “cappotto mancante” rendesse PD-L1 più sfuggente o resistente al blocco.
- Al contrario, il mutante PD-L1Nx4 (quello completamente “nudo”, senza zuccheri) ha mostrato una risposta fantastica! Gli anticorpi riuscivano a bloccare l’interazione PD-L1/PD-1 con grandissima efficacia, anche a concentrazioni bassissime. Questo suggerisce che l’assenza totale di glicosilazione rende PD-L1 un bersaglio molto più facile per le terapie.
- In generale, la presenza di zuccheri su tutti e quattro i siti sembrava interferire con la capacità degli anticorpi di fare il loro lavoro.
Questi risultati sono stati poi confermati con esperimenti ex vivo usando cellule T CD8+ umane, i veri killer del nostro sistema immunitario. Abbiamo visto che la capacità di queste cellule T di attivarsi e uccidere le cellule tumorali era influenzata dallo stato di glicosilazione di PD-L1 e dalla capacità degli ICB di bloccare l’interazione.

Il ruolo del PD-L1 “vagabondo” (sPD-L1)
Un altro pezzo del puzzle sembra essere il PD-L1 solubile (sPD-L1). Si tratta di molecole di PD-L1 che vengono rilasciate dalle cellule tumorali e circolano liberamente. Abbiamo notato una cosa curiosa: le cellule che esprimevano il mutante PD-L1N35A producevano livelli molto più alti di sPD-L1 e di PD-L1 legato a vescicole extracellulari (EV). Al contrario, le cellule con il mutante PD-L1Nx4 ne rilasciavano molto meno.
Perché è importante? Beh, questo sPD-L1 potrebbe agire come una specie di “esca”. Se ce n’è tanto in giro, gli anticorpi terapeutici potrebbero legarsi a queste molecole solubili invece che a quelle presenti sulla superficie delle cellule tumorali, riducendo l’efficacia della terapia. Oppure, l’sPD-L1 potrebbe legarsi direttamente a PD-1 sulle cellule T, contribuendo a sopprimere la risposta immunitaria. Infatti, abbiamo visto che l’sPD-L1 prodotto dal mutante N35A era molto efficace nell’attivare PD-1, il che potrebbe spiegare perché gli anticorpi anti-PD-1 faticavano tanto in presenza di questo mutante.
Quando abbiamo “congelato” le cellule tumorali (fissandole con formalina, così da eliminare l’effetto dell’sPD-L1 e bloccare il PD-L1 sulla membrana), abbiamo visto che l’efficacia del blocco da parte degli anticorpi migliorava per il mutante N35A, anche se non completamente per tutti gli anticorpi. Questo rafforza l’idea che l’sPD-L1 giochi un ruolo importante, ma che ci siano anche delle modifiche intrinseche alla proteina PD-L1N35A che la rendono più resistente.
Cosa significa tutto questo per i pazienti?
Queste scoperte sono, a mio parere, estremamente promettenti. Attualmente, la decisione di usare o meno un ICB si basa spesso sulla quantità di PD-L1 espressa dal tumore (il cosiddetto “staining”). Ma i nostri risultati suggeriscono che non è solo quanto PD-L1 c’è, ma anche come è “vestito” – cioè il suo stato di N-glicosilazione – a fare la differenza.
Pensateci: un paziente potrebbe avere alti livelli di PD-L1, ma se questo è prevalentemente nella forma N35A, che rilascia tanto sPD-L1 e resiste al blocco, la terapia potrebbe non funzionare come sperato. Al contrario, un paziente con livelli apparentemente bassi di PD-L1, ma con una forma non glicosilata (simile al nostro Nx4), potrebbe rispondere in modo eccellente.
Questo apre la strada a strategie più personalizzate:
- Migliore stratificazione dei pazienti: Analizzare lo stato di glicosilazione di PD-L1 nei tumori dei pazienti potrebbe aiutarci a prevedere meglio chi risponderà agli ICB.
- Nuovi bersagli terapeutici: Forse potremmo sviluppare farmaci che modulano la glicosilazione di PD-L1 per renderlo più “sensibile” agli ICB, o che neutralizzano specificamente l’sPD-L1 derivante da forme resistenti come la N35A.
Certo, siamo ancora all’inizio. Questo studio è stato condotto su linee cellulari e con sistemi ex vivo. Bisognerà vedere come questi risultati si traducono nella complessità dell’ambiente tumorale reale e nei pazienti. Però, è un passo avanti entusiasmante!
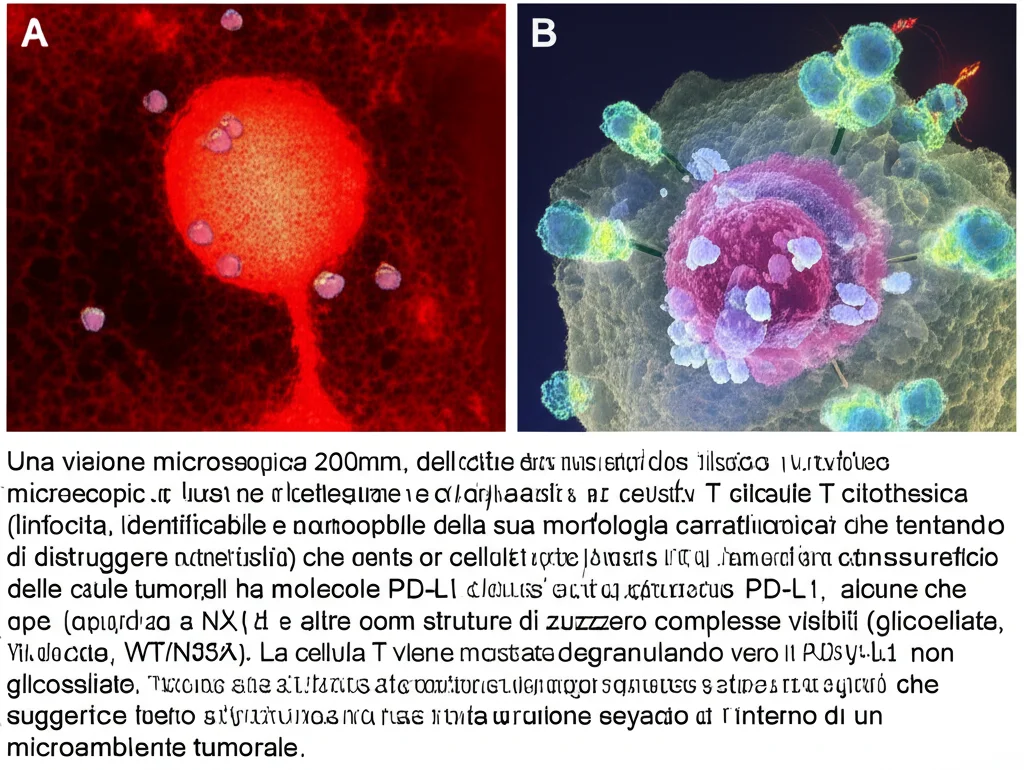
In conclusione, la N-glicosilazione di PD-L1 non è un semplice dettaglio molecolare, ma un attore chiave che modula l’efficacia delle immunoterapie. Capire a fondo questi meccanismi ci avvicina sempre di più a rendere queste potentissime armi contro il cancro ancora più precise ed efficaci per un numero maggiore di pazienti. E questo, per chi come me lavora in questo campo, è la motivazione più grande!
Fonte: Springer