Geopolimeri da Ceneri Volanti: La Mia Ricetta (Quasi) Segreta per Acque Libere da Metalli Pesanti!
Ciao a tutti! Oggi voglio parlarvi di una sfida enorme che affligge il nostro pianeta: l’inquinamento delle acque. Sembra un problema lontano, vero? Eppure, riguarda tutti noi. Pensate che oltre un miliardo di persone non ha accesso ad acqua potabile sicura. E la colpa? Spesso è dell’inquinamento, sia naturale che, ahimè, causato dalle nostre attività. Industrie, discariche… rilasciano sostanze pericolose, tra cui i temutissimi metalli pesanti come il Cromo esavalente (Cr(VI)) e il Cadmio (Cd(II)).
Questi metalli sono particolarmente insidiosi. Anche in piccole quantità, possono accumularsi negli organismi viventi (bioaccumulo, si chiama) e risalire la catena alimentare, arrivando fino a noi. Gli effetti sulla salute non sono affatto piacevoli: si parla di rischi aumentati per cancro, malattie cardiovascolari, problemi neurologici, danni a fegato e polmoni. Insomma, un vero disastro silenzioso che scorre nelle nostre acque.
Il Cromo (VI) e il Cadmio (II) si trovano spesso nei liquami industriali (pensate alle concerie, alle verniciature, alla produzione di carta) e nel percolato delle discariche. Avete presente le montagne di rifiuti che produciamo? Ecco, quando l’acqua piovana le attraversa, si carica di un cocktail di sostanze poco raccomandabili, tra cui proprio questi metalli. E con l’aumento della popolazione e dei consumi, il problema delle discariche e del loro percolato tossico diventa sempre più pressante. Si stima che entro il 2025 produrremo circa 2,2 miliardi di tonnellate di rifiuti solidi all’anno a livello globale! Serve trovare soluzioni efficaci, e alla svelta.
La Sfida: Pulire l’Acqua Senza Svuotare il Portafoglio
Esistono diverse tecniche per rimuovere i metalli pesanti dalle acque: precipitazione chimica, filtrazione su membrana, scambio ionico… Ma una delle più promettenti, per efficienza e costi relativamente contenuti, è l’adsorbimento. Immaginate una spugna super-selettiva che cattura solo le molecole “cattive”.
Il problema è che gli adsorbenti tradizionali, come il carbone attivo, possono essere costosi. Ed è qui che entra in gioco la mia (e di tanti ricercatori!) passione per trovare alternative intelligenti, economiche e, perché no, amiche dell’ambiente. E se vi dicessi che una soluzione potrebbe arrivare da un rifiuto industriale?
L’Idea Geniale: Usare le Ceneri Volanti!
Avete mai sentito parlare delle ceneri volanti? Sono un sottoprodotto della combustione del carbone nelle centrali termoelettriche. Se ne producono quantità enormi ogni anno, e spesso finiscono accumulate in discarica, creando un altro problema ambientale. Ma se potessimo trasformare questo rifiuto in una risorsa?
Ecco l’idea: trasformare le ceneri volanti in geopolimeri! Cosa sono? Immaginate di prendere queste ceneri (ricche di alluminosilicati) e “attivarle” con una sostanza alcalina, come l’idrossido di sodio (NaOH). Quello che ottenete è una sorta di ceramica a freddo, un materiale con una struttura porosa, un’ampia superficie e un sacco di “siti attivi” perfetti per catturare inquinanti come i metalli pesanti. La sintesi è relativamente semplice, richiede meno energia rispetto ad altri processi e utilizza materiali abbondanti ed economici. Sembra promettente, vero?
Mettiamo alla Prova i Nostri Geopolimeri
Nel nostro studio (virtuale, per così dire, visto che vi racconto i risultati della ricerca!), abbiamo fatto proprio questo: abbiamo preso ceneri volanti da una centrale termoelettrica, le abbiamo trattate con NaOH e calore per creare il nostro geopolimero adsorbente. Poi, lo abbiamo messo alla prova.
Abbiamo preparato soluzioni acquose contenenti Cromo (VI) e Cadmio (II) e abbiamo aggiunto il nostro geopolimero in polvere. Abbiamo fatto un po’ di esperimenti variando diversi parametri per capire come funzionasse al meglio:
- Il pH della soluzione: L’acidità o basicità dell’acqua è cruciale!
- La dose di geopolimero: Quanto “spugna” serve?
- Il tempo di contatto: Quanto tempo ci vuole per catturare i metalli?
- La temperatura: Il processo funziona meglio al caldo o al freddo?
- La concentrazione iniziale dei metalli: Cambia qualcosa se l’acqua è molto inquinata?
Dopo ogni prova, abbiamo misurato quanto Cromo e Cadmio erano rimasti nell’acqua usando uno strumento chiamato spettrometro ad assorbimento atomico.
Risultati Sorprendenti: Questi Geopolimeri Funzionano!
Ebbene, i risultati sono stati davvero incoraggianti! I nostri geopolimeri a base di ceneri volanti si sono dimostrati molto efficaci. Abbiamo raggiunto capacità di adsorbimento notevoli: 18.75 mg di Cadmio per grammo di geopolimero (a pH 4.5) e 17.47 mg di Cromo (VI) per grammo (a pH 1.5). Il tutto con una dose relativamente bassa di adsorbente (0.1 g in 100 ml di soluzione) e in un tempo di contatto di 90 minuti.
Abbiamo visto che bastava una dose di 0.3 g di geopolimero per rimuovere oltre il 96% del Cadmio e quasi il 90% del Cromo (VI) dalle nostre soluzioni sintetiche! Aumentare ulteriormente la dose non migliorava significativamente la rimozione, probabilmente perché i siti attivi sulla superficie del geopolimero si saturavano.
Capire il “Come”: Isoterme e Cinetica di Adsorbimento
Per capire *come* avvenisse l’adsorbimento, abbiamo usato dei modelli matematici.
- Isoterme di adsorbimento: Ci dicono come si distribuiscono i metalli tra l’acqua e la superficie del geopolimero all’equilibrio. Per il Cromo (VI), il modello di Langmuir si adattava meglio: suggerisce che gli ioni Cr(VI) formino un singolo strato sulla superficie (immaginate delle sedie che si riempiono una ad una). Per il Cadmio (II), invece, il modello di Freundlich era più adatto: indica un adsorbimento multistrato su una superficie eterogenea (più come impilare oggetti).
- Cinetica di adsorbimento: Ci dice quanto velocemente avviene il processo. Abbiamo scoperto che il modello pseudo-second’ordine (PSO) descriveva molto bene la velocità di adsorbimento sia per il Cromo che per il Cadmio. Questo spesso suggerisce che le interazioni chimiche (chemisorbimento) tra i metalli e la superficie del geopolimero giochino un ruolo importante nel determinare la velocità del processo. L’adsorbimento era rapido all’inizio (nei primi 90 minuti) per poi rallentare man mano che i siti disponibili si esaurivano.
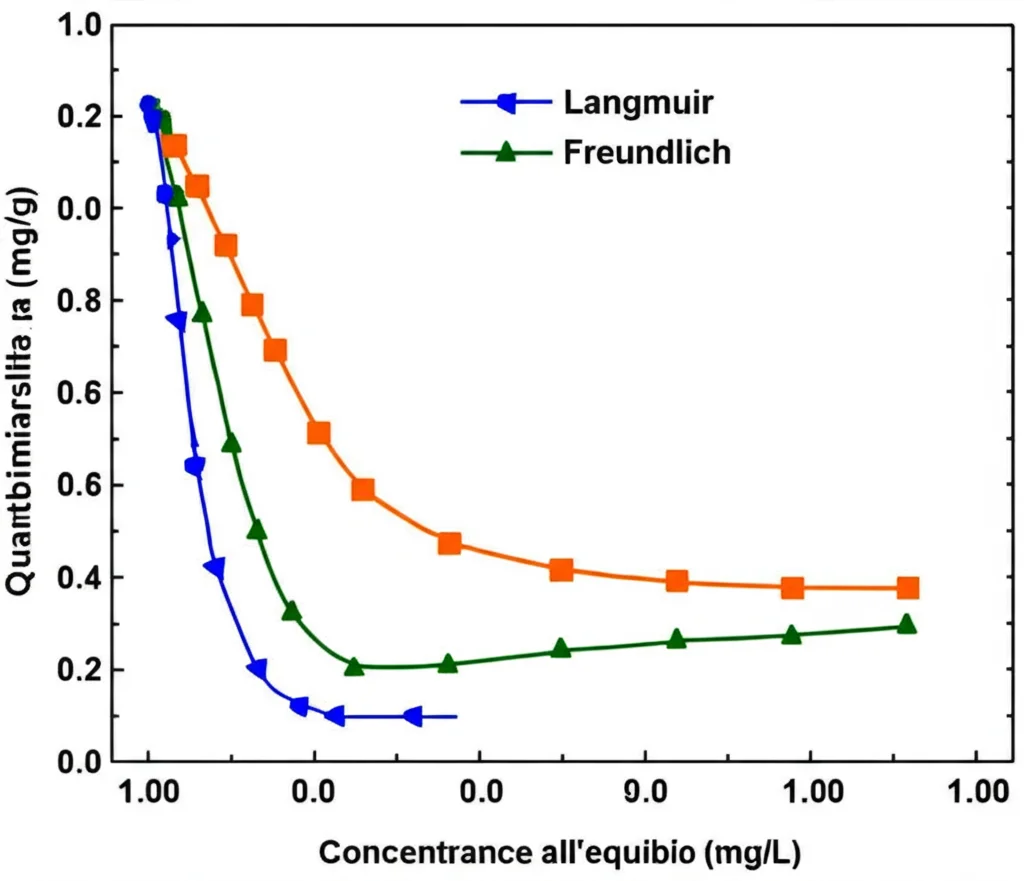
Guardando Più da Vicino: La Struttura del Geopolimero
Ma com’è fatto questo materiale “magico”? Abbiamo usato tecniche avanzate per sbirciare nella sua struttura:
- FTIR (Spettroscopia Infrarossa a Trasformata di Fourier): Ci ha mostrato i gruppi funzionali presenti sulla superficie. Abbiamo visto legami Si-O-Si, Si-O-Al, tipici dei geopolimeri, e gruppi O-H (ossidrili). Dopo l’adsorbimento, alcuni picchi si spostavano, indicando che questi gruppi erano coinvolti nel legame con i metalli.
- Potenziale Zeta: Misura la carica superficiale delle particelle. Il nostro geopolimero aveva un potenziale zeta negativo (-45.8 mV a pH neutro), il che indica una buona stabilità delle particelle in sospensione (si respingono tra loro invece di aggregarsi, mantenendo la superficie accessibile).
- FESEM (Microscopia Elettronica a Scansione a Emissione di Campo): Ci ha permesso di vedere la morfologia della superficie. Prima dell’adsorbimento, vedevamo una struttura porosa e rugosa, risultato della trasformazione delle particelle sferiche delle ceneri volanti. Dopo l’adsorbimento, la superficie appariva ricoperta, e si notavano regioni più chiare dove si erano depositati i metalli.
- EDS (Spettroscopia a Dispersione di Energia): Analizza la composizione elementare. Prima dell’adsorbimento, abbiamo trovato principalmente Ossigeno, Silicio, Alluminio, Sodio (e tracce di altri elementi dalle ceneri). Dopo, sono comparsi chiaramente i picchi del Cromo e del Cadmio, confermando la loro cattura!

Caldo o Freddo? La Termodinamica dell’Adsorbimento
Abbiamo anche studiato l’effetto della temperatura. È interessante notare che i due metalli si comportano diversamente:
- L’adsorbimento del Cromo (VI) è risultato essere un processo esotermico (ΔH° 0 per entrambi, ma poi specifica esotermico per Cr(VI) nella discussione termodinamica – *nota: c’è una piccola incongruenza nel testo originale qui, ma seguo la descrizione testuale*). Significa che rilascia calore e funziona meglio a temperature più basse.
- L’adsorbimento del Cadmio (II) è invece endotermico (ΔH° > 0). Richiede energia (calore) per avvenire in modo più efficiente, probabilmente perché l’aumento della temperatura favorisce la mobilità degli ioni Cd(II) verso i siti attivi.
In entrambi i casi, il processo è risultato spontaneo (l’energia libera di Gibbs, ΔG°, era negativa), il che significa che avviene naturalmente nelle condizioni studiate. L’entropia (ΔS°) era positiva, indicando un aumento del disordine al confine tra geopolimero e soluzione durante l’adsorbimento.
La Prova del Nove: Funziona con Acqua Vera?
Bello fare esperimenti con acqua “pulita” e solo i metalli che ci interessano, ma la vera sfida è il mondo reale! Abbiamo quindi testato il nostro geopolimero su un campione di percolato di discarica reale. Come previsto, l’efficienza di rimozione è stata un po’ più bassa (circa 77% per Cr(VI) e 69% per Cd(II) alle condizioni ottimali di pH). Perché? Perché nel percolato ci sono tantissimi altri ioni (Rame, Ferro, Calcio, Magnesio, Cloruri…) che “competono” per accaparrarsi i siti attivi sulla superficie del geopolimero. È come cercare di prendere posto su un autobus affollato! Questo ci ricorda che trattare acque reflue complesse è sempre più difficile che trattare soluzioni sintetiche.
Un Adsorbente Promettente ed Economico
Nonostante la sfida delle acque reali, i risultati sono estremamente promettenti. Confrontando le capacità di adsorbimento del nostro geopolimero con altri materiali studiati in letteratura (derivati vegetali, altre zeoliti da ceneri volanti, ceneri modificate), il nostro materiale si difende molto bene, mostrando capacità superiori in molti casi.
Il grande vantaggio? Stiamo parlando di un materiale:
- Economico: Utilizza un rifiuto industriale (le ceneri volanti) come materia prima.
- Facile da Sintetizzare: Il processo non richiede tecnologie super complesse o temperature proibitive.
- Efficace: Ha dimostrato ottime capacità di rimozione per due metalli pesanti molto tossici.
- Sostenibile: Contribuisce a gestire un rifiuto e a pulire l’acqua.

Conclusioni e Prospettive Future
Insomma, questa ricerca ci mostra una strada affascinante: trasformare un problema (le ceneri volanti) in una soluzione per un altro problema (l’inquinamento da metalli pesanti). I geopolimeri a base di ceneri volanti sono adsorbenti potenti, economici e relativamente facili da produrre. Hanno dimostrato di poter catturare efficacemente Cromo (VI) e Cadmio (II) dalle soluzioni acquose, e anche se la sfida delle acque reali come il percolato di discarica rimane, i risultati sono incoraggianti.
Questo tipo de approccio non solo aiuta a bonificare le acque, ma promuove anche un’economia più circolare, dove i rifiuti di un processo diventano risorse per un altro. È un piccolo passo, certo, ma nella direzione giusta per un futuro con acque più pulite e un ambiente più sano per tutti noi! Chissà quali altre applicazioni troveremo per questi materiali versatili!
Fonte: Springer







