Svelato il Mistero del Miglio Giallo: Come i Geni Dipingono i Chicchi
Ciao a tutti gli appassionati di scienza e agricoltura! Oggi voglio portarvi con me in un viaggio affascinante nel cuore di un cereale tanto antico quanto prezioso: il panico, o *Setaria italica*, conosciuto anche come miglio volpino (foxtail millet). Avete mai notato come i suoi chicchi possano variare dal bianco pallido a un giallo intenso e invitante? Bene, quel colore non è solo una questione estetica, ma è legato a doppio filo con la qualità nutrizionale, in particolare con l’accumulo di carotenoidi.
Queste molecole, le stesse che danno il colore alle carote o ai peperoni, sono fondamentali per la nostra salute. Sono precursori della Vitamina A, potenti antiossidanti e alleati del nostro sistema immunitario. Il problema? Noi mammiferi non possiamo produrli, dobbiamo assumerli con la dieta. Ecco perché capire come il panico accumula questi pigmenti è cruciale, non solo per la scienza, ma anche per migliorare il valore nutrizionale di questo cereale resiliente e sempre più apprezzato.
Un Arcobaleno nel Piatto: La Varietà è la Norma
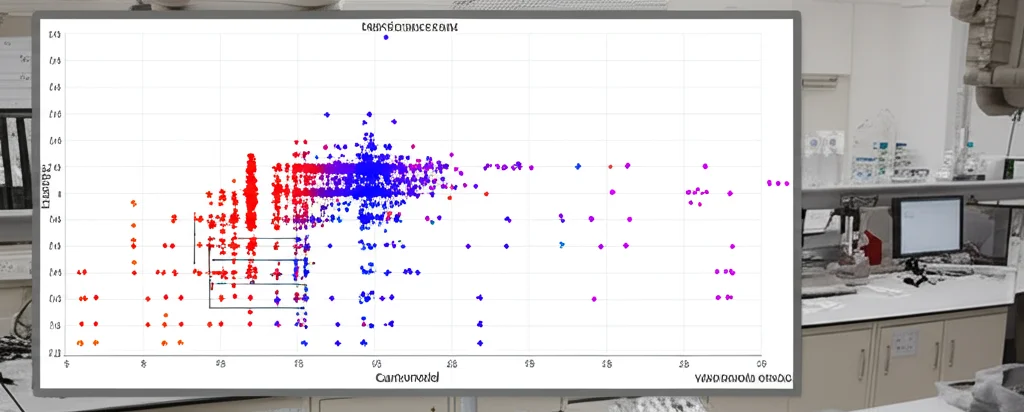
La prima cosa che abbiamo osservato studiando ben 201 varietà diverse di panico è stata proprio l’incredibile gamma di colori e, di conseguenza, di contenuto totale di carotenoidi nei chicchi. Si passava da poco più di 4 mg/kg a oltre 27 mg/kg! Questa grande variabilità ci ha subito suggerito una cosa: il colore del chicco non è controllato da un singolo interruttore genetico “acceso/spento”, ma è un tratto quantitativo, risultato dell’azione combinata di molti geni. Una sfida complessa, ma tremendamente stimolante!
Gli Strumenti del Mestiere Genetico
Come svelare questo intricato puzzle genetico? Abbiamo messo in campo un arsenale di tecniche all’avanguardia. Immaginate di avere una mappa del genoma del panico e di voler trovare le regioni responsabili del colore giallo.
- Abbiamo usato la GWAS (Genome-Wide Association Study), una sorta di “scansione” genetica su larga scala sulle 201 varietà, cercando associazioni tra milioni di piccole variazioni nel DNA (chiamate SNP) e il contenuto di carotenoidi.
- Parallelamente, abbiamo adottato la strategia BSA-seq (Bulk Segregant Analysis sequencing). Abbiamo incrociato una varietà a chicco giallo (GBS) con una a chicco bianco (NMB) e analizzato il DNA di gruppi di discendenti (una popolazione RIL alla generazione F6) con caratteristiche estreme (giallo intenso vs bianco puro). Confrontando i loro genomi, abbiamo cercato le differenze significative ereditate insieme al colore.
- Infine, abbiamo integrato queste informazioni con analisi trascrittomiche (quali geni sono “accesi” e quanto) e metabolomiche (quali molecole, come i carotenoidi, sono presenti e in che quantità) durante le diverse fasi di maturazione del chicco nelle varietà gialle e bianche.
Un approccio multi-livello per avere un quadro il più completo possibile.

I Protagonisti: Un Costruttore e un Demolitore
Combinando i risultati di GWAS e BSA-seq, due regioni genomiche sono emerse come particolarmente “calde”: una sul cromosoma 3 e una sul cromosoma 4. E indovinate quali geni importanti per i carotenoidi abbiamo trovato proprio lì? Principalmente due:
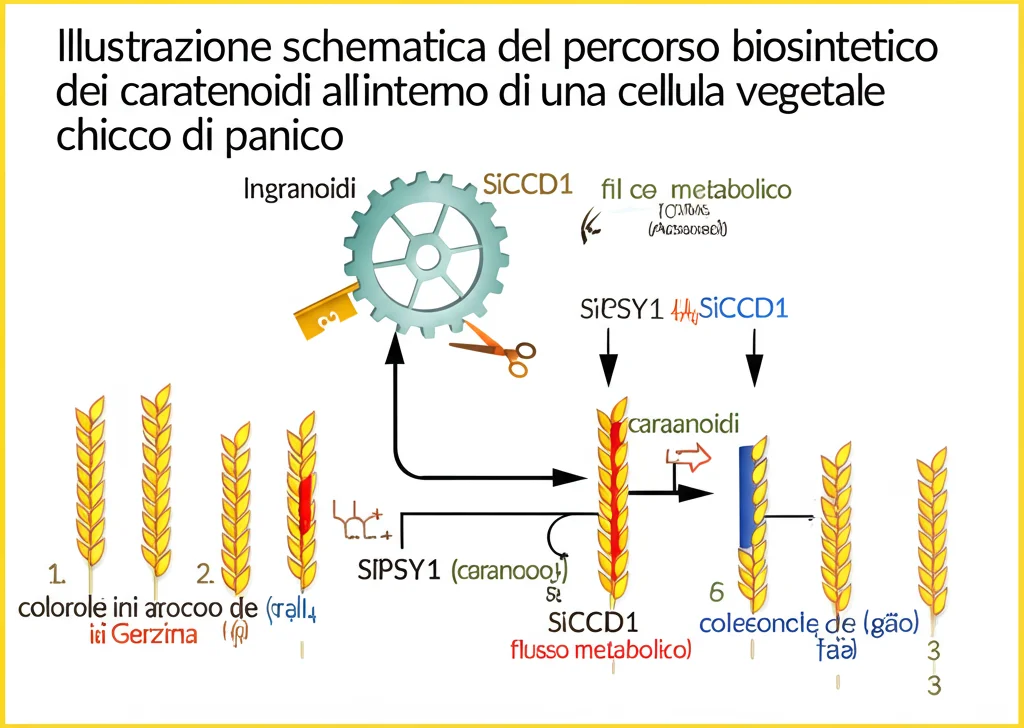
- SiPSY1 (Phytoene Synthase 1): Questo è l’enzima chiave che dà il via a tutta la catena di montaggio dei carotenoidi. È come il capocantiere che decide quanto materiale (precursori metabolici) destinare alla costruzione dei pigmenti gialli.
- SiCCD1 (Carotenoid Cleavage Dioxygenase 1): Questo enzima fa il lavoro opposto. È parte della squadra di “demolizione”, capace di spezzare i carotenoidi già formati, riducendone l’accumulo finale.
Abbiamo trovato anche un altro gene della stessa famiglia di PSY, SiPSY2, ma le analisi successive hanno indicato che SiPSY1 e SiCCD1 sembravano giocare i ruoli più decisivi nella differenza tra chicchi gialli e bianchi.
La Prova del Nove: Geni in Azione
Le analisi trascrittomiche e metabolomiche hanno confermato i sospetti. Durante la maturazione dei chicchi:
- Nelle varietà gialle, il gene SiPSY1 era costantemente molto più “acceso” (espresso) rispetto alle varietà bianche. Più capocantiere al lavoro = più carotenoidi costruiti.
- Al contrario, il gene “demolitore” SiCCD1 era significativamente più attivo nelle varietà bianche, soprattutto nelle fasi finali della maturazione. Più demolizione = meno carotenoidi accumulati.
Analizzando i tipi specifici di carotenoidi, abbiamo visto che la differenza principale tra chicchi gialli e bianchi risiedeva nei livelli di luteina e zeaxantina, i due carotenoidi predominanti. Le varietà gialle ne erano ricche, mentre in quelle bianche i livelli crollavano drasticamente durante la maturazione, proprio quando l’attività di SiCCD1 aumentava. Sembrava proprio che l’equilibrio tra l’attività di costruzione di SiPSY1 e quella di demolizione di SiCCD1 fosse il fattore chiave nel determinare il colore finale del chicco.
Il Dettaglio Cruciale: L’Interruttore Genetico
Ma cosa rende SiPSY1 così attivo nei chicchi gialli e meno in quelli bianchi? La risposta, spesso, si nasconde non nel gene stesso, ma nella regione che lo controlla: il promotore. È come l’interruttore e il regolatore di intensità di una lampadina.
Abbiamo clonato e sequenziato la regione del promotore di SiPSY1 da varietà gialle e bianche. E qui abbiamo trovato la “pistola fumante”! Nelle varietà bianche, abbiamo identificato due piccole ma cruciali differenze rispetto alle varietà gialle:
- Una singola lettera del codice genetico cambiata (un SNP, G al posto di A) in una posizione specifica (364 bp prima dell’inizio del gene).
- Un piccolo pezzo di DNA in più (un’Inserzione/Delezione o Indel di 29 paia di basi) in un’altra posizione (856 bp prima del gene).
Queste modifiche, apparentemente minuscole, si trovano in zone del promotore dove si legano proteine regolatrici, in particolare quelle sensibili alla luce e agli ormoni vegetali come l’acido abscissico.
Per verificare l’impatto di queste differenze, abbiamo usato una tecnica chiamata “saggio della doppia luciferasi”. In pratica, abbiamo collegato i diversi promotori (giallo, bianco e quelli con le singole mutazioni) a un gene che produce luce (come quello delle lucciole) e li abbiamo inseriti in cellule vegetali. Misurando quanta luce veniva prodotta, potevamo quantificare l’attività del promotore. I risultati sono stati netti: il promotore “giallo” era circa 6.5 volte più attivo di quello “bianco”! E, cosa ancora più interessante, introducendo singolarmente le due mutazioni (SNP e Indel) nel promotore giallo, la sua attività si riduceva drasticamente, avvicinandosi a quella del promotore bianco. La mutazione SNP sembrava avere l’effetto inibitorio più forte.

Ecco svelato il meccanismo molecolare: piccole variazioni nella sequenza del promotore di SiPSY1 agiscono come un interruttore dimmerabile, regolando finemente l’espressione di questo gene chiave e, di conseguenza, l’accumulo di carotenoidi e il colore finale dei chicchi di panico.
Perché Tutto Questo è Importante?
Capire i meccanismi genetici alla base del colore e del contenuto di carotenoidi nel panico non è solo un esercizio accademico. Queste scoperte aprono strade concrete per il miglioramento genetico. Ora abbiamo dei “marcatori” molecolari (le variazioni nel promotore di SiPSY1, ad esempio) che possiamo usare per selezionare più rapidamente e con precisione le varietà di panico che accumulano più carotenoidi.
L’obiettivo finale? Sviluppare nuove varietà di panico non solo più belle da vedere, con quel giallo intenso che tanto piace, ma soprattutto più ricche di nutrienti essenziali per la nostra salute. Un piccolo passo nel laboratorio, un potenziale grande balzo per la qualità di questo cereale straordinario. Il nostro viaggio nella genetica del panico continua, e spero di avervi trasmesso un po’ della nostra passione!
Fonte: Springer







