Il Segreto Danzante delle Goccioline Lipidiche: Come la Temperatura le Fa Fondere!
Ciao a tutti, appassionati di scienza e curiosi! Oggi voglio portarvi con me in un viaggio affascinante nel cuore delle nostre cellule, o meglio, nel cuore delle cellule di un piccolo verme chiamato Caenorhabditis elegans, che però ci insegna tantissimo su come funzioniamo anche noi. Parleremo di grasso, ma non come ne parlano le riviste di diete! Parleremo di come le cellule immagazzinano il grasso in piccole “sacche” chiamate goccioline lipidiche (LDs) e di un processo incredibile: la loro fusione.
Perché le goccioline lipidiche si fondono?
Immaginate queste goccioline come minuscoli serbatoi di energia. A volte, per ottimizzare lo stoccaggio o per rispondere a segnali specifici, queste goccioline decidono di unirsi, fondendosi in gocce più grandi. Questo processo è cruciale, ad esempio, nel tessuto adiposo. Nel grasso bianco, una grande goccia unica massimizza lo stoccaggio. Nel grasso bruno, tante piccole gocce offrono una superficie maggiore agli enzimi che devono “bruciare” i grassi per produrre calore quando fa freddo. Capire come avviene questa fusione è fondamentale.
Finora conoscevamo principalmente due modi in cui le goccioline possono “unirsi”:
- Trasferimento di lipidi (fusione atipica): Immaginate due palloncini, uno piccolo e uno grande. Il contenuto del piccolo viene lentamente trasferito nel grande attraverso un “canale” proteico (le proteine Cide), ma le membrane dei palloncini non si fondono direttamente. Il ruolo della membrana qui è un mistero.
- Coalescenza (fusione tipica): Qui le membrane delle due goccioline si fondono davvero, come due bolle di sapone che diventano una sola. Il contenuto si mescola rapidamente. Si pensava che questo fosse favorito da cambiamenti nei tipi di “mattoni” che compongono la membrana, come l’aumento dell’acido fosfatidico (PA) o la diminuzione della fosfatidilcolina (PC).
Ma c’era ancora molto da scoprire, specialmente riguardo al ruolo degli acidi grassi che compongono questi “mattoni” (i fosfolipidi) e all’influenza della temperatura.
Il nostro piccolo eroe: C. elegans e la fusione termosensibile
Ed ecco che entra in gioco il nostro piccolo verme, C. elegans. Questo organismo è fantastico per studiare questi processi per due motivi principali:
- Abbiamo scoperto dei mutanti, chiamati cyp-37A1, in cui le goccioline lipidiche nell’intestino si fondono in modo massiccio e rapidissimo quando la temperatura ambientale sale da 20°C a 30°C. È una fusione termosensibile! Questo fenomeno dipende da un recettore nucleare (una proteina che regola i geni) chiamato DAF-12. Se manca DAF-12, la fusione non avviene. Importante: in questi mutanti, la quantità totale di grasso non cambia, quindi l’aumento di dimensione delle gocce è dovuto *solo* alla fusione, non a una maggiore produzione di grasso. Questo ci dà un modello “pulito” per studiare specificamente la fusione.
- C. elegans è un mago della chimica dei grassi! Produce da solo quasi tutti gli acidi grassi di cui ha bisogno, inclusi alcuni acidi grassi polinsaturi (PUFA) che noi vertebrati dobbiamo assumere con la dieta. Possiamo manipolare geneticamente gli enzimi che producono questi grassi (chiamati FAT) per capire esattamente quali sono importanti.
La caccia ai geni della fusione
Ci siamo messi alla ricerca di altri geni coinvolti in questa fusione termosensibile. Abbiamo trovato dei geni “soppressori”, cioè geni che, se mutati, impedivano la fusione nel mutante cyp-37A1. Due di questi si sono rivelati particolarmente interessanti:
- FAT-3: Un enzima chiave (una desaturasi) per produrre i PUFA a 20 atomi di carbonio (C20). Senza FAT-3, niente C20 PUFA e niente fusione!
- MBOA-6: Un enzima (omologo dell’umano LPCAT3) che appartiene a una famiglia chiamata MBOAT. Questi enzimi prendono i PUFA e li “attaccano” ai fosfolipidi già esistenti, in un processo di rimodellamento chiamato ciclo di Lands. Senza MBOA-6, la fusione è bloccata.
Questi risultati ci hanno subito suggerito che i C20 PUFA e il loro inserimento nei fosfolipidi della membrana delle goccioline fossero cruciali.
DAF-12: il regista della composizione della membrana
Analizzando i livelli dei vari acidi grassi, abbiamo notato che nel mutante cyp-37A1 (quello che fonde) aumentavano proprio i C20 PUFA, in particolare quelli della serie omega-3 (come il C20:5n3, l’EPA!). Se eliminavamo DAF-12, questi livelli tornavano normali.
Abbiamo poi misurato l’espressione dei geni FAT e abbiamo scoperto che DAF-12, quando attivato (nel mutante cyp-37A1), aumentava la trascrizione di molti di questi geni desaturasi (FAT-1, FAT-2, FAT-3, FAT-5, FAT-7). Sembrava che DAF-12 stesse orchestrando una maggiore produzione di PUFA.
Ma la vera sorpresa è arrivata quando siamo andati a vedere *dove* si trovavano questi enzimi FAT e l’enzima MBOA-6 all’interno della cellula. Normalmente, molti di questi enzimi risiedono in una rete di membrane chiamata reticolo endoplasmatico (ER). Ma nel mutante cyp-37A1, abbiamo visto che una quantità significativa di questi enzimi si spostava e andava a “decorare” la superficie delle goccioline lipidiche! Quando DAF-12 era assente, tornavano prevalentemente nell’ER.
Questa è stata una scoperta chiave: DAF-12 non solo regola *quanti* enzimi vengono prodotti, ma anche *dove* vanno a lavorare. Li indirizza specificamente alle goccioline lipidiche!
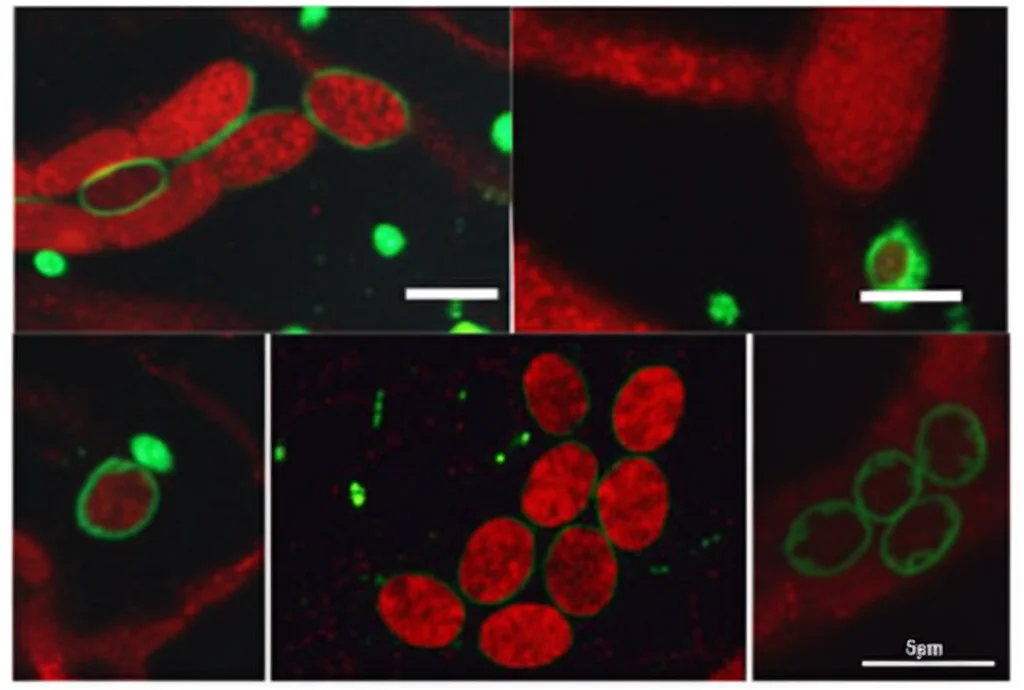
Rimodellamento locale e fluidità di membrana
Cosa fanno questi enzimi una volta arrivati sulla membrana delle LDs? Rimodellano i fosfolipidi! Abbiamo purificato le goccioline lipidiche e analizzato la loro composizione lipidica nel dettaglio (lipidomica). Abbiamo confermato che la fosfatidilcolina (PC) è il fosfolipide dominante (circa il 75%), mentre l’acido fosfatidico (PA) è quasi assente (<0.1%).
La scoperta cruciale è stata che, nel mutante cyp-37A1, aumentavano specificamente le sottospecie di PC che contenevano C20 PUFA omega-3 (come PC(20:5/16:0)). Nei mutanti che non fondevano (cyp-37A1;daf-12, cyp-37A1;fat-3, cyp-37A1;mboa-6), questi PC ricchi di PUFA diminuivano drasticamente.
Quindi, il segnale DAF-12 porta gli enzimi FAT e MBOA-6 sulle LDs per arricchire la loro membrana specificamente con PC contenenti C20 PUFA omega-3.
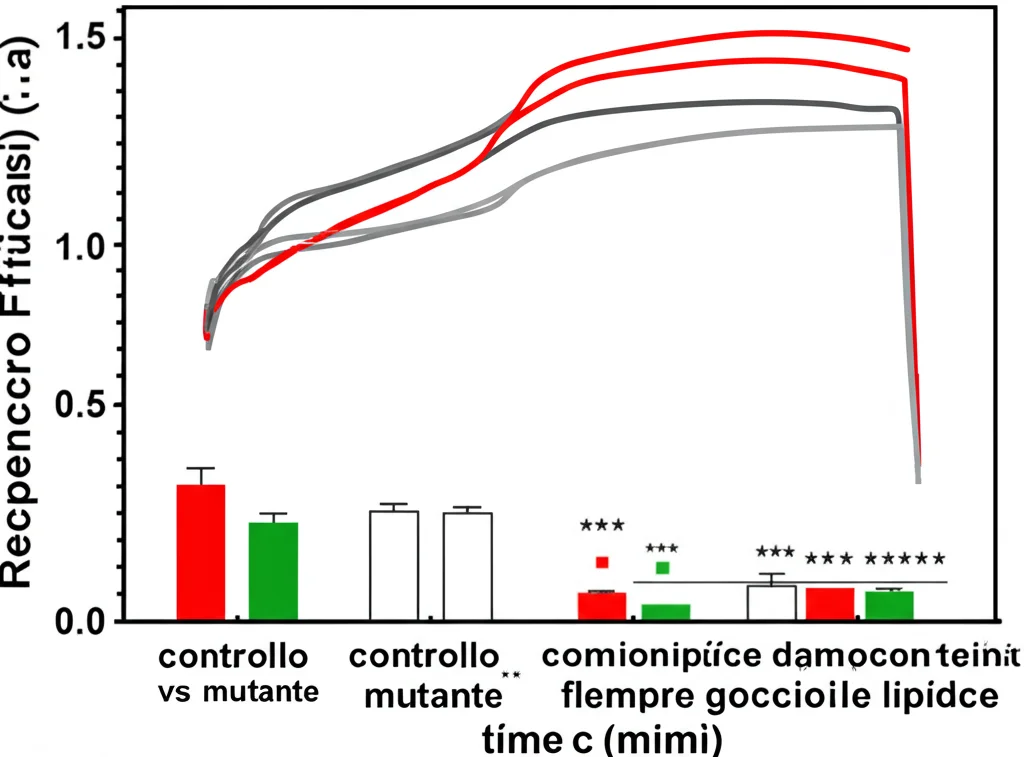
Perché questo è importante per la fusione? I PUFA sono noti per rendere le membrane più fluide. Abbiamo misurato la fluidità della membrana delle LDs purificate usando una tecnica chiamata FRAP (Fluorescence Recovery After Photobleaching). Immaginate di “spegnere” la fluorescenza in una piccola area della membrana e misurare quanto velocemente la fluorescenza “ritorna” grazie al movimento delle molecole. Ebbene, le membrane delle LDs del mutante cyp-37A1 erano significativamente più fluide (recupero più veloce) rispetto a quelle del tipo selvatico o dei mutanti che non fondevano! Inoltre, la fluidità delle LDs di cyp-37A1 aumentava con la temperatura, proprio come la loro tendenza a fondere.
Per confermare il ruolo della fluidità, abbiamo usato il DMSO, una sostanza chimica che rende le membrane più rigide. Trattando i vermi cyp-37A1 con DMSO, abbiamo visto che la fluidità della membrana delle LDs diminuiva e… la fusione termosensibile veniva bloccata! Questo non succedeva in altri mutanti dove le gocce sono grandi per altri motivi (eccessiva sintesi di grasso). Era una prova diretta: la fluidità della membrana è essenziale per la fusione termosensibile.
Forzare gli enzimi sulle LDs: la prova del nove
Se la localizzazione degli enzimi sulle LDs è così importante, cosa succede se li forziamo ad andare lì? Abbiamo creato delle versioni “artificiali” degli enzimi FAT-1 e MBOA-6 attaccandoli a una proteina che va sempre sulle LDs (DGAT-2). In questo modo, questi enzimi erano costretti a localizzarsi sulle goccioline lipidiche, anche nel tipo selvatico.
Il risultato? Questi vermi “ingegnerizzati” mostravano una maggiore tendenza alla fusione termosensibile, anche in assenza della mutazione cyp-37A1! E se li mettevamo nel contesto di cyp-37A1, la fusione diventava ancora più pronunciata e avveniva anche a temperature più basse (20°C). Questa è stata la prova definitiva che il rimodellamento compartimentalizzato dei fosfolipidi sulla membrana delle LDs, guidato dalla localizzazione degli enzimi, è il meccanismo chiave che facilita la fusione.
E nell’uomo?
Questo meccanismo è solo una stranezza dei vermi? Sembra di no! Abbiamo studiato gli omologhi umani degli enzimi chiave: FADS2 (simile a FAT-3) e LPCAT3 (simile a MBOA-6). Abbiamo visto che anche nelle cellule umane (HEK293T), queste proteine possono localizzarsi sulle goccioline lipidiche, specialmente quando le cellule stanno accumulando grasso. Inoltre, esprimere più LPCAT3 nelle cellule umane portava a goccioline lipidiche più grandi.
Ancora più interessante, abbiamo espresso l’LPCAT3 umano nei nostri vermi mutanti cyp-37A1;mboa-6 (che non fondono perché manca l’enzima verme). L’LPCAT3 umano è stato in grado di sostituire parzialmente la funzione di MBOA-6 e ripristinare la fusione termosensibile! Questo suggerisce fortemente che il meccanismo di regolazione della fusione delle LDs attraverso il rimodellamento della membrana da parte di LPCAT3 sia conservato tra C. elegans e l’uomo.

Conclusioni: una danza regolata sulla membrana
Quindi, cosa abbiamo imparato da questo piccolo verme? Abbiamo svelato un meccanismo elegante e finemente regolato:
- Un segnale (mediato da CYP-37A1 e DAF-12) controlla non solo la produzione, ma anche la localizzazione specifica di enzimi chiave (desaturasi FAT e aciltransferasi MBOA-6/LPCAT3) sulla membrana delle goccioline lipidiche.
- Questi enzimi, lavorando “in loco”, rimodellano i fosfolipidi della membrana, arricchendola di PC contenenti C20 PUFA omega-3.
- Questo arricchimento aumenta la fluidità della membrana delle goccioline lipidiche.
- L’aumentata fluidità, specialmente a temperature più alte, facilita la fusione termosensibile delle goccioline.
Questo lavoro non solo chiarisce un aspetto fondamentale della biologia delle goccioline lipidiche, ma apre anche nuove prospettive per capire come questi processi sono regolati nei mammiferi e come potrebbero essere coinvolti in condizioni fisiologiche (come l’adattamento al freddo) o patologiche (come l’accumulo di lipidi in alcune malattie, forse anche la Distrofia Cristallina di Bietti legata al gene CYP4V2, omologo di CYP-37A1).
È incredibile come studiando un organismo così semplice si possano scoprire meccanismi così fondamentali e conservati. La prossima volta che pensate al grasso, ricordatevi di questa danza molecolare che avviene sulle membrane delle sue minuscole riserve energetiche!
Fonte: Springer