Fusione Cellulare nel Glioma: Un’Alleanza Inaspettata che Alimenta il Tumore
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante e un po’ inquietante che succede nel nostro cervello quando si sviluppa uno dei tumori più aggressivi: il glioma, e in particolare la sua forma più cattiva, il glioblastoma (GBM). Sappiamo che il GBM è un osso duro, difficile da trattare nonostante chirurgia, radioterapia e chemio. La sopravvivenza, purtroppo, rimane bassa.
Il Quartiere del Tumore: Il Microambiente
Una delle ragioni per cui il glioma è così tenace è che non agisce da solo. Immaginatelo come un cattivo che non vive isolato, ma in un quartiere complesso, il cosiddetto microambiente tumorale (TME). Questo TME è pieno di “vicini”: cellule immunitarie, cellule stromali (una specie di tessuto di supporto), vasi sanguigni, molecole segnale… un ecosistema dinamico dove tutti interagiscono. E spesso, queste interazioni aiutano il tumore a crescere, invadere e resistere alle terapie.
Le Cellule Jolly: Le MSC e le GA-MSC
Tra i “vicini” del glioma ci sono delle cellule molto particolari: le cellule staminali/stromali mesenchimali (MSC). Sono cellule multipotenti, un po’ come dei jolly, capaci di trasformarsi in diversi tipi cellulari. Si trovano in molti tessuti, incluso il midollo osseo, ma anche… nel microambiente tumorale! Quelle che si trovano nel glioma le chiamiamo GA-MSC (MSC associate al glioma). Studi precedenti hanno mostrato che queste GA-MSC non sono spettatrici passive; anzi, sembrano dare una mano al tumore, promuovendone la crescita e associandosi a una prognosi peggiore. Lo fanno in vari modi: sopprimendo la risposta immunitaria, aiutando a creare nuovi vasi sanguigni, e interagendo direttamente con le cellule tumorali.
Un Fenomeno Incredibile: La Fusione Cellulare
E qui arriva il colpo di scena, qualcosa che sembra uscito da un film di fantascienza: le cellule possono fondersi tra loro! È un processo che esiste in natura (pensate alla formazione dei muscoli o della placenta), ma da oltre un secolo si sospetta che possa avvenire anche nei tumori, contribuendo alla loro aggressività. Immaginate una cellula tumorale che si unisce a una MSC: il risultato è una cellula ibrida, un mix delle due, con caratteristiche nuove e potenzialmente più pericolose. Questa fusione può portare a una riprogrammazione rapidissima del nucleo e a modifiche epigenetiche, aumentando l’eterogeneità del tumore – la sua capacità di avere cellule diverse al suo interno, rendendolo più difficile da combattere.
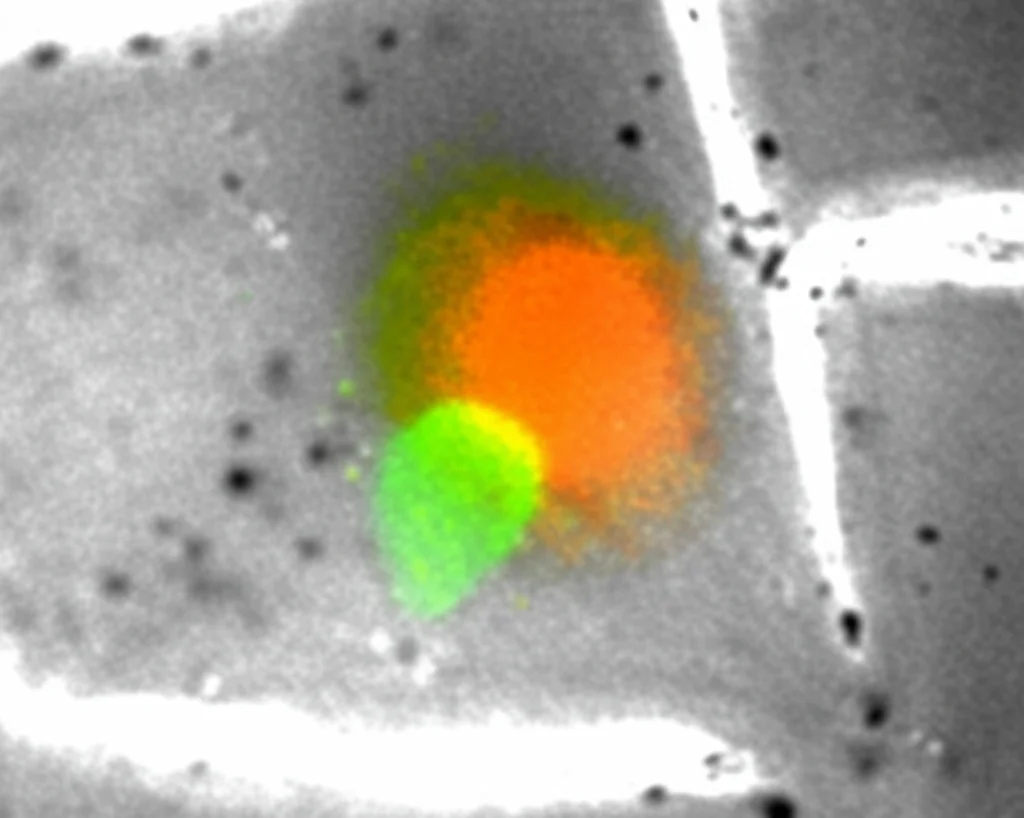
Era già stato osservato che le cellule di glioma potevano fondersi con MSC provenienti dal midollo osseo. Ma cosa succede con le GA-MSC, quelle che vivono già a stretto contatto con il tumore nel cervello? È quello che abbiamo cercato di capire.
La Prova della Fusione: In Laboratorio e Oltre
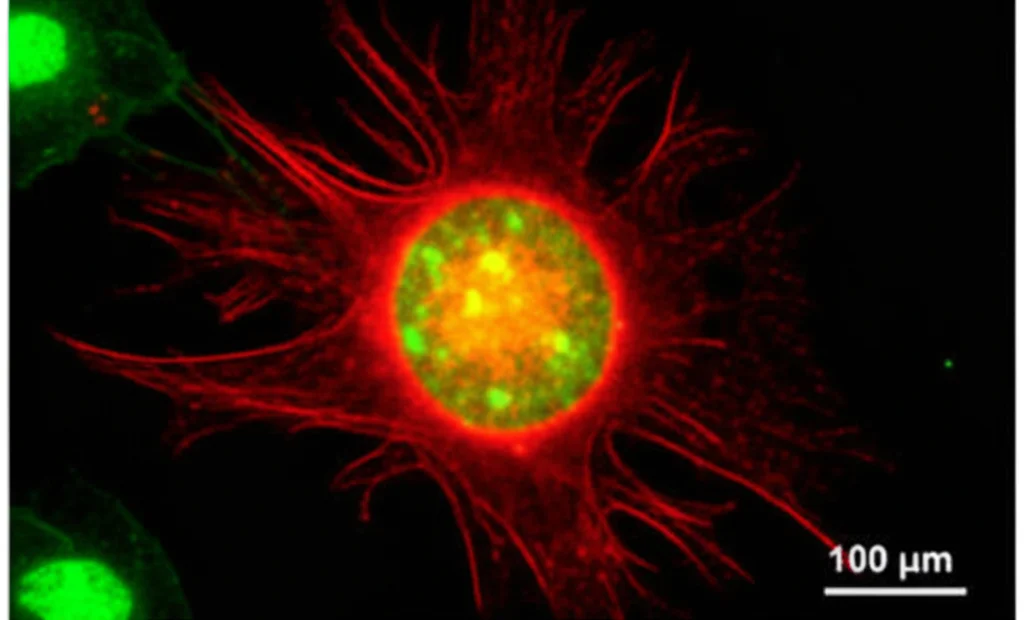
Abbiamo condotto esperimenti sia in vitro (in coltura cellulare) che in vivo (in modelli animali). Abbiamo “etichettato” le cellule di glioma con una proteina fluorescente verde (GFP) e le GA-MSC con una rossa (mCherry). Mettendole insieme, dopo sole 24 ore abbiamo iniziato a vedere cellule che brillavano sia di verde che di rosso: le nostre cellule ibride! Abbiamo usato anche altre tecniche, come marcare i nuclei delle cellule di glioma e la membrana delle GA-MSC, confermando che avveniva una vera e propria fusione. Ancora più importante, abbiamo iniettato un mix di queste cellule nel cervello di topi: dopo tre settimane, nei tumori che si erano formati, abbiamo trovato cellule che esprimevano entrambe le proteine fluorescenti. La fusione avviene anche nell’ambiente complesso del cervello! Abbiamo anche isolato queste cellule ibride sfruttando il fatto che avevamo ingegnerizzato le cellule parentali per resistere a due antibiotici diversi: solo le cellule fuse potevano sopravvivere a entrambi.
Un Cambiamento Sottile ma Potente: La Modifica m6A
Ok, abbiamo queste cellule ibride. Ma cosa le rende speciali? Abbiamo guardato a un livello molto profondo, quello delle modifiche dell’RNA. Esiste una modifica chimica molto comune chiamata N6-metiladenosina (m6A). Immaginatela come un’etichetta “post-it” che viene messa sull’RNA e ne influenza il destino (quanto dura, se viene tradotto in proteina, ecc.). L’m6A gioca ruoli cruciali in molte condizioni, cancro incluso. Ebbene, abbiamo scoperto che le cellule ibride glioma-GA-MSC hanno livelli significativamente più bassi di m6A rispetto alle cellule di glioma da cui derivano.
Il Regista della Demetilazione: L’Enzima FTO
Come avviene questa riduzione di “etichette” m6A? Ci sono enzimi che mettono le etichette (le “metiltransferasi” o “writers”) e altri che le tolgono (le “demetilasi” o “erasers”). Abbiamo controllato i livelli di questi enzimi e abbiamo trovato un chiaro sospettato: l’enzima FTO (Fat mass and obesity-associated protein), una demetilasi, era costantemente più espresso nelle cellule ibride. Per confermare il suo ruolo, abbiamo “spento” FTO nelle cellule ibride usando tecniche di silenziamento genico (shRNA). Risultato? I livelli di m6A sono risaliti! Quindi, è proprio FTO che, essendo più abbondante nelle ibride, rimuove le etichette m6A.

L’Effetto sul Campo di Battaglia: Reclutare e Corrompere i Macrofagi
Questa modifica m6A più bassa ha delle conseguenze. Abbiamo notato una cosa strana: mentre in vitro le cellule ibride non crescevano più velocemente delle cellule di glioma normali, in vivo, nel cervello dei topi, i tumori formati dalle ibride erano più grandi! Questo suggeriva che le ibride fossero più brave a interagire con il microambiente tumorale.
Abbiamo quindi analizzato quali geni avessero meno m6A e fossero più espressi nelle ibride. Tra questi, uno ha attirato la nostra attenzione: il gene CSF1 (Colony-Stimulating Factor 1). Il CSF1 è una citochina, una molecola segnale, nota per il suo ruolo nel reclutare e “istruire” i macrofagi. I macrofagi sono cellule immunitarie, una sorta di spazzini e poliziotti del nostro corpo. Nel TME del glioma, però, possono essere “corrotti” e trasformarsi in macrofagi di tipo M2, che invece di combattere il tumore, lo aiutano a crescere, promuovendo l’infiammazione cronica, la formazione di vasi e la soppressione immunitaria.
Abbiamo verificato: le cellule ibride producevano e secernevano molto più CSF1 delle cellule di glioma normali. E questo aumento dipendeva da FTO: spegnendo FTO, la produzione di CSF1 calava.
Il Meccanismo Svelato: m6A, YTHDF2 e Stabilità dell’RNA
Come fa la riduzione di m6A ad aumentare CSF1? Le etichette m6A spesso funzionano come segnali per la degradazione dell’RNA. Esistono delle proteine “lettrici” (readers) che riconoscono l’m6A e innescano questo processo. Una di queste è YTHDF2. Abbiamo ipotizzato che FTO, togliendo l’etichetta m6A dall’RNA di CSF1, impedisse a YTHDF2 di riconoscerlo e marcarlo per la distruzione. Meno degradazione = RNA più stabile = più proteina CSF1 prodotta.
I nostri esperimenti hanno confermato questo quadro:
- L’RNA di CSF1 nelle cellule ibride aveva effettivamente meno m6A.
- Spegnendo FTO, l’m6A su CSF1 aumentava e l’RNA diventava meno stabile (degradato più velocemente).
- Abbiamo dimostrato che YTHDF2 si lega all’RNA di CSF1.
- Spegnendo sia FTO che YTHDF2 nelle ibride, i livelli di CSF1 e la stabilità del suo RNA venivano parzialmente ripristinati, confermando che YTHDF2 è coinvolto in questo meccanismo m6A-dipendente.
L’Impatto Finale: Un Tumore Più Aggressivo
Quindi, la catena di eventi è questa: la fusione tra cellula di glioma e GA-MSC porta a un aumento di FTO. FTO riduce le etichette m6A sull’RNA di CSF1. Questo rende l’RNA di CSF1 più stabile, grazie all’azione (o meglio, alla mancata azione degradativa mediata da) YTHDF2. Le cellule ibride secernono più CSF1. Il CSF1 attira i macrofagi nel tumore e li spinge a diventare M2 pro-tumorali. Questo microambiente “amico” favorisce la crescita del glioma.
Abbiamo confermato l’importanza dei macrofagi: se li eliminavamo dai topi usando un farmaco apposito (clodronato), la differenza di crescita tra i tumori formati da cellule ibride e quelli formati da cellule normali spariva! Erano proprio i macrofagi reclutati e polarizzati dalle ibride a fare la differenza in vivo. Inoltre, spegnendo FTO nelle ibride, queste perdevano parte della loro capacità di attrarre e polarizzare i macrofagi in M2, sia in vitro che in vivo.
Cosa Significa Tutto Questo?
Questa ricerca svela un meccanismo di comunicazione cellulare nuovo e subdolo nel glioma. La fusione cellulare non è solo una curiosità biologica, ma un evento che può attivamente rimodellare il microambiente tumorale a favore del cancro, agendo su un asse ben preciso: FTO → m6A → CSF1 → Macrofagi M2.
Capire questi “dialoghi segreti” tra le cellule apre nuove prospettive terapeutiche. Potremmo puntare a inibire l’enzima FTO? O bloccare il segnale CSF1/CSF1R (cosa già in sperimentazione)? O addirittura trovare modi per impedire la fusione cellulare stessa?
Certo, ci sono ancora aspetti da approfondire. Ad esempio, dobbiamo capire meglio le diverse sotto-popolazioni di macrofagi coinvolte (quelli residenti nel cervello, le microglia, e quelli che arrivano dal sangue) e la loro esatta funzione. La classificazione M1/M2 è utile ma forse troppo semplicistica. Inoltre, tracciare la fusione cellulare in vivo rimane una sfida tecnica.
Ma il messaggio chiave è potente: nel cuore del glioma, cellule apparentemente diverse possono unirsi, creando entità ibride che orchestrano l’ambiente circostante per favorire la propria crescita. Un’alleanza inaspettata che dobbiamo imparare a smantellare.
Fonte: Springer