Accendiamo la Chimica con la Luce del Sole: Ecco i Fotoenzimi del Futuro!
Amici scienziati e curiosi di natura, preparatevi perché oggi vi racconto una storia che ha dell’incredibile, una di quelle scoperte che ti fanno dire: “Wow, la natura (e un po’ di ingegno umano) è davvero pazzesca!”. Parliamo di fotoenzimi, delle vere e proprie macchine molecolari che la natura usa per orchestrare reazioni chimiche sfruttando l’energia della luce. Pensate alla fotosintesi: è il fotoenzima per eccellenza! Ma noi scienziati siamo tipi ambiziosi, e ci siamo chiesti: possiamo creare dei fotoenzimi “su misura”, ancora più efficienti e selettivi, magari per reazioni che in natura non esistono?
Il Problema della “Vecchia Guardia”: La Benzofenone e i suoi Limiti
Fino a poco tempo fa, nel nostro laboratorio (e in molti altri, a dire il vero!), quando parlavamo di fotoenzimi ingegnerizzati, il protagonista indiscusso era un sensibilizzatore chiamato benzofenone. Immaginatelo come una piccola antenna capace di catturare la luce e trasferirne l’energia per far partire una reazione chimica. Figo, no? Beh, sì e no. La benzofenone ha un “difettuccio”: per attivarsi ha bisogno di luce ultravioletta (UV). Ora, la luce UV non è proprio il massimo: può danneggiare le molecole con cui lavoriamo, substrati inclusi, portando a reazioni collaterali indesiderate e riducendo l’efficienza del nostro processo. È un po’ come cercare di accendere un fiammifero in una polveriera: speri che si accenda solo il fiammifero, ma il rischio di far saltare tutto è alto! Inoltre, la sua “fame” di UV ne limita l’efficienza fotochimica e restringe il tipo di magie chimiche che possiamo compiere.
Non fraintendetemi, con la benzofenone abbiamo fatto passi da gigante, creando enzimi capaci di reazioni stereo-controllate, come le cicloaddizioni [2+2]. Ma sentivamo che si poteva fare di più, che c’era un potenziale inespresso, limitato proprio dalle caratteristiche non ottimali di questa “antenna”. Era come avere una Ferrari con il motore di una utilitaria.
La Svolta: Arriva il Tioxantone, l’Eroe della Luce Visibile!
E qui entra in gioco la nostra nuova star: il tioxantone. Questo sensibilizzatore è una vera primadonna, ma in senso buono! A differenza della benzofenone, il tioxantone adora la luce visibile, quella che ci circonda ogni giorno, molto più “gentile” e precisa. Ha un assorbimento luminoso che si estende nello spettro del visibile ed è meno incline a “distrarsi” con reazioni secondarie che compromettono l’efficienza del trasferimento di energia (EnT). Insomma, è più efficiente e selettivo.
La vera sfida, però, era come “montare” questo tioxantone all’interno di una proteina in modo preciso, come un gioielliere incastona una gemma. Non potevamo semplicemente “incollarlo” a caso. La soluzione? L’ingegneria genetica! Abbiamo sviluppato una coppia ortogonale di Methanococcus jannaschii tirosil-tRNA sintetasi/tRNA per codificare amminoacidi non canonici contenenti tioxantone direttamente nella struttura della proteina durante la sua sintesi. È come aver insegnato alla cellula un nuovo “dialetto” del codice genetico, permettendole di costruire proteine con questo nuovo mattoncino superpotenziato.
Grazie a questo trucchetto, siamo riusciti a inserire il tioxantone in posizioni strategiche all’interno di enzimi, creando dei veri e propri “siti attivi potenziati dalla luce”. E i risultati? Beh, lasciate che ve li racconti!
![Immagine macro di un fotoenzima ingegnerizzato (VEnT1.3) al lavoro, con una molecola di tioxantone blu brillante che assorbe luce visibile all'interno di una tasca proteica complessa. Il substrato chinolonico è visibile mentre si avvicina per una reazione di cicloaddizione [2+2]. Illuminazione controllata da laboratorio, alta definizione, obiettivo macro 60mm, focus preciso sulla molecola di tioxantone.](https://scienzachiara.it/wp-content/uploads/2025/05/205/093_immagine-macro-di-un-fotoenzima-ingegnerizzato-vent13-al-lavoro-con-una-molecola-di-tioxantone-blu-brillante-che.webp)
Un Campione di Efficienza: Il Cicloadduttore [2+2] VEnT1.3
Per prima cosa, abbiamo messo alla prova il nostro sistema con una reazione di cicloaddizione [2+2] intramolecolare, usando un derivato chinolonico. Abbiamo preso un enzima che avevamo già “allenato” con la benzofenone (chiamato EnT1.3) e abbiamo sostituito il vecchio sensibilizzatore con il nostro fiammante tioxantone, creando una variante che abbiamo battezzato VEnT1.0. Già così, i risultati erano promettenti: buona stereocontrollo e attività decisamente migliore rispetto al tioxantone “libero” in soluzione.
Ma noi non ci accontentiamo! Abbiamo sottoposto VEnT1.0 a tre round di evoluzione diretta. Immaginatevi un addestramento intensivo, in cui l’enzima viene modificato casualmente in alcuni punti e poi testato. Solo i “mutanti” migliori, quelli più veloci e precisi, passano al round successivo. Dopo aver analizzato circa 5.300 cloni (sì, un lavoraccio!), è emerso un campione: VEnT1.3. Questo enzima è risultato essere ordini di grandezza più efficiente dei precedenti fotoenzimi basati su benzofenone, con una velocità catalitica (kcat) di 13 s-1 e oltre 1.300 turnover! Tradotto: è una scheggia e lavora tantissimo prima di stancarsi. E la cosa fantastica è che funziona benissimo anche in presenza di ossigeno, cosa non scontata per questi sistemi, e produce il prodotto desiderato con una purezza enantiomerica superiore al 99%. Addirittura, la stereochimica del prodotto è opposta a quella ottenuta con l’enzima a benzofenone, il che ci dice quanto sia fine il controllo che possiamo esercitare!
Per darvi un’idea, in esperimenti comparativi, mentre VEnT1.3 raggiungeva oltre il 40% di resa in 60 secondi, il suo “cugino” con benzofenone, EnT1.3, non dava segni di vita nemmeno dopo 200 secondi di irradiazione. Una bella differenza, no?
Domare Reazioni Complesse: Nascono i β-Lattamici Spirociclici con SpEnT1.3
Contenti ma non sazi, abbiamo alzato l’asticella. Volevamo dimostrare che i nostri enzimi al tioxantone potevano affrontare sfide chimiche ancora più ardue. Abbiamo puntato alla sintesi di β-lattamici spirociclici, strutture complesse presenti in molti farmaci, attraverso un’inserzione C-H selettiva su substrati chinolonici eccitati. Questa è una reazione che, con i catalizzatori tradizionali a piccole molecole, dà un sacco di problemi: si formano un sacco di isomeri diversi e, peggio ancora, il substrato tende a decomporsi per vie traverse.
Abbiamo quindi ingegnerizzato un secondo enzima, che abbiamo chiamato SpEnT1.0, riposizionando il tioxantone in un’altra tasca per accogliere substrati più ingombranti. Anche qui, l’evoluzione diretta ha fatto la sua magia. Dopo aver vagliato circa 3.200 cloni, è nato SpEnT1.3, un vero artista della selettività. Questo fotoenzima non solo è tollerante all’ossigeno, ma guida la reazione verso la formazione di un singolo stereoisomero del β-lattamico spirociclico con una purezza enantiomerica del 99% e un rapporto diastereoisomerico di 22:1! Impressionante, vero?
Ma la cosa forse più sbalorditiva è che SpEnT1.3 sopprime quasi completamente la via di decomposizione del substrato che affliggeva i catalizzatori a piccola molecola. Mentre con il tioxantone libero o con SpEnT1.0 la decomposizione era la reazione dominante (oltre il 50% dei prodotti), con SpEnT1.3 i prodotti di scarto erano solo un misero 5%. Questo dimostra la capacità incredibile degli enzimi ingegnerizzati di controllare il destino degli intermedi eccitati, quasi “accompagnandoli per mano” verso il prodotto desiderato e tenendoli lontani dai guai.
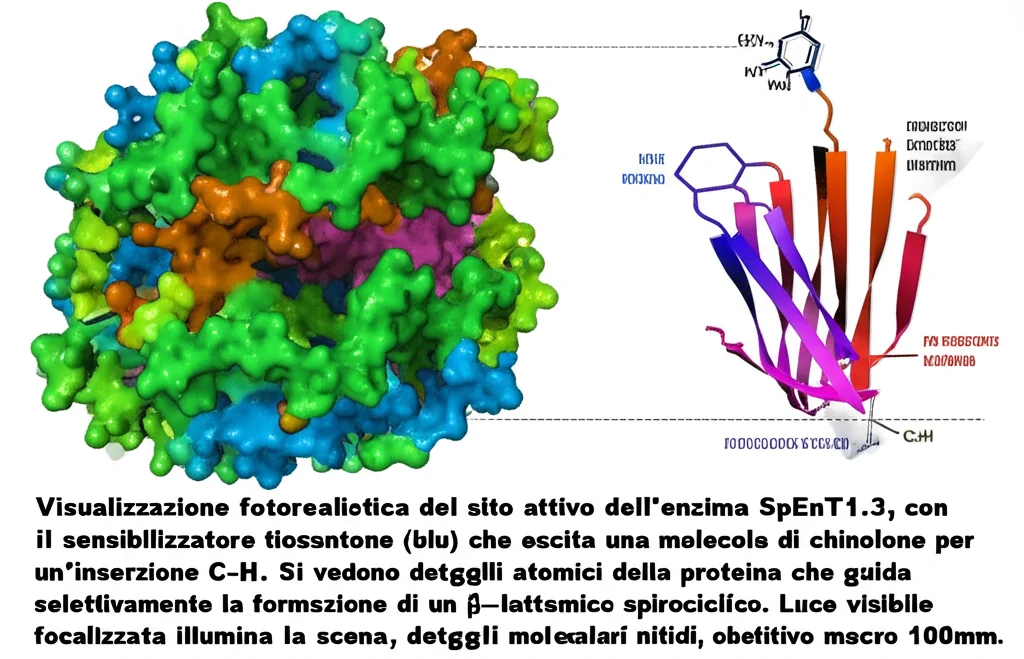
Le analisi cinetiche hanno rivelato che anche SpEnT1.3 è un portento, con una kcat di 8.7 s-1 e oltre 300 turnover in condizioni aerobiche. E sì, funziona alla grande anche per sintesi su scala preparativa, permettendoci di ottenere milligrammi di prodotto puro.
Dentro l’Enzima: Uno Sguardo al Meccanismo
Ma come fanno questi enzimi a essere così bravi? Abbiamo usato la cristallografia a raggi X per “fotografare” la struttura di VEnT1.3 e SpEnT1.3. Queste immagini tridimensionali ci hanno mostrato come le mutazioni introdotte durante l’evoluzione diretta abbiano rimodellato finemente la tasca del sito attivo. Il sensibilizzatore tioxantone è posizionato in modo ottimale, e nel caso di VEnT1.3, adotta una posa simile a quella della benzofenone nel vecchio EnT1.3, ma con performance nettamente superiori.
L’ambiente proteico gioca un ruolo cruciale: non solo posiziona il substrato vicino al tioxantone eccitato per un efficiente trasferimento di energia (a circa 3.2 Å, una distanza intima!), ma estende anche la vita dello stato di tripletto del tioxantone. Per esempio, in VEnT1.3, la vita del tripletto è di 18.4 µs, molto più lunga dei 5.0 µs del tioxantone libero in condizioni anaerobiche, e sorprendentemente stabile anche in presenza di ossigeno (mentre il tioxantone libero viene “spento” rapidamente dall’ossigeno). Questo confinamento nella tasca idrofobica del sito attivo sembra anche facilitare il passaggio allo stato di tripletto, riducendo la fluorescenza che invece è marcata nel tioxantone libero in acqua.
Residui specifici, come una Gln195, formano legami idrogeno con il substrato, aiutando a bloccarlo nella giusta conformazione e orientamento per la reazione. È un po’ come avere una culla su misura che presenta il bebè (il substrato) nel modo perfetto per la foto (la reazione).
Un Futuro Luminoso per la Foto-Biocatalisi
Cosa significa tutto questo? Beh, per me e per il mio team, è una dimostrazione lampante della potenza che si scatena quando uniamo l’espansione del codice genetico con l’ingegneria enzimatica. Non siamo più limitati ai pochi cofattori naturali: possiamo disegnare e installare sensibilizzatori “custom” nelle proteine, con proprietà fatte su misura per l’applicazione che abbiamo in mente.
Il fatto che i nostri fotoenzimi al tioxantone siano così efficienti e selettivi con la luce visibile apre scenari entusiasmanti. Immaginate di poter realizzare reazioni chimiche complesse in modo più pulito, efficiente ed economico, magari per produrre farmaci, agrochimici o materiali innovativi. La capacità di sopprimere reazioni collaterali indesiderate potrebbe permetterci di affrontare trasformazioni chimiche finora considerate impossibili o troppo “sporche” con i metodi tradizionali.
Il cammino è ancora lungo, ma le prospettive sono esaltanti. Continuando ad espandere il codice genetico, potremo avere a disposizione una vera e propria “cassetta degli attrezzi” di sensibilizzatori codificabili, ognuno con le sue peculiarità. Integrando questi nuovi elementi con il design computazionale di proteine e con piattaforme di screening ad alta processività, siamo ottimisti sulla possibilità di sviluppare enzimi per una vastissima gamma di trasformazioni fotochimiche preziose, spingendo i confini di ciò che è chimicamente possibile. La luce, amici miei, ha appena iniziato a mostrarci il suo vero potenziale catalitico!







