SMAD2 e Cancro al Polmone: Quella Modifica Inattesa che Riscrive la Sopravvivenza
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo dalla ricerca sul cancro al polmone, in particolare sul tipo non a piccole cellule (NSCLC), che purtroppo è ancora una delle principali cause di mortalità per cancro nel mondo. Ci addentreremo in un meccanismo molecolare specifico, una piccola modifica su una proteina chiamata SMAD2, e vedremo come questa possa avere un impatto enorme sulla malattia e sulla sopravvivenza dei pazienti. Sembra complicato? Tranquilli, cercherò di spiegarlo nel modo più chiaro e coinvolgente possibile!
Il Contesto: NSCLC e il Segnale di TGFβ
Partiamo dalle basi. L’NSCLC rappresenta la stragrande maggioranza dei tumori polmonari. Spesso viene diagnosticato tardi, quando le opzioni chirurgiche curative sono limitate. Negli ultimi anni, immunoterapia e terapie mirate hanno fatto passi da gigante, ma non tutti i pazienti ne beneficiano e le resistenze ai farmaci sono un problema enorme. Ecco perché capire i meccanismi alla base del tumore è fondamentale per trovare nuove strategie.
Uno dei protagonisti in questo scenario è il pathway di segnale del TGFβ (Transforming Growth Factor beta). Nel NSCLC, questo segnale è spesso “acceso” e contribuisce alla crescita del tumore e a un processo chiamato transizione epitelio-mesenchimale (EMT), che rende le cellule tumorali più invasive. Il TGFβ agisce principalmente tramite le proteine SMAD2 e SMAD3. Quando il recettore del TGFβ è attivato, aggiunge un gruppo fosfato (un processo chiamato fosforilazione) alla parte finale (C-terminale) di SMAD2/3. Queste proteine modificate (pSMAD2/3C) entrano nel nucleo e regolano l’espressione genica. Nelle cellule normali, questo segnale ha un effetto anti-proliferativo, ma nei tumori avanzati, paradossalmente, può favorire la progressione.
La Sorpresa: La Fosforilazione nel “Linker” di SMAD2 (pSMAD2L)
Qui arriva il bello. La fosforilazione di SMAD2/3 non avviene solo alla fine della proteina (C-terminale). Esiste un’altra regione, chiamata “linker”, che può essere fosforilata (pSMAD2L / pSMAD3L) da altri attori cellulari, come le chinasi MAPK o quelle legate al ciclo cellulare (CDK). Questa fosforilazione nel linker è come un’interfaccia che integra segnali diversi da quello del TGFβ e può cambiare completamente il comportamento della cellula.
Ci siamo chiesti: visto che il NSCLC prolifera nonostante il segnale TGFβ (che dovrebbe frenarlo), potrebbe essere che la fosforilazione nel linker di SMAD2 (pSMAD2L) giochi un ruolo nel “bypassare” questo freno?
pSMAD2L e la Divisione Cellulare: Un Legame Stretto
Abbiamo iniziato a indagare nelle cellule di NSCLC in laboratorio. La prima cosa che abbiamo notato è che pSMAD2L è molto più abbondante nelle cellule che si stanno dividendo (in mitosi). Abbiamo visto che si localizza vicino a strutture chiave per la mitosi, come i centrosomi (indicati dal marcatore PCNT) e i cromosomi condensati (marcati da pHH3). Sembra proprio che pSMAD2L sia coinvolta attivamente nella divisione cellulare.
Per capirne di più, abbiamo creato delle cellule A549 (una linea cellulare di adenocarcinoma polmonare) modificate geneticamente (usando CRISPR/Cas9) in cui i siti di fosforilazione nel linker di SMAD2 sono stati eliminati (le abbiamo chiamate A549Lsub). Cosa è successo?
- La proliferazione è rallentata: meno cellule entravano nella fase di divisione (G2/M).
- La capacità di migrare (muoversi) era ridotta.
- L’espressione di geni legati alla mitosi era alterata.
Questi risultati suggeriscono che pSMAD2L aiuta le cellule tumorali a proliferare, contrastando l’effetto anti-proliferativo del segnale canonico del TGFβ.
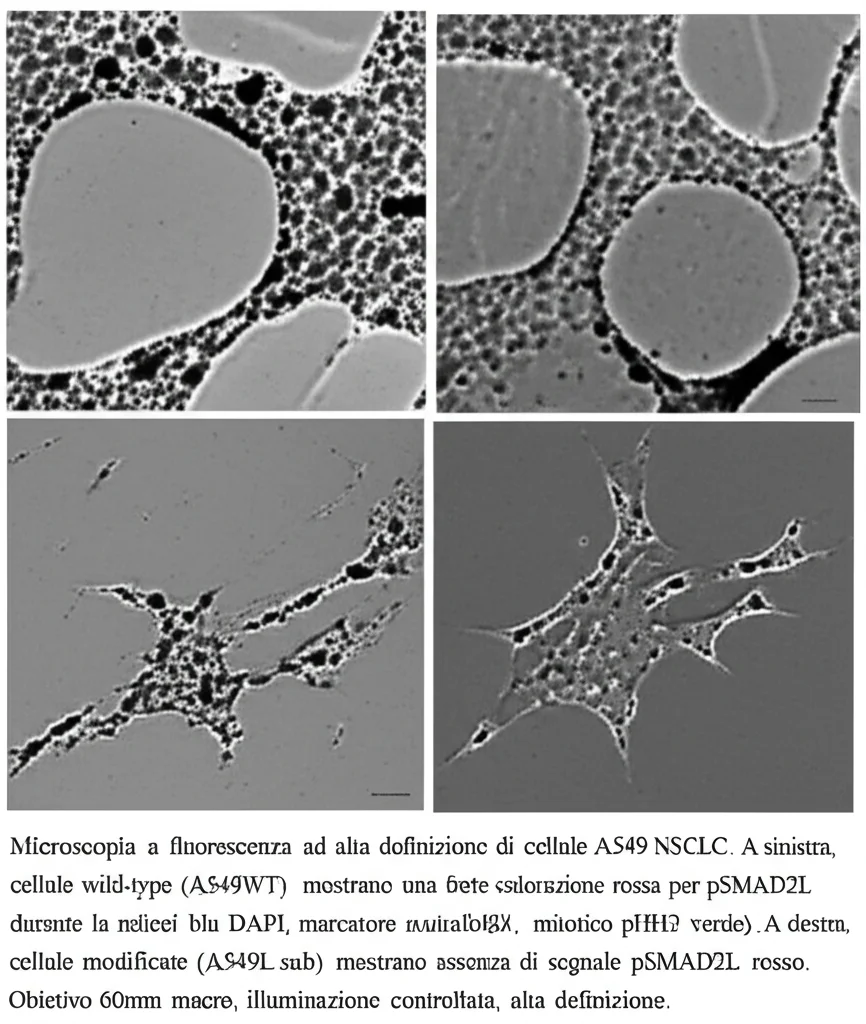
Curiosamente, abbiamo osservato un fenomeno simile anche in cellule non tumorali: i linfociti T sani. Quando li abbiamo stimolati a proliferare in vitro, anche loro mostravano un aumento di pSMAD2L durante la mitosi, mentre era assente nelle cellule T a riposo. Questo indica che il legame tra pSMAD2L e mitosi è un meccanismo conservato, presente sia in cellule sane che tumorali.
Chi Fosforila il Linker? Le CDK Entrano in Scena
Se pSMAD2L è legata alla mitosi, quali sono le “registe” di questa fosforilazione? Abbiamo puntato i riflettori sulle chinasi ciclina-dipendenti (CDK), motori chiave del ciclo cellulare. Usando inibitori specifici, abbiamo scoperto che bloccando CDK2 o CDK4/6 (ma non CDK1), la quantità di pSMAD2L diminuiva drasticamente, parallelamente alla diminuzione del marcatore mitotico pHH3. Quindi, sono proprio CDK2 e CDK4/6 a orchestrare la fosforilazione del linker di SMAD2 nel NSCLC. Questo apre scenari terapeutici interessanti, dato che esistono già farmaci inibitori di CDK4/6 (come il Palbociclib) usati per altri tumori.
Un’Altra Sorpresa: Lo Splice Variant Corto SMAD2ΔE3
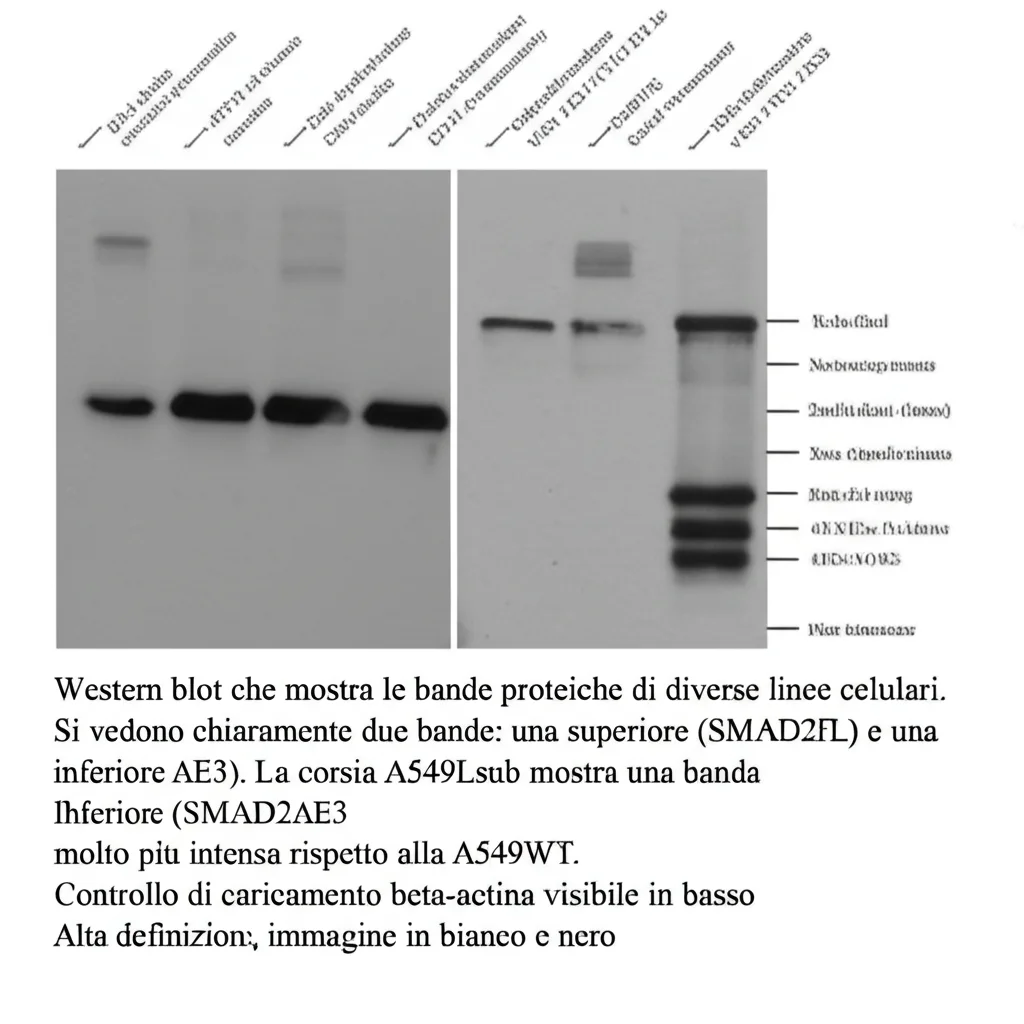
Analizzando le proteine nelle nostre cellule modificate A549Lsub (quelle senza pSMAD2L), abbiamo notato un’altra cosa inaspettata. La proteina SMAD2 totale era aumentata. Scavando più a fondo, abbiamo visto che esistono due versioni (splice variants) di SMAD2: una “full-length” (SMAD2FL) e una più corta, priva di un pezzetto chiamato Esone 3 (SMAD2ΔE3). Nelle cellule normali A549WT, la versione lunga predomina nettamente. Ma nelle cellule A549Lsub, senza pSMAD2L, la quantità della versione corta SMAD2ΔE3 aumentava tantissimo, arrivando quasi a eguagliare quella lunga!
Questa variante corta è nota per avere ruoli importanti durante lo sviluppo embrionale. E, guarda caso, anche bloccando CDK4/6 nelle cellule A549WT (mimando l’assenza di pSMAD2L), vedevamo aumentare SMAD2ΔE3. Sembra esserci una connessione inversa: meno pSMAD2L, più SMAD2ΔE3.
Abbiamo controllato anche in altri tipi cellulari:
- Altre linee di NSCLC avevano rapporti variabili tra le due varianti.
- Cellule epiteliali alveolari sane (AECII), considerate possibili progenitrici del NSCLC, avevano un profilo simile alle A549WT (poca SMAD2ΔE3).
- I linfociti T sani non esprimevano proprio la variante corta SMAD2ΔE3, né a riposo né in proliferazione.
- Invece, cellule di leucemia linfoblastica T (JURKAT), che sono maligne e proliferano, esprimevano sia pSMAD2L che SMAD2ΔE3.
Questo suggerisce che il rapporto tra pSMAD2L e SMAD2ΔE3 potrebbe essere legato allo stato di differenziazione e malignità della cellula.
L’Impatto Funzionale: Sviluppo, Staminalità e Risposta a TGFβ1
L’aumento di SMAD2ΔE3 e la perdita di pSMAD2L nelle cellule A549Lsub non erano solo curiosità molecolari. Analizzando l’espressione genica (trascrittoma), abbiamo visto che le cellule A549Lsub avevano un profilo associato a processi di sviluppo embrionale, morfogenesi e adesione cellulare. Funzionalmente, come detto, proliferavano e migravano meno, ma la loro capacità di invadere (attraversare una matrice) o crescere senza ancoraggio (in soft agar) non cambiava significativamente.
Ancora più intrigante: abbiamo usato un array proteico per vedere quali altre proteine cambiassero nelle cellule A549Lsub. Ebbene, abbiamo trovato un aumento significativo di proteine legate alla pluripotenza e alle cellule staminali tumorali (CSCs), come POU5F1/OCT4 e NANOG, mentre diminuiva la E-caderina (importante per l’adesione cellulare). Queste proteine staminali sono associate a resistenza alle terapie e a una prognosi peggiore nel NSCLC. Sembra quasi che la perdita di pSMAD2L, pur rallentando la proliferazione, spinga le cellule verso uno stato meno differenziato, più “staminale”.
E come cambia la risposta al segnale canonico del TGFβ? Abbiamo stimolato le cellule A549WT e A549Lsub con TGFβ1. Sorprendentemente, la perdita di pSMAD2L cambiava radicalmente quali geni venivano attivati o spenti da TGFβ1. Nelle A549Lsub, TGFβ1 attivava geni legati alla morfogenesi e alla proliferazione, mentre spegneva geni legati alla morte cellulare. Nelle A549WT, invece, attivava geni legati a neurogenesi e motilità. Questo dimostra che pSMAD2L agisce come un’interfaccia critica che “reindirizza” la risposta cellulare al segnale del TGFβ.
Il Quadro Clinico: pSMAD2L e la Sopravvivenza dei Pazienti
Tutto molto interessante in laboratorio, ma cosa succede nei pazienti con NSCLC? Abbiamo analizzato campioni di tessuto tumorale da una coorte di 316 pazienti, usando una tecnica di immunofluorescenza multiplex (mIF) per vedere dove si trovasse pSMAD2L (nelle cellule tumorali epiteliali, marcate con panCK, o nelle cellule immunitarie, marcate con CD45) e se le cellule fossero in mitosi (marcate con pHH3).
I risultati sono stati sorprendenti e, a prima vista, controintuitivi:
- Nelle cellule tumorali (panCK+): Una bassa densità di cellule pSMAD2L+ era associata a una prognosi peggiore (minore sopravvivenza globale, OS, e sopravvivenza libera da malattia, DFS). Al contrario, un’alta densità era favorevole.
- Nelle cellule immunitarie (CD45+), soprattutto nello stroma: Una bassa densità di cellule pSMAD2L+ era associata a una prognosi migliore (maggiore OS e DFS). Al contrario, un’alta densità era sfavorevole.
In pratica, l’effetto di pSMAD2L sulla sopravvivenza dipende drasticamente dal tipo di cellula in cui si trova!

Abbiamo quindi classificato i pazienti in base a questi due parametri (pSMAD2L nelle cellule tumorali e pSMAD2L nelle cellule immunitarie stromali). Lo scenario migliore, associato alla prognosi più favorevole, era quello con alta pSMAD2L nelle cellule tumorali E bassa pSMAD2L nelle cellule immunitarie stromali. Circa metà dei pazienti rientrava in questa categoria “favorevole”, mentre l’altra metà mostrava combinazioni associate a una prognosi peggiore.
Conclusioni e Implicazioni: Un Bersaglio Complesso
Cosa ci dice tutto questo? La fosforilazione del linker di SMAD2 (pSMAD2L) è molto più di un dettaglio molecolare.
- È legata alla proliferazione cellulare (mitosi) sia nelle cellule tumorali che in quelle sane, probabilmente contrastando l’effetto anti-proliferativo del TGFβ canonico.
- È orchestrata da CDK2 e CDK4/6.
- La sua assenza (o inibizione, ad esempio con inibitori di CDK4/6) riduce la proliferazione e la migrazione, ma induce l’espressione della variante corta SMAD2ΔE3 e di marcatori di staminalità (OCT4, NANOG), spingendo le cellule verso uno stato meno differenziato.
- Modula profondamente la risposta cellulare al segnale di TGFβ1.
- Nei pazienti con NSCLC, il suo impatto sulla sopravvivenza è opposto a seconda che si trovi nelle cellule tumorali (alta = buono) o nelle cellule immunitarie (alta = cattivo).
Questo quadro complesso ci mette in guardia sull’uso semplicistico di terapie che potrebbero influenzare pSMAD2L. Ad esempio, inibire CDK4/6 (come con Palbociclib) potrebbe sì frenare la proliferazione, ma rischia anche di indurre uno stato staminale più resistente e, a seconda del contesto immunitario, potrebbe non migliorare o addirittura peggiorare la prognosi complessiva.
La storia di pSMAD2L nel NSCLC è un esempio lampante di come la biologia del cancro sia intricata e contesto-dipendente. Capire queste sfumature è essenziale per sviluppare terapie davvero efficaci e personalizzate. La ricerca continua, e ogni pezzo del puzzle che aggiungiamo ci avvicina all’obiettivo!
Fonte: Springer






