Alzheimer: Una Finestra sul Cervello con la Luce Infrarossa – La fNIRS Rivela Nuovi Segreti
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona davvero tanto: come possiamo “sbirciare” dentro il cervello per capire meglio una malattia complessa come l’Alzheimer. Sappiamo tutti che l’Alzheimer è un osso duro, una malattia neurodegenerativa cronica che colpisce milioni di persone e che, purtroppo, è destinata ad aumentare. Si manifesta in modo subdolo, spesso con piccole dimenticanze che confondiamo con il normale invecchiamento, ma sotto la superficie, nel cervello, i cambiamenti patologici sono già in atto da anni.
La Sfida della Diagnosi Precoce
Uno dei problemi principali è proprio questo: la diagnosi arriva spesso tardi. Esistono tecniche come la PET amiloide o l’analisi del liquido cerebrospinale, ma sono costose e non facilmente accessibili a tutti. E le terapie? Beh, siamo ancora alla ricerca della bacchetta magica. I farmaci hanno un’efficacia limitata e le terapie non farmacologiche, come l’allenamento cognitivo o la stimolazione magnetica transcranica, hanno bisogno di una valutazione precisa della funzione cerebrale per essere davvero efficaci e personalizzate. Qui entra in gioco la tecnologia!
fNIRS: Illuminare il Cervello (Letteralmente!)
Avete mai sentito parlare della spettroscopia funzionale nel vicino infrarosso, o più semplicemente fNIRS? È una tecnica relativamente nuova nel campo delle neuroscienze, ma sta aprendo scenari incredibili. Immaginate una specie di “caschetto” leggero e portatile, che non usa radiazioni e non è sensibile ai piccoli movimenti. Questo strumento utilizza una luce nel vicino infrarosso (totalmente innocua!) per misurare in tempo reale i cambiamenti nel flusso sanguigno cerebrale, in particolare la concentrazione di emoglobina ossigenata (Oxy-Hb) e deossigenata (Deoxy-Hb).
Come funziona? È semplice: quando un’area del cervello si attiva, i neuroni lì presenti hanno bisogno di più energia. Questa energia arriva grazie al metabolismo del glucosio, che richiede ossigeno. L’ossigeno viene trasportato dall’emoglobina nel sangue. Quindi, se vediamo un aumento di Oxy-Hb in una certa zona, è un segnale indiretto che quell’area si sta attivando. È il principio dell’accoppiamento neurovascolare. La fNIRS, basandosi sulla legge di Beer-Lambert, ci permette di misurare queste variazioni sulla superficie della corteccia cerebrale. Fantastico, no?
Il Nostro Studio: Cosa Abbiamo Cercato (e Trovato)
Nel nostro studio, abbiamo usato proprio la fNIRS per confrontare l’attività cerebrale di persone con Alzheimer da lieve a moderato con quella di persone sane (il nostro gruppo di controllo). Volevamo capire se ci fossero differenze significative sia a riposo che durante un compito cognitivo specifico, il Verbal Fluency Test (VFT). Il VFT è un test semplice in cui si chiede alla persona di elencare il maggior numero possibile di parole appartenenti a una categoria (es. animali, frutta) in un tempo limitato. È un ottimo modo per valutare diverse funzioni cognitive come la memoria, la velocità di elaborazione e le funzioni esecutive.
Abbiamo reclutato 24 partecipanti, 17 nel gruppo Alzheimer (età media 76.88 anni) e 7 nel gruppo di controllo (età media 72.57 anni). Tutti hanno fatto un esame cognitivo (il famoso MMSE) e poi l’esame fNIRS.

Risultati Sorprendenti Durante il Compito VFT
E qui arrivano i risultati interessanti! Durante il test VFT, abbiamo osservato differenze notevoli. In molte aree della corteccia prefrontale – una zona cruciale per le funzioni cognitive superiori – i pazienti con Alzheimer mostravano valori di attivazione significativamente più bassi rispetto al gruppo di controllo. Non solo, anche la concentrazione media di emoglobina ossigenata (Oxy-Hb) era inferiore in diverse aree chiave, come la corteccia premotoria, l’area di Broca (importante per il linguaggio) e soprattutto l’area del polo frontale e la corteccia prefrontale dorsolaterale (DLPFC).
In pratica, sembra che il cervello dei pazienti con AD, in queste specifiche regioni, faccia più fatica ad “accendersi” e a ricevere l’ossigeno necessario quando messo sotto sforzo da un compito cognitivo. Curiosamente, la velocità con cui queste aree si attivavano non mostrava differenze significative nella maggior parte dei canali, suggerendo forse che il problema sia più legato all’intensità della risposta che alla sua rapidità iniziale.
Cosa Succede a Riposo? La Rete si Indebolisce
Ma non ci siamo fermati qui. Abbiamo analizzato i dati fNIRS anche durante lo stato di riposo, per vedere come le diverse aree cerebrali “comunicassero” tra loro. Questo si chiama connettività funzionale. Immaginate il cervello come una rete complessa: abbiamo misurato quanti “collegamenti” (edge) attivi c’erano tra le varie zone della corteccia prefrontale.
Anche qui, i risultati sono stati chiari: il numero totale di connessioni nella rete prefrontale era significativamente inferiore nel gruppo con Alzheimer. Questo suggerisce una minore forza di connessione funzionale. Le aree più colpite da questa “disconnessione” sembravano essere proprio la DLPFC e l’area del polo frontale (FPA), soprattutto nell’emisfero sinistro (interessante, dato che tutti i partecipanti erano destrimani).
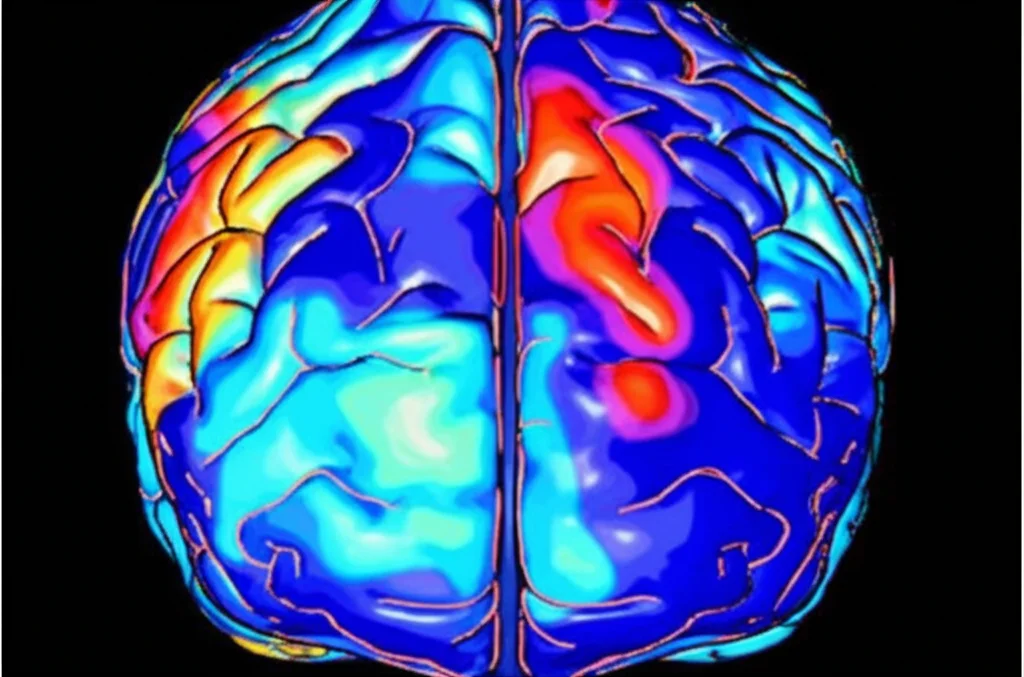
Il Legame con il Declino Cognitivo
La cosa ancora più importante è che abbiamo trovato una correlazione diretta tra questi risultati della fNIRS e i punteggi ottenuti dai pazienti nel test cognitivo MMSE. In parole povere: minore era l’attivazione durante il VFT, minore era la concentrazione di Oxy-Hb, e minore era la connettività funzionale a riposo, più bassi erano i punteggi cognitivi. Questo legame è fondamentale perché ci dice che ciò che misuriamo con la fNIRS riflette effettivamente il grado di deterioramento cognitivo del paziente. Analizzando più a fondo, abbiamo visto che specifiche connessioni (come quelle interne alla DLPFC sinistra o tra la DLPFC sinistra e altre aree) erano correlate a specifici domini cognitivi valutati dall’MMSE, come l’orientamento, la memoria, l’attenzione e il linguaggio.
Perché la Corteccia Prefrontale è Così Importante?
Ci siamo concentrati molto sulla corteccia prefrontale. Perché? Perché è un po’ la nostra “centralina”, la parte del cervello evolutivamente più recente e complessa, responsabile di funzioni cognitive superiori come la pianificazione, il giudizio, la memoria di lavoro, l’attenzione, il ragionamento e la regolazione delle emozioni. È strettamente collegata all’ippocampo, un’altra area fondamentale per la memoria. Un malfunzionamento in questa rete prefrontale-ippocampale è probabilmente alla base di molti sintomi dell’Alzheimer. La DLPFC, in particolare, sembra giocare un ruolo centrale.
fNIRS: Uno Strumento per il Futuro?
Cosa significa tutto questo in pratica? I nostri risultati suggeriscono che la fNIRS potrebbe diventare uno strumento prezioso nella pratica clinica.
- Screening precoce: Potrebbe aiutarci a identificare i segni di declino cognitivo molto prima che i sintomi diventino evidenti, magari distinguendo l’invecchiamento normale dall’inizio di una patologia.
- Valutazione personalizzata: Permette di mappare con precisione quali aree e quali connessioni sono più compromesse in un singolo paziente.
- Guida per terapie mirate: Queste mappe potrebbero guidare terapie non farmacologiche come la stimolazione magnetica transcranica (TMS) o altre forme di neurostimolazione, permettendo di “colpire” esattamente le aree che ne hanno più bisogno. Già studi sulla TMS hanno mostrato miglioramenti cognitivi stimolando proprio la DLPFC sinistra.
- Monitoraggio: Essendo portatile, non invasiva e ben tollerata, la fNIRS potrebbe essere usata per monitorare l’evoluzione della malattia o l’efficacia di un trattamento nel tempo, anche in ambienti riabilitativi reali.

Limiti e Prossimi Passi
Certo, ogni studio ha i suoi limiti. Il nostro campione era relativamente piccolo, e la fNIRS misura l’attività solo sulla superficie della corteccia. Inoltre, il segnale può essere influenzato da fattori non neuronali. Per il futuro, sarà importante ampliare il numero di partecipanti, utilizzare tecniche più avanzate per “pulire” il segnale e magari integrare la fNIRS con altre tecniche di imaging per avere una visione ancora più completa, magari dell’intero cervello.
In Conclusione
Nonostante i limiti, credo fermamente che la fNIRS rappresenti una strada promettente. Ci offre una finestra non invasiva e dinamica sui cambiamenti emodinamici che avvengono nel cervello dei pazienti con Alzheimer, sia a riposo che durante compiti cognitivi. Abbiamo visto che questi cambiamenti sono legati al declino cognitivo e possono aiutarci a identificare specifiche disfunzioni nella rete prefrontale. La possibilità di usare questa tecnologia per screening precoci e, soprattutto, per personalizzare e ottimizzare le terapie è davvero entusiasmante. È un passo avanti verso una gestione più precisa ed efficace dell’Alzheimer.
Fonte: Springer