Fludarabina: Un Soffio di Speranza per i Polmoni Infiammati Grazie alla Regolazione dell’Autofagia?
Ciao a tutti, appassionati di scienza e curiosi! Oggi voglio portarvi con me in un viaggio affascinante nel microscopico mondo dei nostri polmoni, più precisamente quando le cose si mettono male a causa di una brutta condizione chiamata danno polmonare acuto (ALI), che nella sua forma più grave conosciamo come sindrome da distress respiratorio acuto (ARDS). Immaginate i vostri polmoni, di solito così efficienti nel scambiare ossigeno e anidride carbonica, che improvvisamente si infiammano, si riempiono di liquidi e faticano a fare il loro lavoro. Una situazione davvero critica, con tassi di mortalità purtroppo ancora alti e, cosa frustrante, poche armi farmacologiche efficaci a nostra disposizione.
Ma la ricerca non si ferma mai, ed è proprio di una nuova, promettente scoperta che voglio parlarvi. Un recente studio ha acceso i riflettori su una molecola, la Fludarabina (Fluda), e sul suo potenziale ruolo nel calmare questa tempesta infiammatoria polmonare. Pronti a scoprire come?
L’Infiammazione Polmonare: Un Nemico Insidioso
Quando i nostri polmoni subiscono un insulto, come un’infezione batterica (spesso simulata in laboratorio con il famigerato lipopolisaccaride, o LPS, un componente della parete dei batteri Gram-negativi), si scatena una risposta immunitaria. Questa risposta, sebbene nata per difenderci, può diventare eccessiva e dannosa. Arrivano sulla scena i “soldati” del nostro sistema immunitario: macrofagi alveolari, neutrofili e altre cellule infiammatorie. Queste cellule rilasciano una cascata di molecole pro-infiammatorie come il TNF-α (fattore di necrosi tumorale alfa), l’IL-6 (interleuchina-6) e l’ossido nitrico (NO). Il risultato? Edema, difficoltà respiratorie e un generale “caos” a livello alveolare.
Pensate ai macrofagi alveolari come ai primi guardiani dei nostri polmoni. Sono fondamentali, ma se “impazziscono” a causa di uno stimolo come l’LPS, possono contribuire significativamente al danno. Ed è qui che entra in gioco un altro processo cellulare cruciale: l’autofagia.
Autofagia: Quando il “Riciclo” Cellulare Va in Tilt
L’autofagia è un meccanismo cellulare sofisticatissimo, una specie di “servizio di pulizia e riciclo” interno alla cellula. Permette di degradare e riutilizzare componenti cellulari danneggiati o superflui. Un processo vitale per mantenere l’omeostasi, cioè l’equilibrio interno della cellula. Durante l’autofagia, si formano delle vescicole chiamate autofagosomi, che inglobano il materiale da eliminare. Proteine come la LC3 (che passa dalla forma LC3-I alla LC3-II quando l’autofagia è attiva) e la p62 (che aiuta a “etichettare” il materiale da degradare e viene essa stessa degradata) sono marcatori chiave di questo processo.
Ora, cosa succede nell’ALI? Sembra che l’autofagia, in queste condizioni, vada un po’ in tilt. Invece di essere un processo protettivo e ben regolato, può diventare “disregolata”. Nello studio in questione, si è visto che l’esposizione a LPS portava a un accumulo sia di LC3-II che di p62 nelle cellule infiammatorie. Questo è un segnale che qualcosa non va: è come se la cellula iniziasse a produrre tanti sacchi della spazzatura (autofagosomi con LC3-II) ma poi non riuscisse a smaltirli correttamente (p62 non degradata), indicando un blocco nel flusso autofagico finale, cioè nella degradazione lisosomiale.
Questa autofagia disregolata sembra contribuire all’infiammazione e al peggioramento del danno polmonare. Ma come si collega tutto questo alla Fludarabina?
La Fludarabina e il Bersaglio STAT1/IRF1
Qui la storia si fa ancora più interessante. I ricercatori hanno identificato una via di segnalazione cellulare, chiamata JAK/STAT, e in particolare una proteina chiamata STAT1, come un attore chiave nell’innescare la risposta infiammatoria. Quando STAT1 viene attivata (fosforilata), migra nel nucleo della cellula e promuove la produzione di fattori pro-infiammatori. Un suo importante “braccio destro” in questo processo è IRF1 (Interferon Regulatory Factor 1), un fattore di trascrizione che anch’esso gioca un ruolo cruciale nella regolazione delle risposte immunitarie e dell’infiammazione.
Nello studio, si è osservato che l’LPS aumentava significativamente l’attivazione di STAT1 e l’espressione di IRF1 nei polmoni dei topi e nei macrofagi. Ed ecco il colpo di scena: la Fludarabina è un inibitore di STAT1! L’idea, quindi, è stata: e se bloccando STAT1 con la Fludarabina riuscissimo a ridurre l’infiammazione e magari a “riparare” l’autofagia impazzita?
Cosa Hanno Scoperto i Ricercatori? Risultati Promettenti!
Gli esperimenti sono stati condotti sia in vivo (su topolini con ALI indotta da LPS) sia in vitro (su cellule di macrofagi chiamate RAW264.7). E i risultati sono stati davvero incoraggianti!
Nei topolini trattati con Fludarabina prima dell’esposizione a LPS, si è osservato che:
- L’attivazione di STAT1 e l’espressione di IRF1 erano significativamente ridotte.
- L’infiltrazione di cellule infiammatorie (neutrofili e macrofagi) negli alveoli era diminuita.
- I livelli di citochine infiammatorie come TNF-α, IL-6, IFN-γ e la produzione di ossido nitrico (NO) e dell’enzima che lo produce (iNOS) erano calati.
- Il danno polmonare generale, valutato con un punteggio specifico, era inferiore.
Ma la cosa forse più intrigante riguarda l’autofagia. Utilizzando topolini transgenici che esprimono la proteina LC3 legata a una proteina fluorescente verde (GFP-LC3), i ricercatori hanno potuto visualizzare gli autofagosomi. L’LPS aumentava il numero di questi “puntini verdi” (autofagosomi) nelle cellule del liquido di lavaggio broncoalveolare (BAL), ma il pretrattamento con Fludarabina riduceva questa formazione eccessiva. Ancora più importante, la Fludarabina riduceva l’accumulo sia di LC3-II che di p62, suggerendo che non solo frenava la formazione eccessiva di autofagosomi, ma aiutava anche a ripristinare un corretto flusso autofagico, permettendo la degradazione del materiale accumulato.
Risultati simili sono stati ottenuti anche nelle cellule RAW264.7 in coltura: la Fludarabina ha spento la via STAT1/IRF1, ridotto la produzione di mediatori infiammatori e normalizzato i livelli di LC3-II e p62 indotti dall’LPS.
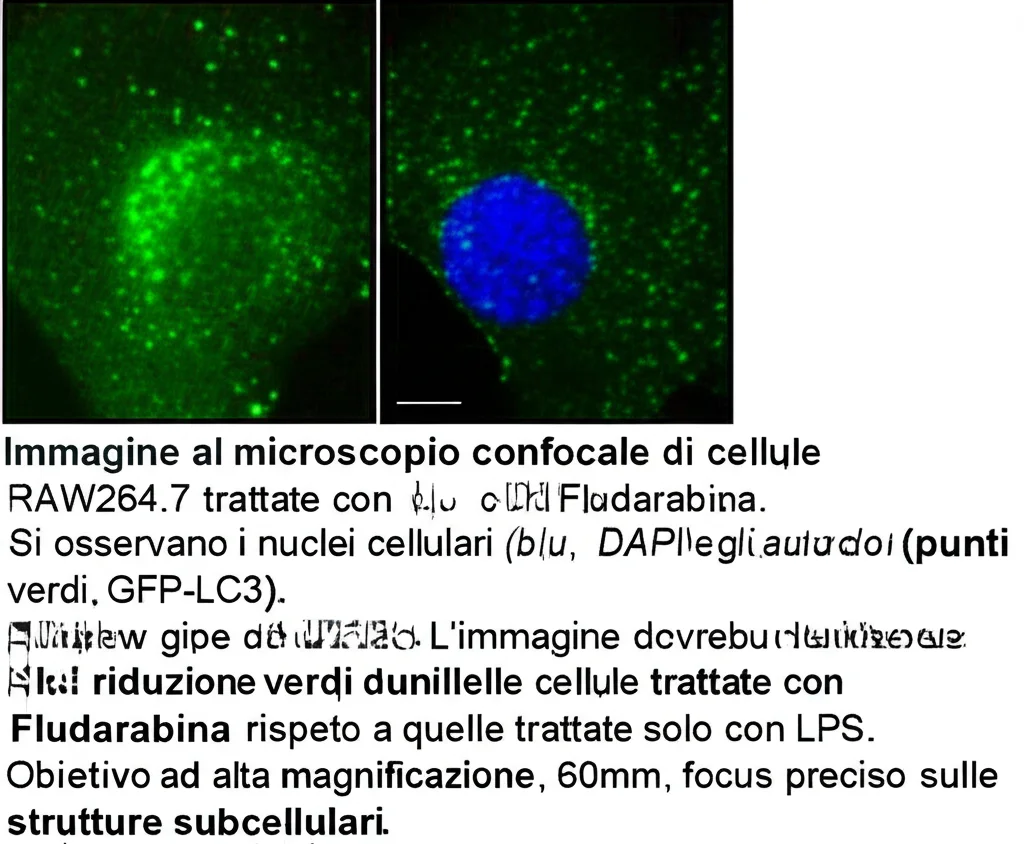
Il Meccanismo d’Azione: Un Effetto a Cascata
Sembra quindi che la Fludarabina, inibendo la via STAT1/IRF1, riesca a fare due cose importantissime:
- Ridurre l’infiammazione diretta: meno STAT1/IRF1 attivi significa meno segnali che dicono alla cellula di produrre molecole infiammatorie.
- Modulare l’autofagia disregolata: ripristinando un flusso autofagico più equilibrato, si evita l’accumulo di “spazzatura” cellulare che può essa stessa alimentare l’infiammazione.
Inoltre, lo studio ha mostrato che l’inibizione di STAT1/IRF1 da parte della Fludarabina portava anche a una riduzione dell’attivazione di altre due importanti vie di segnalazione infiammatoria: la via di NF-κB (in particolare la fosforilazione di p65) e la via delle MAPK (in particolare la fosforilazione di ERK1/2). È come se, bloccando il “generale” (STAT1/IRF1), si riuscisse a calmare anche i suoi “luogotenenti” (NF-κB e ERK).
Cosa Significa Tutto Questo per il Futuro?
Beh, è presto per cantare vittoria, ma i risultati sono decisamente promettenti! Questo studio suggerisce che la Fludarabina, un farmaco già utilizzato in clinica per alcune malattie ematologiche, potrebbe avere un nuovo, inaspettato ruolo nel trattamento dell’ALI/ARDS. L’idea di poter “spegnere” l’interruttore principale dell’infiammazione (STAT1/IRF1) e contemporaneamente “resettare” un processo di pulizia cellulare andato in tilt (autofagia) è davvero affascinante.
Certo, serviranno molte altre ricerche, prima su modelli animali più complessi e poi, se tutto andrà bene, sull’uomo, per confermare questi dati e capire dosaggi, tempistiche e sicurezza. Ma ogni passo avanti nella comprensione dei meccanismi alla base di malattie così gravi è una luce di speranza.
Personalmente, trovo incredibile come studiando i meccanismi più intimi delle nostre cellule si possano aprire strade per terapie innovative. La Fludarabina potrebbe un giorno diventare uno strumento in più nell’arsenale contro l’ALI, una condizione che, come abbiamo imparato anche troppo bene negli ultimi anni, può colpire duramente. Incrociamo le dita e continuiamo a seguire con passione i progressi della scienza!
Fonte: Springer