Cancro Vescica: Fibroblasti Svelano Come Attirare le Difese Immunitarie (e Perché è un Problema)
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo dalla ricerca sul cancro alla vescica, in particolare sulla forma muscolo-invasiva (MIBC), quella più aggressiva e difficile da trattare. Immaginate il tumore non come un’entità isolata, ma come un ecosistema complesso, il cosiddetto microambiente tumorale (TME). Questo ambiente è un mix intricato di cellule tumorali, matrice extracellulare e un sacco di altre cellule “normali” che però il tumore riesce a corrompere per i propri scopi. Tra queste ci sono i fibroblasti (spesso chiamati fibroblasti associati al cancro, o CAF) e le cellule del nostro sistema immunitario, come le cellule T.
Sappiamo da tempo che sia i CAF che le cellule T “esauste” (Tex), cioè quelle cellule immunitarie che hanno combattuto a lungo e hanno perso la loro efficacia, giocano un ruolo nel cancro alla vescica. Ma come interagiscono esattamente? Quali segnali si scambiano? Capirlo è fondamentale, perché queste interazioni possono favorire la crescita del tumore e la sua resistenza alle terapie.
La Lente d’Ingrandimento: il Sequenziamento a Singola Cellula
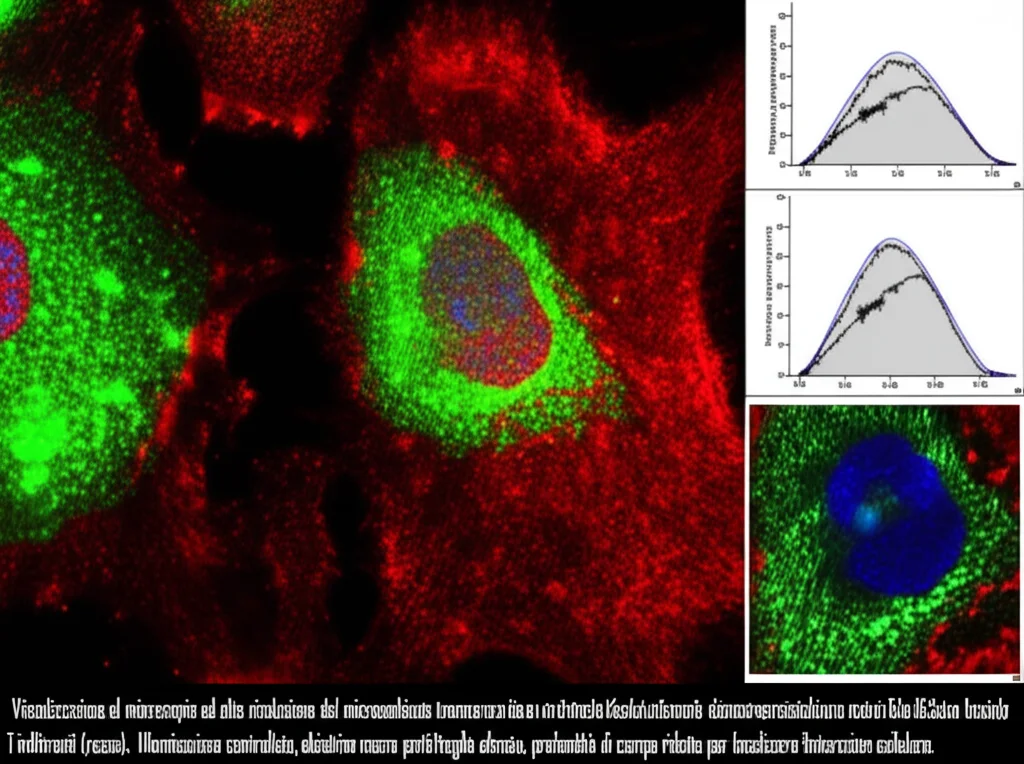
Per svelare questi meccanismi nascosti, abbiamo utilizzato una tecnologia potentissima: il sequenziamento dell’RNA a singola cellula (scRNA-seq). Pensatela come una lente d’ingrandimento molecolare che ci permette di guardare dentro ogni singola cellula del tumore e del suo microambiente, capendo esattamente cosa sta facendo, quali geni sta esprimendo.
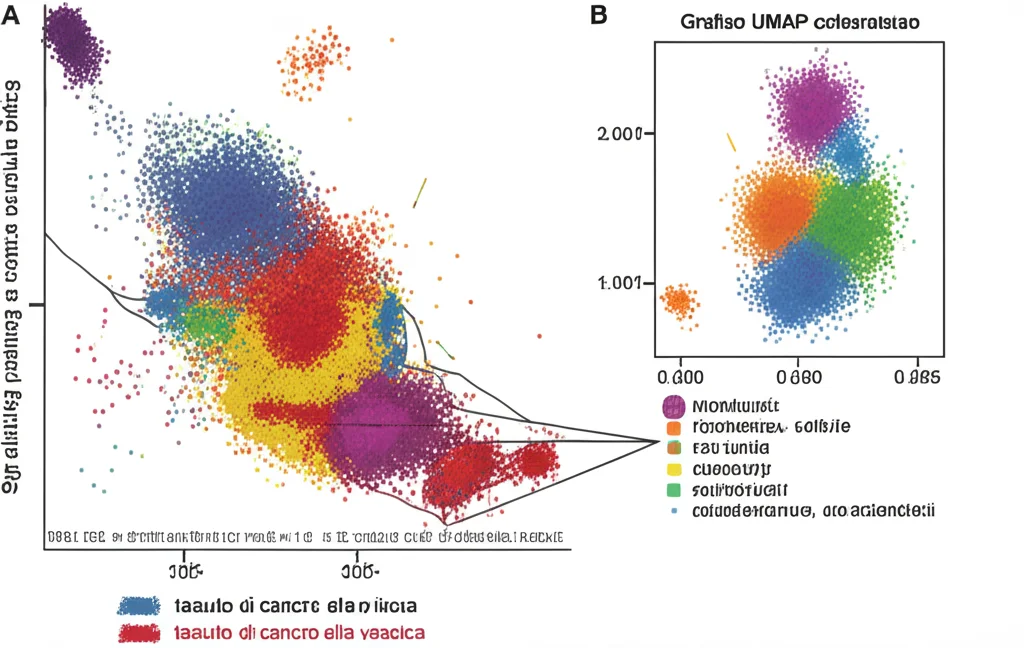
Abbiamo analizzato 19 campioni di tessuto provenienti da 12 pazienti: 7 con MIBC, 3 con cancro alla vescica non muscolo-invasivo (NMIBC) e 9 campioni di tessuto normale adiacente. In totale, abbiamo “spiato” l’attività di oltre 127.000 cellule! Questo ci ha permesso di creare una mappa dettagliata di questo complesso ecosistema.
Cosa abbiamo visto? Innanzitutto, abbiamo confermato che il TME del MIBC è diverso da quello del NMIBC e del tessuto normale. In particolare, nel MIBC c’è una maggiore infiltrazione di cellule immunitarie rispetto agli altri campioni. Sembra quasi che il sistema immunitario cerchi di reagire, ma qualcosa non funzioni a dovere.
Alla scoperta dei fibroblasti: chi sono e cosa fanno nel tumore
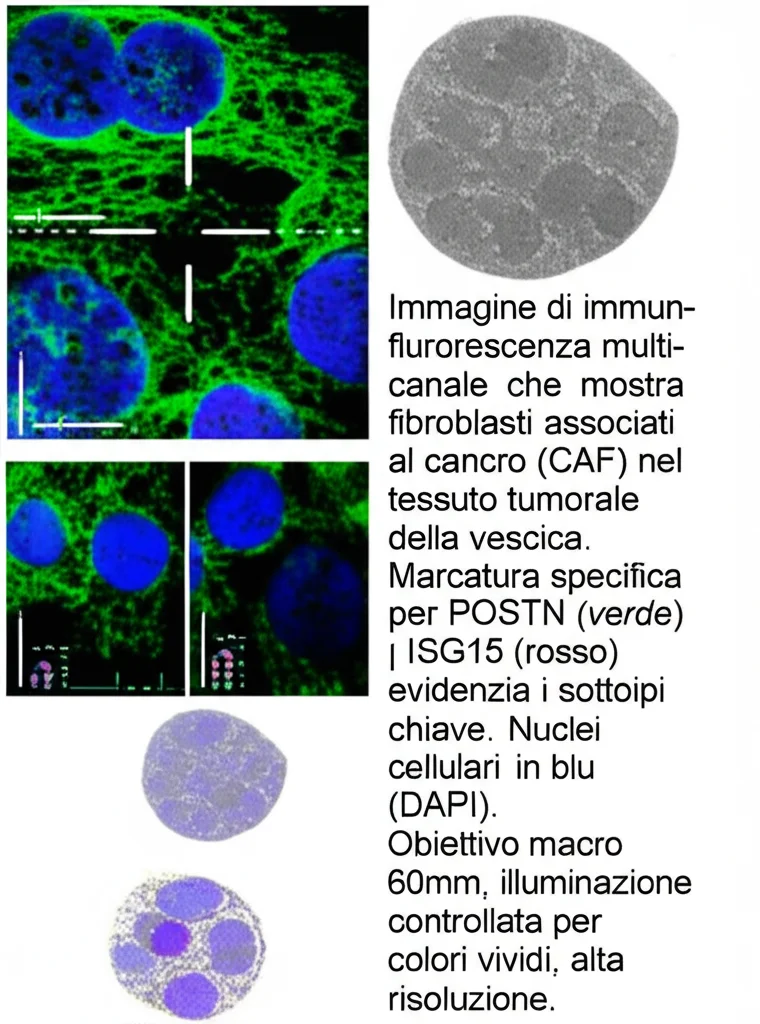
Concentrandoci sui fibroblasti, ne abbiamo identificati ben 13 tipi diversi, ognuno con una sua “personalità” trascrizionale. È incredibile pensare a quanta eterogeneità ci sia anche in cellule che potremmo considerare “di supporto”!
Due di questi cluster di fibroblasti sono risultati particolarmente abbondanti nel MIBC:
- F-ISG15: Li potremmo definire CAF “infiammatori”. Esprimono geni indotti dall’interferone (IFN), una molecola chiave nella risposta immunitaria.
- F-POSTN: Questi sono CAF “miofibroblastici”. Esprimono alti livelli di POSTN, una proteina della matrice cellulare coinvolta nella formazione di fibre di collagene e nella regolazione immunitaria.
Questi CAF non se ne stanno lì buoni. Producono un sacco di molecole che rimodellano l’ambiente circostante: collagene (che può rendere il tumore più “duro” e difficile da penetrare per farmaci e cellule immunitarie), enzimi chiamati metalloproteinasi (MMP) che degradano la matrice e facilitano la metastasi, e fattori di crescita che possono stimolare la formazione di nuovi vasi sanguigni (angiogenesi) per nutrire il tumore.
Ma la cosa forse più interessante è che questi CAF, specialmente quelli infiammatori, esprimono alti livelli di una chemochina chiamata CXCL12. Le chemochine sono come dei segnali “vieni qui” per le cellule immunitarie. E indovinate un po’? Molte cellule T esprimono il recettore per CXCL12, chiamato CXCR4.
Inoltre, l’analisi dei percorsi molecolari attivi in questi fibroblasti ha rivelato una forte associazione con le vie di segnalazione dell’interferone (IFN-α e IFN-γ). Questo suggerisce che l’interferone, una molecola prodotta dalle cellule immunitarie, possa “accendere” questi fibroblasti.
Le cellule T: soldati stanchi nel campo di battaglia del cancro
Passiamo ora alle cellule T, i soldati del nostro sistema immunitario. Ne abbiamo identificate 10 popolazioni diverse nel microambiente del cancro alla vescica. Anche qui, tanta eterogeneità!
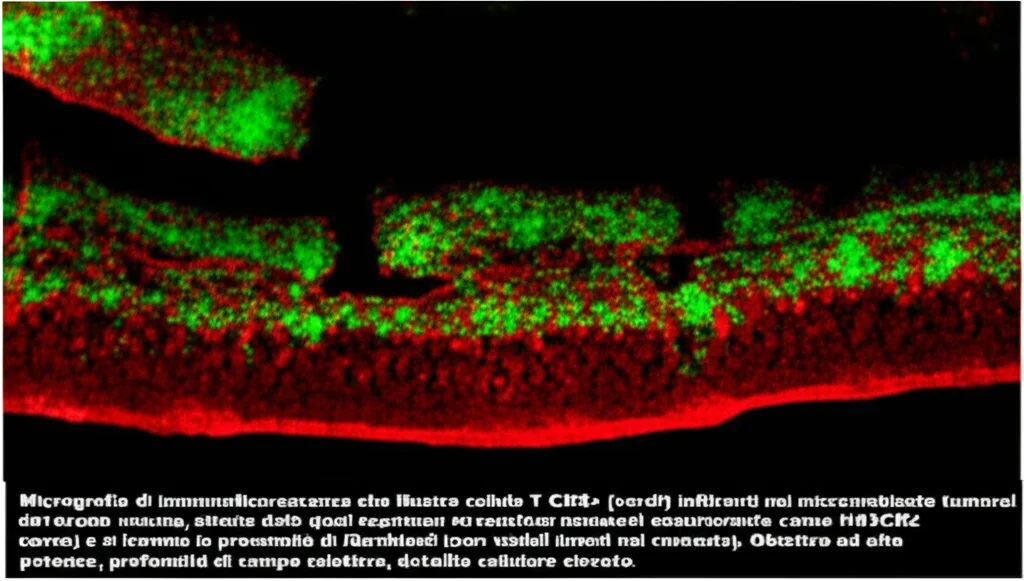
Nel MIBC, abbiamo notato una predominanza di cellule T regolatorie (Tregs), che hanno un ruolo immunosoppressivo, e di cellule T esauste (Tex). Queste Tex sono caratterizzate dall’espressione di marcatori di “stanchezza” come HAVCR2 (TIM-3), LAG3 e CTLA4. Curiosamente, l’espressione di PD-1, un altro famoso marcatore di esaurimento e bersaglio di molte immunoterapie, era relativamente bassa in queste cellule Tex, suggerendo che forse non è la via principale di esaurimento in questo contesto.
Un’altra scoperta chiave riguarda le cellule Tex CD8+: queste cellule esprimono alti livelli di IFN-γ. Proprio l’interferone che sembra attivare i nostri fibroblasti! Inoltre, alcune popolazioni di cellule T, incluse le Tex, esprimono il recettore CXCR4, rendendole potenziali bersagli della chemochina CXCL12 prodotta dai fibroblasti.
Le analisi suggeriscono che le cellule Tex CD8+ possano derivare da cellule T citotossiche (CTL) che, esposte cronicamente agli antigeni tumorali e all’ambiente infiammatorio (ricco di IFN-γ), diventano progressivamente disfunzionali.
Il dialogo segreto: come fibroblasti e cellule T si influenzano a vicenda
Mettendo insieme i pezzi, emerge un quadro affascinante e, purtroppo per i pazienti, vizioso. Abbiamo usato analisi computazionali (come CellChat) per mappare le comunicazioni tra cellule. Risultato? I fibroblasti, in particolare i CAF infiammatori, “parlano” alle cellule T usando la chemochina CXCL12. Le cellule T, che esprimono il recettore CXCR4, rispondono a questo richiamo e vengono attirate nel microambiente tumorale.
Ma non finisce qui. Le cellule T esauste (Tex), una volta arrivate, producono IFN-γ. Questo IFN-γ, a sua volta, agisce sui fibroblasti, stimolandoli a produrre ancora più CXCL12 e mantenendoli in uno stato attivato. Si crea così un ciclo autoperpetuante:
- Le Tex producono IFN-γ.
- L’IFN-γ attiva i CAF.
- I CAF attivati producono CXCL12.
- CXCL12 attira altre cellule T CXCR4+ (incluse future Tex).
- Il ciclo ricomincia, mantenendo un ambiente immunosoppressivo e favorendo l’infiltrazione di cellule T disfunzionali.
Abbiamo confermato questi risultati con esperimenti in vitro. Stimolando fibroblasti umani con IFN-γ, abbiamo visto un aumento significativo della secrezione di CXCL12. Inoltre, abbiamo osservato che le cellule T CD8+ nel sangue di pazienti con MIBC esprimono livelli più alti di CXCR4 rispetto a donatori sani. Infine, esperimenti di migrazione hanno dimostrato che CXCL12 induce effettivamente le cellule T CXCR4+ a muoversi.
Implicazioni cliniche e prospettive future: nuove armi contro il cancro alla vescica?
Ma cosa significa tutto questo per i pazienti? Analizzando dati clinici e genomici dal database TCGA, abbiamo scoperto che una “firma” genica associata a questi fibroblasti attivati (in particolare quelli che esprimono ISG15 e POSTN) è correlata a stadi più avanzati della malattia e a una sopravvivenza ridotta nei pazienti con MIBC. Questo sottolinea il ruolo negativo di questi specifici CAF.
La buona notizia è che questa ricerca apre nuove strade terapeutiche. Se riusciamo a interrompere questo dialogo deleterio tra fibroblasti e cellule T, potremmo migliorare la risposta immunitaria contro il tumore. L’asse CXCL12-CXCR4 e la via di segnalazione dell’IFN emergono come bersagli critici. Bloccare CXCL12 o il suo recettore CXCR4, o modulare la risposta all’IFN-γ nel microambiente tumorale, potrebbero essere strategie innovative per “risvegliare” il sistema immunitario e migliorare l’efficacia delle terapie esistenti, inclusa l’immunoterapia.
Certo, la strada è ancora lunga. Serviranno ulteriori studi, anche in modelli animali, per validare questi meccanismi e testare potenziali farmaci. Ma aver identificato questa specifica firma genica dei fibroblasti e il suo ruolo nel richiamare cellule T esauste è un passo avanti fondamentale nella comprensione del MIBC. Ci dà una mappa più chiara del campo di battaglia e suggerisce nuovi modi per sabotare le strategie del nemico.
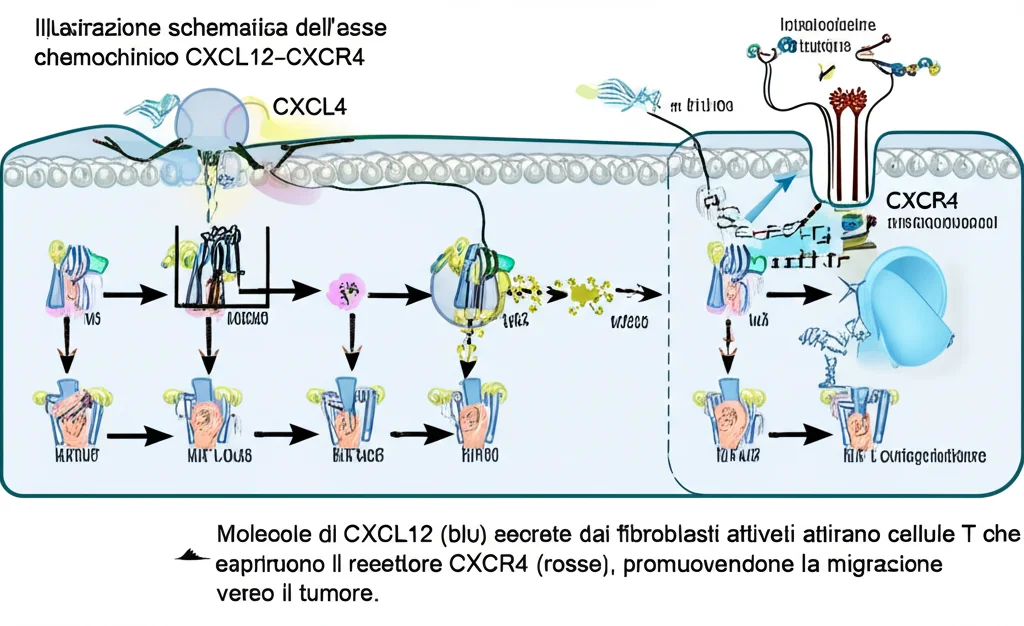
In conclusione, il microambiente tumorale del cancro alla vescica muscolo-invasivo è un luogo di interazioni complesse e dinamiche. Grazie al sequenziamento a singola cellula, stiamo iniziando a decifrare il linguaggio segreto usato dalle cellule tumorali e dai loro “complici” stromali, come i fibroblasti, per manipolare il sistema immunitario. La scoperta di questo loop IFN-γ → CXCL12 → CXCR4 → Infiltrazione Tex ci offre non solo una comprensione più profonda della malattia, ma anche bersagli concreti per sviluppare terapie più efficaci e personalizzate. Continuiamo a esplorare questo affascinante micro-mondo, perché è lì che si nascondono molte delle risposte che cerchiamo nella lotta contro il cancro.
Fonte: Springer