FGF10 Super Stabile: Quando Troppa Stabilità Causa Problemi Nello Sviluppo
Avete mai pensato a come il nostro corpo si costruisce pezzo per pezzo durante lo sviluppo embrionale? È un processo incredibilmente complesso, orchestrato da una miriade di molecole che agiscono come messaggeri, dicendo alle cellule quando crescere, quando differenziarsi, quando muoversi. Tra questi messaggeri, i Fattori di Crescita dei Fibroblasti (FGF) giocano un ruolo da protagonisti. Controllano la formazione di organi vitali come polmoni e arti, ma sono anche fondamentali per mantenere i nostri tessuti sani e ripararli quando serve nell’organismo adulto.
Il Mistero dell’Instabilità degli FGF
Nonostante la loro importanza cruciale, c’è ancora molto che non sappiamo su come funzionano esattamente gli FGF. Una cosa curiosa che abbiamo notato è la loro stabilità termica. Immaginate 22 diversi FGF nei mammiferi: alcuni sono dei veri “duri”, restando stabili e attivi alla temperatura corporea (circa 37°C) per più di 24 ore. Altri, invece, sono incredibilmente fragili e perdono la loro attività in pochi minuti! Come mai questa enorme differenza? E, soprattutto, che impatto ha questa (in)stabilità sulla loro funzione durante lo sviluppo? È una domanda che mi ha sempre affascinato.
FGF10: La “Diva” Instabile dello Sviluppo
Tra gli FGF più “delicati”, spicca FGF10. È fondamentale per lo sviluppo di polmoni e arti, ma è anche uno dei meno stabili. A 37°C, tende a “srotolarsi”, perdendo la sua forma tridimensionale corretta, e viene rapidamente inattivato. Pensate: ha un’emivita di meno di 30 minuti in coltura cellulare! Ci siamo chiesti: e se questa instabilità non fosse un difetto, ma una caratteristica voluta, un meccanismo di regolazione?
Creare un FGF10 “Potenziato”: Nascono gli FGF10-STAB
Per capirlo, abbiamo deciso di “ingegnerizzare” FGF10. Usando tecniche di mutagenesi mirata, guidate da modelli computerizzati e analisi evolutive, siamo riusciti a creare diverse varianti di FGF10 molto più stabili, che abbiamo chiamato FGF10-STAB (STAB sta per “stabilizzato”, ovviamente!). Queste versioni potenziate hanno una temperatura di fusione (il punto in cui iniziano a perdere la forma) superiore di oltre 19°C rispetto all’FGF10 normale (wildtype). Un bel salto!
Abbiamo verificato che a 37°C, mentre circa metà dell’FGF10 normale si “disfa” entro 8 ore, i nostri FGF10-STAB restano perfettamente integri per almeno 24 ore. Non solo, sono anche molto più resistenti alla degradazione da parte di enzimi (come la tripsina): l’FGF10 normale viene distrutto in 10 minuti, mentre gli STAB resistono per ore!
Funzionano Come l’Originale? Test in Laboratorio
La prima cosa da fare era controllare se queste versioni “potenziate” funzionassero ancora come l’originale, almeno all’inizio. Abbiamo condotto una serie di esperimenti in vitro:
- Legame ai recettori: Gli FGF10-STAB si legano ai loro recettori specifici (soprattutto FGFR2b) con un’affinità molto simile a quella dell’FGF10 wildtype. Nessuna sorpresa qui.
- Attivazione della segnalazione: Una volta legati, attivano le vie di segnalazione a valle (come le vie ERK-MAPK e PI3K/AKT) esattamente come l’originale, sia in termini di intensità che di durata iniziale.
- Espressione genica: Inducono l’espressione degli stessi geni bersaglio dell’FGF10 normale nelle prime ore dopo il trattamento.
Fin qui, tutto normale. Ma la vera differenza emerge quando mettiamo alla prova la loro resistenza. Se pre-incubiamo l’FGF10 normale a 37°C per qualche ora prima di aggiungerlo alle cellule, la sua attività crolla drasticamente. Gli FGF10-STAB, invece, rimangono perfettamente attivi anche dopo 24 ore (e in alcuni casi, addirittura dopo 15 giorni!) a 37°C. Questo ci dice che la stabilità fa davvero la differenza sulla “durata” del segnale.
Effetti a Lungo Termine: Proliferazione e Migrazione Cellulare
Cosa succede quando il segnale dura più a lungo? Abbiamo testato gli effetti sulla proliferazione e sulla migrazione cellulare, processi che richiedono un segnale sostenuto nel tempo.
- Proliferazione: In cellule epiteliali polmonari (4MBr-5), gli FGF10-STAB hanno stimolato la crescita cellulare in modo molto più marcato rispetto all’FGF10 wildtype, soprattutto dopo 7 giorni di trattamento.
- Migrazione: In un test che simula la guarigione di una ferita (scratch assay su cellule MCF7), gli FGF10-STAB hanno accelerato significativamente la “chiusura” della ferita rispetto all’originale.
Quindi, la maggiore stabilità si traduce in un’attività biologica potenziata nel lungo periodo.
Quando la Stabilità Diventa un Problema: Sviluppo Polmonare Anomalo
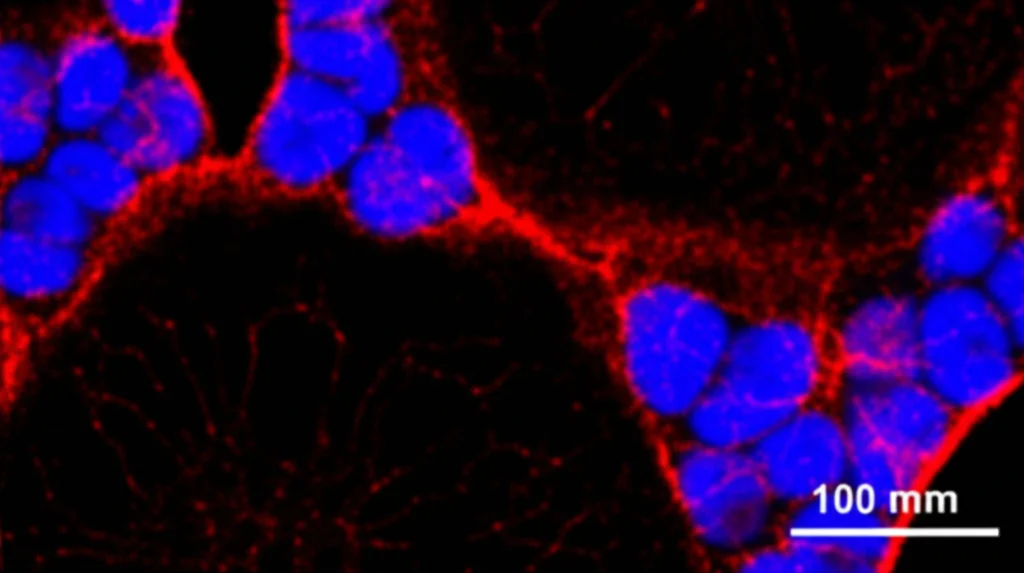
Qui le cose si fanno davvero interessanti. FGF10 è cruciale per la morfogenesi polmonare, in particolare per la corretta ramificazione delle vie aeree. Abbiamo preso dei polmoni embrionali di topo in uno stadio precoce (E11.25) e li abbiamo coltivati ex vivo (in laboratorio) con FGF10 normale o con i nostri FGF10-STAB.
I risultati sono stati sorprendenti:
- L’FGF10 wildtype (a 500 ng/ml) ha avuto effetti modesti.
- Gli FGF10-STAB (già a 100-200 ng/ml per STAB3 e STAB1/2 rispettivamente) hanno causato cambiamenti morfologici drastici: la ramificazione delle gemme epiteliali era soppressa, le gemme si dilatavano enormemente fino a formare strutture simili a cisti, e c’era un’espansione eccessiva del tessuto epiteliale distale (più cellule SOX9+ e E-caderina+) a scapito di quello prossimale (meno cellule SOX2+ e αSMA+).
In pratica, l’FGF10 super-stabile mandava un segnale troppo forte e persistente, sbilanciando il delicato equilibrio tra proliferazione, differenziazione e ramificazione necessario per formare un polmone normale. Sembrava proprio un caso di segnalazione ectopica: il segnale arrivava dove non doveva o durava troppo a lungo.
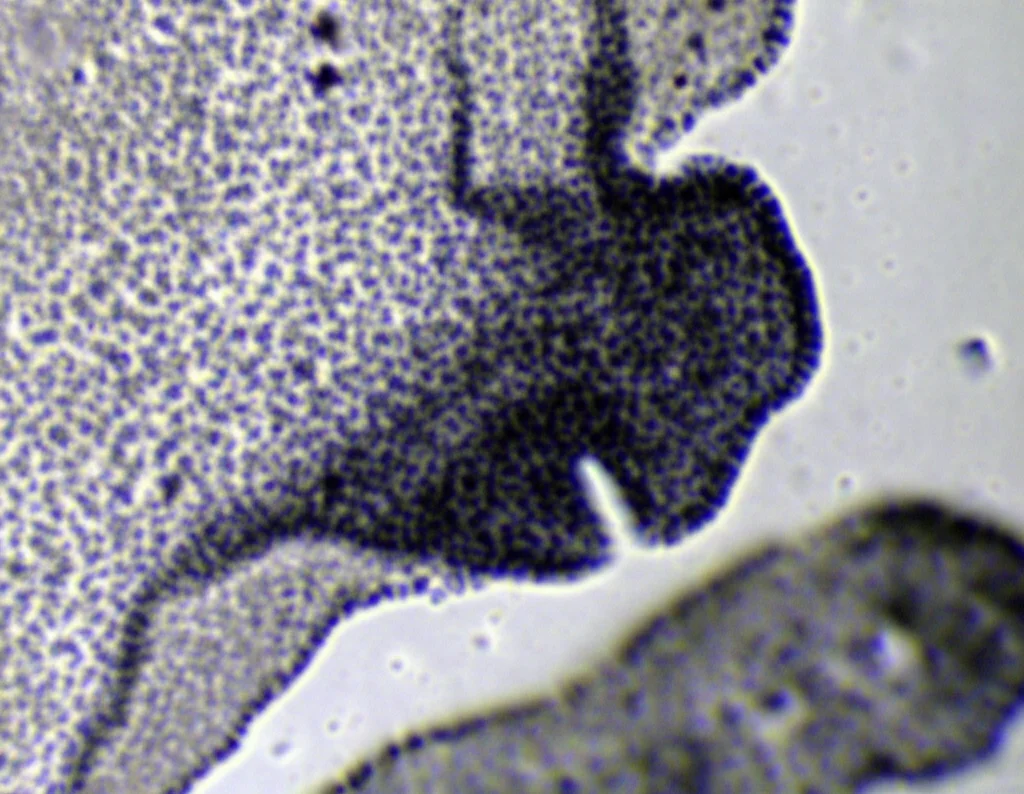
Effetti Indesiderati Anche Nello Sviluppo degli Arti
Non ci siamo fermati ai polmoni. FGF10 è essenziale anche per l’inizio dello sviluppo degli arti. Abbiamo impiantato delle piccole sfere imbevute di FGF10 (normale o STAB1) negli abbozzi alari di embrioni di pollo (stadio HH19-21). Dopo circa 10 giorni:
- Gli embrioni trattati con FGF10 wildtype non hanno mostrato anomalie.
- Ben il 22% degli embrioni trattati con FGF10-STAB1 presentava gravi deformità scheletriche: arti accorciati, soprattutto nelle ossa lunghe (omero, ulna, radio), e fusioni articolari.
Abbiamo anche coltivato ex vivo delle tibie embrionali di topo (E18). L’FGF10-STAB1 ha inibito significativamente la crescita ossea, mentre l’FGF10 wildtype ha avuto un effetto molto più debole e solo a concentrazioni più alte. Anche qui, la versione stabile sembrava “fare danni” segnalando in modo inappropriato.
E le Implicazioni per Noi Umani? Organoidi e Modelli di Danno Polmonare
Se da un lato la stabilità eccessiva causa problemi nello sviluppo, dall’altro potrebbe essere utile in contesti terapeutici? Abbiamo esplorato questa possibilità usando modelli più vicini alla biologia umana.
- Organoidi Polmonari Umani: Abbiamo differenziato cellule staminali pluripotenti indotte (iPSC) umane per formare mini-polmoni in provetta (organoidi). Trattandoli con FGF10-STAB1, abbiamo osservato una migliore differenziazione epiteliale (più E-caderina e SOX9) rispetto al trattamento con FGF10 wildtype o nessun trattamento.
- Modelli di Danno Polmonare Ex Vivo: Abbiamo usato fettine di polmone di topo (PCLS) in cui avevamo indotto un danno simile alla fibrosi o all’enfisema. Trattando queste fettine con FGF10-STAB2, abbiamo notato effetti rigenerativi potenziati rispetto all’FGF10 wildtype: ridotta tossicità cellulare nel modello fibrotico, limitata proliferazione associata alla fibrosi, e un aumento delle cellule progenitrici alveolari (ProSPC+) nel modello enfisematoso.
Questi risultati suggeriscono che, in un contesto di danno tissutale dove serve una spinta rigenerativa forte e duratura, un FGF10 stabilizzato potrebbe essere vantaggioso.
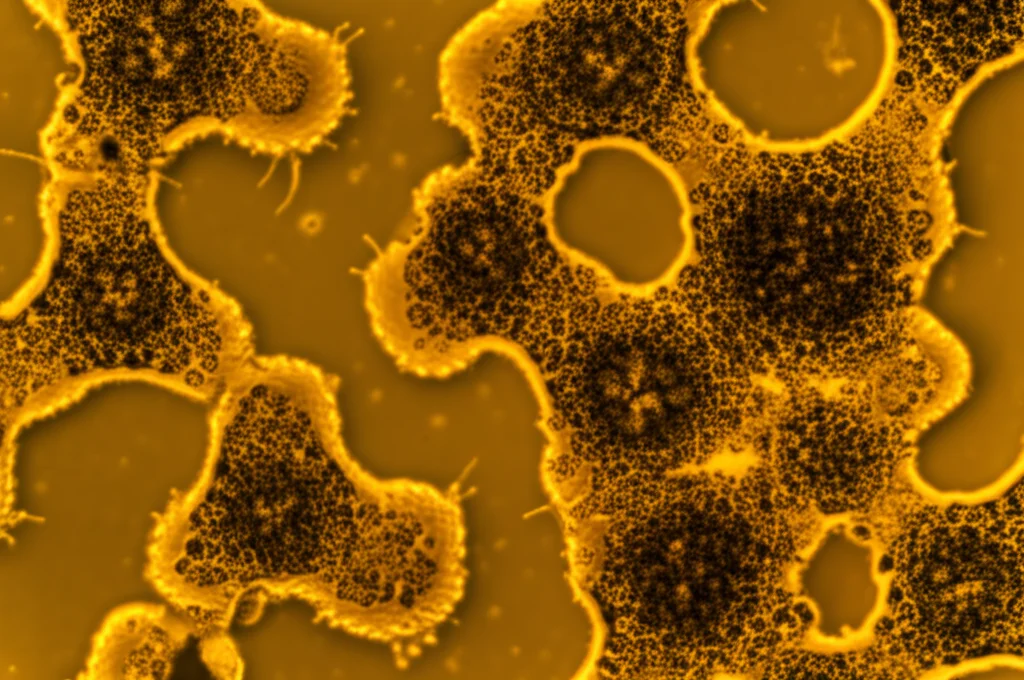
L’Instabilità Come Meccanismo di Sicurezza Naturale
Ma allora, perché FGF10 (e forse altri FGF) è così instabile in natura? È un difetto? I nostri risultati suggeriscono il contrario. L’instabilità termica sembra essere un meccanismo di controllo intrinseco, una sorta di “timer” molecolare che limita la portata e la durata del segnale FGF10.
Pensateci: durante lo sviluppo, i segnali devono essere incredibilmente precisi nello spazio e nel tempo. Un segnale che si diffonde troppo lontano o che persiste troppo a lungo può causare gravi difetti. Molti altri sistemi di segnalazione (come WNT o TGFβ/BMP) utilizzano antagonisti secreti, molecole che bloccano attivamente il segnale quando non è più necessario o dove non dovrebbe arrivare. Il sistema FGF sembra fare a meno di questi antagonisti esterni (almeno per la maggior parte), forse proprio perché molti dei suoi “messaggeri” hanno questa instabilità incorporata. Si “autodistruggono” prima di poter fare danni altrove. L’interazione con i proteoglicani sulla superficie cellulare può stabilizzare localmente gli FGF, permettendo loro di segnalare dove serve, ma la loro intrinseca fragilità impedisce una diffusione incontrollata.
Conclusioni e Prospettive Future
La nostra ricerca dimostra che la stabilità termica non è un dettaglio tecnico, ma un fattore cruciale che regola la funzione degli FGF, in particolare di FGF10, durante lo sviluppo. L’instabilità previene la segnalazione ectopica, garantendo che la morfogenesi di organi complessi come polmoni e arti avvenga correttamente.
Questa scoperta apre scenari affascinanti:
- Dobbiamo riconsiderare l’interpretazione delle funzioni di altri FGF instabili (come FGF8, un altro attore chiave dello sviluppo) alla luce della loro “fragilità”.
- Gli FGF10 stabilizzati che abbiamo creato, pur essendo problematici per lo sviluppo normale, mostrano un potenziale promettente per la medicina rigenerativa, specialmente per riparare danni polmonari. Potrebbero diventare strumenti preziosi per terapie cellulari o farmacologiche mirate a ripristinare la funzione polmonare.
Insomma, a volte, essere un po’ “instabili” è proprio la chiave per fare le cose per bene!
Fonte: Springer