Superbatteri K.O.? Ho Scoperto un’Arma Segreta che Li Disarma e Blocca la Resistenza!
Ciao a tutti! Oggi voglio parlarvi di una sfida che mi appassiona e mi tiene sveglio la notte: la lotta contro i batteri resistenti agli antibiotici. Sapete, quei “superbatteri” di cui si sente tanto parlare, che stanno diventando un incubo globale per la salute pubblica. Pensate che si stima che già oggi causino centinaia di migliaia di morti all’anno, e se non facciamo qualcosa, potrebbero diventare la principale causa di morte entro il 2050. Un vero disastro annunciato!
Il problema è particolarmente grave con alcuni ceppi, i cosiddetti patogeni ESKAPE (un acronimo che sta per Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa ed Enterobacter spp.). Questi sono dei veri campioni di resistenza e spesso ci lasciano con poche o nessuna opzione terapeutica. È una corsa contro il tempo per trovare nuove armi, nuovi antibiotici con meccanismi d’azione diversi, che possano aggirare le difese sempre più sofisticate di questi microrganismi, specialmente quelli Gram-negativi, che sono particolarmente tosti.
Negli ultimi anni, qualche progresso c’è stato, ma siamo onesti, la pipeline di nuovi antibiotici è quasi a secco. Ecco perché nel mio lavoro ho deciso di cambiare prospettiva. Invece di cercare molecole che uccidono direttamente i batteri (come fanno gli antibiotici classici, rischiando però di selezionare ancora più resistenze), mi sono chiesto: e se potessimo semplicemente disarmarli? Se potessimo renderli innocui, incapaci di causare infezioni e di evolvere resistenza, lasciando poi al nostro sistema immunitario il compito di eliminarli?
Un Bersaglio Astuto: La Proteina Mfd
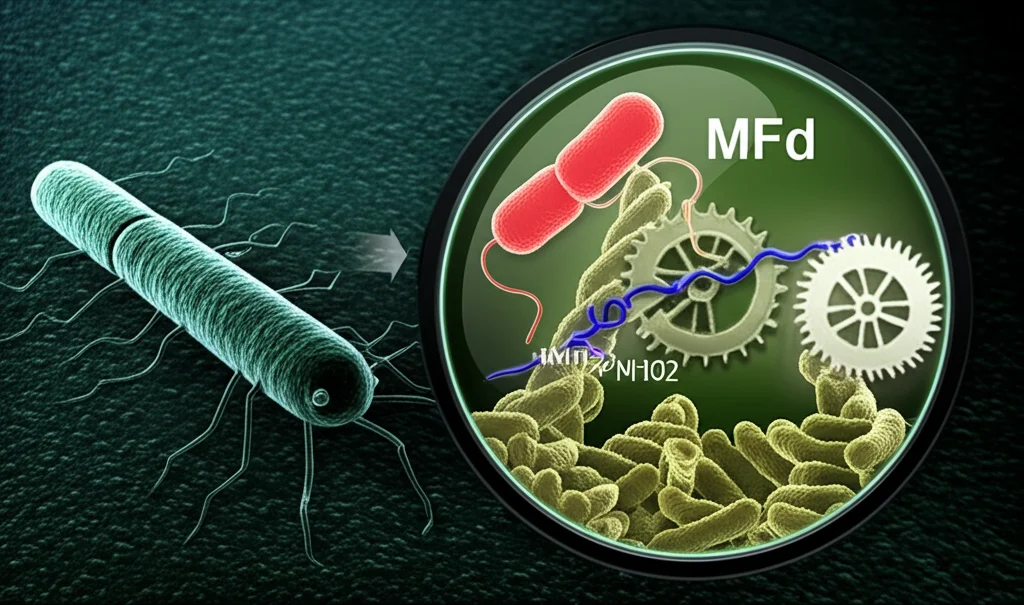
È qui che entra in gioco una proteina affascinante chiamata Mfd (Mutation Frequency Decline). Cosa fa questa Mfd? Beh, pensatela come un meccanico super specializzato all’interno della cellula batterica. Normalmente, non è essenziale per la sopravvivenza del batterio in condizioni tranquille. Ma quando le cose si mettono male, ad esempio durante un’infezione, quando il nostro sistema immunitario attacca con sostanze come l’ossido nitrico (NO) che danneggiano il DNA batterico, Mfd diventa cruciale.
Mfd è un fattore di accoppiamento trascrizione-riparazione. In pratica, riconosce quando l’RNA polimerasi (la macchina che legge il DNA per produrre proteine) si blocca a causa di un danno sul DNA. Usando l’energia derivata dall’ATP (la “benzina” delle cellule), Mfd spinge via la polimerasi e chiama a raccolta gli enzimi della riparazione del DNA. Un vero pronto intervento!
Ma non è tutto. Mfd ha anche un lato oscuro: è stata identificata come un “fattore di evolvibilità”. Sembra infatti che promuova le mutazioni nei batteri, specialmente sotto stress (come durante una terapia antibiotica), accelerando così lo sviluppo di nuove resistenze. Insomma, Mfd aiuta i batteri a:
- Sopravvivere agli attacchi del sistema immunitario riparando i danni al DNA.
- Evolvere più velocemente, diventando resistenti agli antibiotici.
La cosa fantastica è che Mfd è presente in tantissimi batteri, ma è assente negli eucarioti (come noi!). Questo la rende un bersaglio ideale: colpendola, dovremmo danneggiare i batteri patogeni senza toccare le nostre cellule. L’idea quindi è stata: troviamo una molecola che blocchi Mfd! Una molecola che non uccida i batteri direttamente, ma li renda vulnerabili al nostro sistema immunitario e incapaci di sviluppare resistenza. Una strategia anti-virulenza e anti-evolvibilità.

La Caccia alla Molecola Giusta: Nasce NM102
Come trovare questa molecola magica? Non potevamo usare i metodi classici basati sulla crescita batterica, perché Mfd non è essenziale in condizioni normali. Così, abbiamo optato per un approccio high-tech: uno screening in silico basato sulla struttura tridimensionale di Mfd. Conosciamo bene la tasca in cui Mfd lega l’ATP per ottenere energia. Abbiamo usato potenti computer per “testare” virtualmente milioni di composti chimici, cercando quelli che potessero incastrarsi perfettamente in questa tasca, meglio dell’ATP stesso, agendo da competitori.
Dopo questa massiccia ricerca virtuale, abbiamo selezionato 95 candidati promettenti. Li abbiamo testati in laboratorio per vedere se effettivamente inibivano l’attività ATPasica di Mfd (cioè la sua capacità di usare ATP). E voilà! Una molecola, che abbiamo chiamato NM102, si è distinta per la sua efficacia, inibendo l’attività di Mfd fino all’85%!
Abbiamo studiato NM102 più a fondo. Analisi più dettagliate (come gli esperimenti di calorimetria ITC) hanno confermato che NM102 si lega specificamente alla tasca dell’ATP di Mfd, con un’affinità addirittura maggiore dell’ATP stesso, e lo fa in modo competitivo. È come se occupasse il posto auto riservato all’ATP, impedendogli di parcheggiare e quindi bloccando il “motore” di Mfd. La struttura chimica di NM102 è interessante: assomiglia un po’ all’ATP, con anelli simili all’adenosina e al ribosio, ma con gruppi specifici che le permettono di legarsi così bene.
Ma NM102 è specifica per Mfd? Abbiamo verificato se inibisse altre proteine che usano ATP, sia batteriche che eucariotiche (incluse alcune molto simili a Mfd nella funzione). Risultato? NM102 ha mostrato una specificità notevole per Mfd, con effetti minimi o nulli sulle altre proteine testate. Questo è fondamentale per evitare effetti collaterali indesiderati. Studi computazionali (docking) hanno confermato questi dati, mostrando come NM102 si adatti perfettamente alla tasca di Mfd e interagisca con residui aminoacidici chiave, spiegando la sua alta affinità e specificità. Abbiamo anche simulato cosa succederebbe mutando questi residui chiave in Mfd: come previsto, né l’ATP né NM102 riuscivano più a legarsi correttamente, confermando ulteriormente il meccanismo d’azione.

NM102 in Azione: Dalla Provetta agli Animali
Ok, NM102 blocca Mfd in provetta. Ma funziona contro le infezioni reali? Ricordate, l’idea è che NM102 sia attiva solo quando Mfd è necessaria, cioè sotto stress. Abbiamo testato NM102 su batteri patogeni come Klebsiella pneumoniae, Pseudomonas aeruginosa ed E. coli (tutti membri della lista ESKAPE o comunque clinicamente rilevanti).
In condizioni normali, senza stress, NM102 non aveva alcun effetto sulla crescita batterica. Ma quando abbiamo simulato lo stress immunitario aggiungendo un donatore di ossido nitrico (NO), ecco che NM102 ha mostrato la sua attività antimicrobica, inibendo la sopravvivenza dei batteri! Questo conferma la nostra ipotesi: NM102 agisce specificamente in condizioni che mimano l’ambiente di un’infezione.
Il passo successivo era testare NM102 in vivo. Abbiamo iniziato con un modello semplice: le larve del baco da seta (Bombyx eri) infettate con P. aeruginosa. Il trattamento con NM102 ha ridotto drasticamente la carica batterica nelle larve! E, cosa importantissima, quando abbiamo usato un ceppo di P. aeruginosa a cui avevamo tolto il gene Mfd (mutante Δmfd), NM102 non aveva più alcun effetto. Questo è la prova del nove che NM102 agisce specificamente attraverso Mfd anche in vivo. Interessante notare che NM102 riduceva la carica batterica del ceppo normale allo stesso livello basso osservato con il mutante Δmfd, suggerendo che l’inibizione di Mfd fosse completa.
Poi siamo passati a un modello più complesso e rilevante: l’infezione polmonare nei topi con K. pneumoniae e P. aeruginosa. Qui abbiamo dovuto superare un ostacolo: NM102 è poco solubile in acqua. Abbiamo quindi sviluppato una nanoformulazione, incapsulando NM102 in nanoparticelle di PLGA (un polimero biocompatibile e approvato dalla FDA). Questa formulazione acquosa era stabile e adatta alla somministrazione negli animali.
I risultati sono stati entusiasmanti! Nei topi infettati con K. pneumoniae, la somministrazione della nanoformulazione di NM102 ha ridotto significativamente la carica batterica nei polmoni, in modo dose-dipendente. A dosi più alte, l’efficacia era paragonabile a quella del meropenem, un antibiotico carbapenemico comunemente usato. Ma la vera sorpresa è arrivata con un ceppo di K. pneumoniae resistente al meropenem: mentre l’antibiotico era inefficace, NM102 ha funzionato alla grande, riducendo notevolmente l’infezione! Questo dimostra il potenziale di NM102 contro i superbatteri resistenti. Anche qui, abbiamo confermato la specificità: NM102 non aveva effetto sul mutante Δmfd di K. pneumoniae.
Abbiamo anche testato NM102 in combinazione con meropenem contro P. aeruginosa. Sebbene NM102 da sola avesse un effetto modesto in questo modello, la combinazione dei due è stata potentissima, riducendo la carica batterica molto più dei singoli trattamenti. Questo suggerisce un possibile uso di NM102 come adiuvante per potenziare gli antibiotici esistenti.

Un Approccio più Gentile: Sicurezza e Microbiota
Un aspetto cruciale nello sviluppo di nuovi farmaci è la sicurezza. Abbiamo testato la tossicità di NM102 (sia la molecola pura che la nanoformulazione) su cellule umane (HeLa) e di scimmia (Vero). Alle concentrazioni efficaci (e anche più alte), NM102 non ha mostrato citotossicità significativa. Anche negli animali (larve e topi), il trattamento con NM102 non ha causato mortalità o perdita di peso. Il PLGA usato per la nanoformulazione è già ampiamente utilizzato e considerato sicuro.
Ma c’è un altro vantaggio potenziale enorme della nostra strategia. Gli antibiotici tradizionali sono armi potenti ma poco selettive: uccidono i patogeni, ma spesso fanno piazza pulita anche dei batteri buoni che compongono il nostro microbiota intestinale, con conseguenze negative sulla salute. Poiché NM102 agisce solo in condizioni di stress (come l’infiammazione localizzata nel sito d’infezione) e colpisce una proteina non essenziale in condizioni normali, abbiamo ipotizzato che potesse risparmiare il microbiota intestinale.
Per verificarlo, abbiamo analizzato la composizione del microbiota fecale dei topi dopo infezione polmonare e trattamento con NM102. I risultati sono stati fantastici: il trattamento con NM102 non ha alterato significativamente la diversità o la struttura del microbiota intestinale rispetto ai topi non trattati! Al contrario, sappiamo che antibiotici come la streptomicina possono devastare il microbiota. Questo rende NM102 un candidato “microbioma-friendly”, un vantaggio non da poco. Certo, in caso di infezioni intestinali, dove ci sarebbe infiammazione locale, l’effetto potrebbe essere diverso, ma per infezioni in altri distretti, questo approccio sembra molto promettente per ridurre i danni collaterali.
Fermare l’Evoluzione: L’Effetto Anti-Evolvibilità
Ricordate l’altro ruolo di Mfd, quello di “fattore di evolvibilità” che accelera la comparsa di resistenze? Ci siamo chiesti se NM102 potesse bloccare anche questa funzione. Abbiamo misurato la frequenza con cui E. coli sviluppava mutazioni spontanee che conferivano resistenza a un antibiotico (rifampicina). Come previsto, il mutante Δmfd aveva una frequenza di mutazione molto più bassa del ceppo normale. Ebbene, trattando il ceppo normale con NM102, la frequenza di mutazione si è ridotta significativamente, raggiungendo livelli simili a quelli del mutante Δmfd! Ancora una volta, NM102 non aveva effetto sul mutante, confermando la sua specificità.
Abbiamo poi fatto un esperimento di “evoluzione diretta”: abbiamo esposto E. coli a concentrazioni crescenti di antibiotici (rifampicina e streptomicina) per diversi giorni, simulando quello che succede durante una terapia, e abbiamo visto quanto velocemente si sviluppava la resistenza. In presenza di NM102, l’evoluzione della resistenza è stata significativamente rallentata (fino a 8 volte più lenta per la rifampicina)!
Questo è un risultato potentissimo! NM102 non solo aiuta a combattere l’infezione rendendo i batteri più vulnerabili, ma agisce anche come un “freno evolutivo”, rallentando la capacità dei batteri di adattarsi e diventare resistenti agli antibiotici. Questo duplice meccanismo d’azione è ciò che rende questo approccio così innovativo e promettente. Potrebbe dare agli antibiotici esistenti una nuova vita, rendendoli più efficaci e più a lungo.

Verso il Futuro: Una Nuova Speranza Contro i Superbatteri
Insomma, il nostro lavoro ha identificato e caratterizzato NM102, una molecola che inibisce la proteina batterica Mfd. Abbiamo dimostrato che NM102 ha una doppia azione:
- Agisce come antimicrobico in condizioni di infezione, rendendo i batteri (anche quelli resistenti) vulnerabili alle difese dell’ospite.
- Agisce come anti-evolvibilità, riducendo la capacità dei batteri di sviluppare resistenza agli antibiotici.
Questa molecola si è dimostrata efficace in vivo contro patogeni ESKAPE Gram-negativi clinicamente rilevanti, sia da sola che in combinazione con antibiotici esistenti. Inoltre, sembra essere sicura per le cellule ospiti e, cosa importantissima, non danneggia il microbiota intestinale.
Certo, la strada verso un farmaco utilizzabile nell’uomo è ancora lunga e richiederà ulteriori studi e ottimizzazioni. Ma i risultati sono estremamente incoraggianti. Targeting di fattori non essenziali come Mfd, che sono coinvolti nella virulenza e nell’evolvibilità, rappresenta un cambio di paradigma nella lotta all’antibiotico-resistenza. Potrebbe offrirci nuove armi terapeutiche più mirate, più durature e con minori effetti collaterali.
Sono convinto che molecole innovative come NM102 possano davvero espandere il nostro arsenale contro i superbatteri e darci una nuova speranza in questa battaglia cruciale per la salute globale. È una ricerca che mi entusiasma e spero di avervi trasmesso un po’ di questa passione!
Fonte: Springer