EXO1: Il Regista Inatteso della Danza dei Cromosomi nella Meiosi
Ciao a tutti, appassionati di scienza! Oggi voglio portarvi nel cuore pulsante delle nostre cellule, in un processo tanto fondamentale quanto affascinante: la meiosi. Avete mai pensato a come si formano le cellule riproduttive, come ovuli e spermatozoi? È un balletto molecolare incredibilmente preciso, dove i cromosomi si scambiano pezzi di DNA per creare nuove combinazioni genetiche. Questo scambio, chiamato crossover, è essenziale per la diversità genetica e per garantire che i cromosomi si separino correttamente. Senza di esso, potremmo avere seri problemi di fertilità o malattie genetiche.
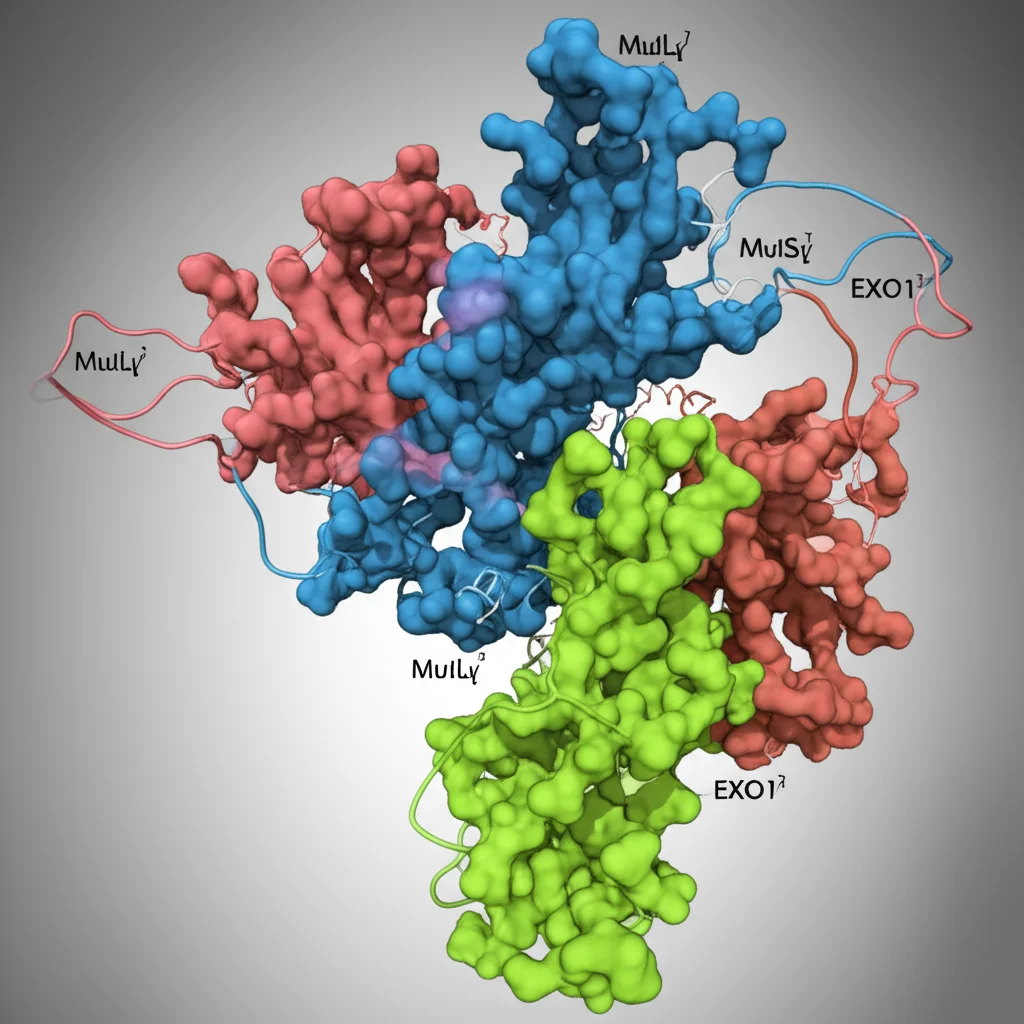
Il Team del Taglio Preciso: MutLγ e i Suoi Aiutanti
Al centro di questo processo c’è un complesso proteico chiamato MLH1-MLH3 (o MutLγ, per gli amici). Immaginatelo come delle forbici molecolari super specializzate, il cui compito è tagliare il DNA nei punti giusti per creare i crossover. Ma MutLγ non lavora da solo. Ha bisogno di una squadra di aiutanti per essere attivato e guidato. Tra questi ci sono MSH4-MSH5 (MutSγ), che riconosce le strutture intermedie della ricombinazione (le famose giunzioni di Holliday, o dHJs), e il complesso RFC-PCNA, una sorta di morsetto scorrevole che aiuta a posizionare le proteine sul DNA.
EXO1: L’Enigma nel Meccanismo
E poi c’è EXO1. Per molto tempo, il suo ruolo preciso in questo specifico contesto è stato un po’ un mistero. Sappiamo che EXO1 è un “tuttofare” del DNA: è una nucleasi, cioè sa tagliare il DNA (specificamente, mangiucchia le estremità 5′ dei filamenti), ed è coinvolta in vari processi, dalla riparazione degli errori di replicazione (Mismatch Repair, MMR) alla fase iniziale della ricombinazione meiotica, dove aiuta a “rosicchiare” le estremità del DNA rotto.
Ma nella fase finale della meiosi, quella della creazione dei crossover dipendenti da MutLγ, EXO1 sembra avere un ruolo diverso, indipendente dalla sua capacità di tagliare il DNA. Studi precedenti, sia nel lievito che nei mammiferi, avevano mostrato che topi senza EXO1 sono sterili, ma topi con una versione di EXO1 incapace di tagliare (nuclease-dead) sono fertili! Questo suggeriva che EXO1 facesse qualcosa di strutturale, non enzimatico, per aiutare MutLγ. Si sapeva anche che EXO1 interagisce direttamente con MLH1 (una delle due subunità di MutLγ) tramite una piccola sequenza chiamata motivo MIP. Ma bastava questo a spiegare tutto?
Indagini Approfondite: L’Interazione con MLH1 Non Basta
Per capirci di più, abbiamo deciso di “smontare” e ricostruire questo meccanismo in provetta, usando proteine umane purificate. Abbiamo creato versioni mutate di EXO1, specificamente alterando il motivo MIP e un’altra zona che i modelli computerizzati (grazie AlphaFold2!) suggerivano potesse interagire con MLH1 (attorno all’aminoacido I403).
E qui la sorpresa: anche bloccando pesantemente l’interazione fisica tra EXO1 e MLH1, l’attivazione delle “forbici” MutLγ da parte di EXO1 era solo parzialmente ridotta! Era come scoprire che l’interruttore principale che pensavamo controllasse la luce, in realtà ne comandava solo una parte. Doveva esserci qualcos’altro.
La Scoperta Chiave: EXO1 Parla Anche con MutSγ!
La nostra attenzione si è spostata su MutSγ (MSH4-MSH5). Poteva essere che EXO1 interagisse anche con questo complesso? Abbiamo fatto esperimenti di “pulldown” (dove si usa una proteina come “esca” per vedere cosa “pesca”) e… bingo! Abbiamo dimostrato che EXO1 interagisce direttamente con MutSγ, e in particolare con la subunità MSH4.
Abbiamo poi cercato di capire quale parte di EXO1 fosse responsabile di questo nuovo legame. Tagliando via pezzi della lunga coda C-terminale di EXO1 (che è in gran parte disordinata), abbiamo scoperto che una piccola regione, subito dopo il dominio nucleasico strutturato (precisamente gli aminoacidi 353-390), era assolutamente essenziale. Se toglievamo questa parte, EXO1 perdeva quasi completamente la capacità di stimolare MutLγ, pur mantenendo intatta la sua capacità di legare il DNA!
All’interno di questa regione cruciale, abbiamo identificato un gruppetto di aminoacidi conservati tra i vertebrati. Grazie ancora ai modelli di AlphaFold2, abbiamo ipotizzato che questi interagissero con una specifica zona di MSH4. E le mutazioni puntiformi hanno confermato tutto: modificando un singolo aminoacido in EXO1, il triptofano 371 (W371E), abbiamo completamente annullato la sua capacità di attivare MutLγ-MutSγ, senza minimamente intaccare la sua funzione di nucleasi! Era la prova definitiva che questa interazione EXO1-MSH4 era fondamentale.
Non Solo Interazioni Proteiche: L’Importanza di Tenersi Stretti al DNA
Quindi, EXO1 interagisce con MLH1 (anche se meno criticamente di quanto pensassimo) e, cosa fondamentale, con MSH4. Ma c’è un terzo elemento essenziale: il DNA stesso. Abbiamo visto che la capacità di EXO1 di legarsi al DNA a doppia elica (dsDNA) è importante per la sua funzione di attivatore.
Abbiamo testato mutanti di EXO1 incapaci di coordinare gli ioni magnesio (Mg2+), essenziali per la sua attività di taglio (come D78A e D173A). Come previsto, questi mutanti non tagliavano più il DNA, ma stimolavano MutLγ-MutSγ altrettanto bene della proteina normale! Questo conferma che la funzione di taglio di EXO1 non serve qui.
Invece, quando abbiamo mutato due aminoacidi (K185D, K237D) che, secondo la struttura cristallografica, sono importanti per il contatto diretto con il DNA, abbiamo visto una riduzione significativa della capacità di EXO1 di stimolare MutLγ-MutSγ. È interessante notare che MutLγ e MutSγ legano preferenzialmente le giunzioni di Holliday ma hanno un’affinità più debole per il DNA a doppia elica “normale”, mentre EXO1 si lega al dsDNA piuttosto bene.
Un Nuovo Modello: EXO1 come “Graffetta” Molecolare
Mettendo insieme tutti i pezzi, emerge un modello affascinante. EXO1 non agisce principalmente come un enzima in questa fase, ma come una componente strutturale essenziale del complesso di risoluzione dei crossover. La sua funzione sembra essere quella di agire come una sorta di “graffetta” o “ponte” molecolare.
Ecco come potrebbe funzionare:
1. MutSγ riconosce la giunzione di Holliday (l’intermedio della ricombinazione).
2. MutLγ viene reclutato sul posto.
3. EXO1 entra in gioco, stabilizzando l’intero complesso. Lo fa interagendo contemporaneamente con:
* MLH1 (di MutLγ)
* MSH4 (di MutSγ) – questa interazione è cruciale!
* Il DNA a doppia elica vicino alla giunzione.
4. Questa triplice interazione aiuta a “tenere fermo” il complesso MutSγ-MutLγ sul DNA, posizionando le “forbici” di MutLγ nel punto giusto per tagliare e creare il crossover.
È un meccanismo elegante che spiega perché la funzione strutturale di EXO1, e non quella di taglio, sia così importante in questo contesto, almeno negli esseri umani. Curiosamente, l’interazione EXO1-MSH4 che abbiamo identificato sembra conservata nei vertebrati ma non nel lievito, suggerendo che potrebbero esserci delle differenze nel modo in cui questo processo è regolato tra diverse specie.

Questa scoperta non solo ci aiuta a capire meglio i dettagli molecolari di un processo biologico fondamentale come la meiosi, ma potrebbe anche avere implicazioni per comprendere alcune cause di infertilità umana legate a mutazioni in questi fattori di ricombinazione. La danza dei cromosomi è complessa, e ogni partner ha un ruolo ben definito, anche quelli che, come EXO1, ci riservano ancora delle sorprese!
Fonte: Springer